Химия: изменчивая история - Chemistry: A Volatile History - Wikipedia
| Химия: изменчивая история | |
|---|---|
| Жанр | История науки |
| Представлено | Джим Аль-Халили |
| В главных ролях | Андреа Селла |
| Передал | Джим Аль-Халили |
| Композитор | Тай Анвин |
| Исходный язык | английский |
| Нет. серии | 1 |
| Нет. эпизодов | 3 |
| Производство | |
| Исполнительный продюсер | Саша Бейсток |
| Продолжительность | 60 минут |
| Производственная компания | BBC |
| Релиз | |
| Исходная сеть | BBC Четыре |
| Формат изображения | 16:9 1080i |
| Аудио формат | Стерео |
| Оригинальный выпуск | 21 января – 4 февраля 2010 г. |
| внешняя ссылка | |
| Интернет сайт | |
Химия: изменчивая история 2010 год BBC документальный фильм о история химии представленный Джим Аль-Халили. Он был номинирован на 2010 Премия Британской академии телевидения в категории Специалист по фактам.
Эпизод 1: Открытие элементов
Вступление
Только за последние 200 лет мы узнали, что такое элемент есть - вещество, которое не может быть далее разбито химическая реакция.
Древние греки, не имея возможности взламывать субстанции, могли основывать свои идеи об элементах только на том, что они могли видеть: Земля, Огонь, Вода и Воздух.
В 16 веке алхимики были заняты превращением неблагородных металлов, таких как свинец, в золото.
Парацельс и триа прима
Это был швейцарский алхимик и хирург. Парацельс кто первым бросил вызов древнегреческой идее четыре элемента.
В 1526 году Парацельс был в Базеле, когда знаменитый печатник Фробениус Ему сказали, что ему придется ампутировать ногу в ходе операции по спасению жизни. Вместо того чтобы принять полученную мудрость, он призвал Парацельса, который вылечил его нетрадиционным способом, используя свои алхимические знания. Это сделало его радикальным мыслителем, придавшим вес его идеям, главной из которых была идея о том, что мир на самом деле состоит из трех элементов: триа прима в составе соли, серы и ртути.
Парацельсу не удалось убедить истеблишмент - вместо этого он сумел привести их в ярость, сжег их установленные медицинские тексты, и в конечном итоге был вынужден бежать из Швейцарии в Германию.
Однако именно алхимическая погоня за золотом привела к первому прорыву в охоте за новыми элементами.
Хенниг Бренд и ледяная ноктилука
В 1669 г. Хенниг Бренд искал способ извлечения золото от человеческого тела, и пришел к идее использования мочи, думая, что моча может содержать некоторую часть «жизненной силы», жизненно важной для поддержания человеческой жизни. Чтобы избавиться от неважных частей, в первую очередь от воды, Бранд кипятил мочу в течение нескольких дней, пока не осталась густая паста. Наконец, появились фрагменты вещества, которое горело ярче, чем любая средневековая свеча, доступная в то время, но оставившее сосуд сгоревшим на холоде: Бранд назвал это новое вещество ледяная ноктилука - «холодный ночник».
Вскоре после своего открытия ледяная ноктилука посетила Королевские дома Европы, а в 1677 г. Королевское общество в Лондоне, затем под председательством Карл II, где один из ее членов решил провести расследование.
В его книге Новые эксперименты и наблюдения, сделанные на ледяной ноктилуке Роберт Бойл описывает эксперимент, в котором порошки серы и фосфора смешиваются, вызывая сильное горение. Это открытие легло в основу изобретения спички.
Фосфор, как теперь известна ледяная ноктилука, используется во всем, от спичечных головок до зубной пасты и, в конечном счете, в бомбах времен Второй мировой войны, которые разрушили тот самый город, в котором Бранд обнаружил ее, - Гамбург.
Хотя Бранд так и не открыл золото, его случайное открытие элемента, теперь известного как фосфор, породило идею о том, что элементы могут быть спрятаны внутри других веществ.
Роберт Бойл и Скептический химик
Более чем за десять лет до того, в 1661 году, через год после открытия Королевского общества, Бойль сдал на хранение Скептический химик в его подвалах. Эта книга обычно рассматривается как поворотный момент, ознаменовавший переход от алхимии к химии. Скептический химик был новаторским в нескольких отношениях: он был написан не на латыни, как это было традицией для алхимических книг, а на английском языке; он обошелся без старого химические символы для различных элементов использовать вместо них английские названия; и, что самое главное, это было действительно опубликовано, а не держалось в секрете.
Бойль был готов поделиться своими открытиями, чтобы позволить другим развивать его работу и способствовать научному пониманию элементов. Он хотел поставить алхимию на более научную основу, отказавшись от метафизического багажа, который она принесла с собой из прошлого века.
К сожалению, этот новый век химического просвещения был полон тупиков.
Иоганн Бехер и флогистон
В 1667 году немецкий ученый Иоганн Беккер предположил, что пожар был вызван эфирным, без запаха, вкуса, цвета, невесомостью сущностью, называемой флогистон. Идея заключалась в том, что флогистон заставляет вещи гореть, превращая их в чистую форму. Например, при сжигании древесины высвобождается флогистон, и остается чистая форма древесины - зола, поэтому древесина состоит из ясеня (чистого дерева) и флогистона.
Флогистон был принят как научная истина, что парализовало способность научного сообщества открывать больше истинных элементов. Один ученый даже утверждал, что выделил флогистон.
Генри Кавендиш и легковоспламеняющийся воздух
Крупный акционер Банк Англии с королевскими связями, Генри Кавендиш был болезненно застенчивым персонажем, внесшим жизненно важный химический вклад в открытие первого элементарного газа.
Он добавил немного цинка в солевой спирт (соляная кислота ) и собирал испарения в виде пузырьков. Собранный им газ был без вкуса, запаха и цвета, и, кроме того, он издавал скрипучий хлопок в присутствии пламени - это побудило Кавендиша назвать газ легковоспламеняющийся воздух, который он считал одним и тем же флогистоном.
Кавендиш, хотя и не осознавал этого, сделал важное наблюдение о горении флогистона в воздухе; На внутренней стороне стеклянной посуды образовалась влажная жидкость: воды. Это должно было иметь огромные последствия для всего научного сообщества 1700-х годов, которое все еще считало воду элементарным веществом. Но если бы вода могла быть сделали при сжигании легковоспламеняющегося воздуха вода нет элемент, но сложный.
Однако Кавендишу просто не пришло в голову, что вода представляет собой соединение - вместо этого он предположил, что воздух содержит форму воды, которую флогистон преобразовал в жидкую элементарную воду.
Флогистон дал древнегреческому представлению о воде как элементе краткую отсрочку, но греческая система теперь подвергалась тщательному изучению, поскольку Королевское общество поручило своим членам исследовать невидимый воздух.
Джозеф Пристли и дефлогистический воздух
К середине 1700-х годов было три известных «эфира»:
- Общий воздух - воздух, которым мы дышим;
- Легковоспламеняющийся воздух Кавендиша;
- Фиксированный воздух.
Именно этот последний воздух привлек внимание Джозеф Пристли, министр-унитарий, чьим любимым занятием было исследование воздуха, в частности неподвижного воздуха, выделяемого в процессе брожения на пивоварнях.
Страсть Пристли к науке привела к приглашению Bowood House, чтобы обучать детей Лорд Шелберн. Это была прекрасная возможность, учитывая, что у Пристли не было денег, как у химиков прошлого, таких как Бойл и Кавендиш, и он все еще мог проводить свои собственные исследования.
В 1774 году Пристли провел чрезвычайно важный эксперимент: он нагрел ртутный кальций и собрал выделяющийся газ. Он обнаружил, что этот газ может снова зажечь угли ранее зажженной деревянной шины. Он пришел к выводу, что шина вводила флогистон в газ, только после чего он мог гореть, поэтому газ должен быть «без флогистона» - это побудило Пристли назвать его дефлогистированный воздух.
В октябре 1775 года Пристли сопровождал лорда Шелбурна в поездке в Париж, где их пригласили отобедать с выдающимися учеными того времени. Именно здесь Пристли познакомился с французским ученым. Антуан Лавуазье.
Антуан Лавуазье и конец флогистона
Пристли рассказал Лавуазье все подробности своих экспериментов по производству дефлогистированного воздуха. В отличие от Пристли, у Лавуазье была одна из самых оснащенных лабораторий в Европе, и теперь он обратил свое внимание на высокоточное измерение масс веществ до и после их нагрева.
Лавуазье взвесил образец олова, затем снова взвесил после того, как он нагрел его и обнаружил, что его масса увеличилась. Это был неожиданный результат, учитывая, что считалось, что олово выделяет флогистон в процессе горения. Лавуазье пришла в голову новаторская мысль - может быть, олово поглотило что-то из воздуха, сделав его тяжелее, но если да, то что?
Чтобы исследовать это дальше, Лавуазье повторил эксперимент Пристли в обратном порядке: он нагрел ртуть в герметичном контейнере до тех пор, пока она не превратилась в ртуть, и измерил количество абсорбированного воздуха. Затем он нагрел ртутный кальций и измерил количество выпущенного воздуха и обнаружил, что количество такое же. Лавуазье понял, что что-то абсорбируется из воздуха, когда ртуть нагревается для образования ртути, и этот же газ выделяется, когда ртуть нагревается. Лавуазье пришел к выводу, что этот газ не имеет отношения к флогистону, но на самом деле представляет собой совершенно новый элемент, который он назвал кислород.
Лавуазье успешно избавился от необходимости в теории флогистона и признал «дефлогистированный воздух» Пристли элементом кислорода. Несмотря на то, что основа его открытия была заложена оригинальной работой Пристли, Лавуазье утверждал, что открыл кислород; В конце концов, Пристли не смог распознать это как новый элемент.

Лавуазье дал науке первое определение элемента: вещество, которое не может быть разложено существующими химическими средствами. Он также приступил к составлению списка всех элементов - теперь 33 элемента заменили древние четыре. Его список был разделен на четыре категории: газы, неметаллы, металлы и земли.
Вдобавок к этому Лавуазье создал систему классификации постоянно растущего числа обнаруживаемых химических веществ. Как уже упоминалось, «дефлогистированный воздух» стал кислород, «Горючий воздух» стал водород, но номенклатура соединений также получила более логичную основу, поскольку «купоросное масло» превратилось в серную кислоту, «философская шерсть» стала оксидом цинка, а «вяжущий марс-шафран» превратился в оксид железа.
К сожалению, в то время как Лавуазье избавил мир от парадигмы флогистона, он ввел два новых ошибочных элемента, которые теперь известны как чистая энергия: люмьер и калорик; свет и тепло.
В мести за свои симпатии к революционерам во Франции, дом Пристли в Англии был атакован поджигателями в 1791 году. К счастью, он сбежал благодаря наводке, но решил бежать в Америку. Вклад Лавуазье в науку был прерван в 1794 году революционерами, которые арестовали его за то, что он враг французского народа, и приговорили к гильотине.
Хамфри Дэви и поташ
В 1807 году профессором химии в Королевском институте в Лондоне был корнуолл. Хэмфри Дэви. Он исследовал кристаллические соли поташ поскольку он не был убежден в том, что калий является элементом, но к концу прошлого века Лавуазье был не в состоянии разбить его дальше.
Однако с тех пор первые электрическая батарея были изобретены недавно (ряды металлических пластин и картона, пропитанные соленой водой). Хотя ученые знали, что производство постоянного электрического тока происходит из-за некоторых свойств металлов, Дэви полагал, что имеет место химическая реакция. Если это правда, то, возможно, верно и обратное: электрический ток может вызвать химическую реакцию.
Дэви нагрел поташ до тех пор, пока он не станет жидким, затем ввел два электрода и пропустил ток через расплавленный калий. Наблюдалось лиловое пламя, результат успешного разложения поташа на составляющие элементы, одним из которых был ранее невиданный элемент. калий.
Дэви добавил шесть новых элементов в список Лавуазье, а также подтвердил, что такие вещества, как хлор и йод также были элементы. К моменту его смерти в 1829 году идея элементов была прочно обоснована, было открыто 55 отдельных элементов, и в мире появилась новая наука: Химия.
Эпизод 2: Орден стихий
Вступление
В начале XIX века было обнаружено только 55 из 92 природных элементов. Ученые не имели ни малейшего представления о том, сколько еще они могли бы найти, и действительно ли существует бесконечное количество элементов. Они также стремились ответить на фундаментальный вопрос, а именно: есть ли узор в элементах?
Атомы Джона Далтона

Ученые недавно обнаружили, что, когда элементы объединяются в соединения, они всегда образуют одни и те же пропорции по весу. Джон Далтон думал, что для этого каждый элемент должен состоять из своих уникальных строительных блоков, которые он назвал атомы.
Дальтон предположил, что все во Вселенной состоит из атомов и что существует столько же видов атомов, сколько и элементов, каждый со своим собственным весом сигнатуры. Основываясь на этих идеях, работая в полном одиночестве, Далтон попытался наложить некоторый порядок на элементы, составив список, в котором каждый элемент был представлен алхимическим символом, упорядоченным по атомный вес.
Хотя Далтон не определил все свои атомные веса правильно, он указал науке в правильном направлении. К сожалению, в начале 1800-х годов немногие ученые приняли идею о том, что элементы имеют разный вес.
Йенс Якоб Берцелиус в поисках атомных весов
Шведский ученый Йенс Якоб Берцелиус был одним из немногих ученых, которые твердо верили в идею атомного веса и считали, что знать как можно больше об их весе жизненно важно. Услышав о теории Дальтона, он приступил к гигантской задаче измерения атомного веса каждого известного элемента без каких-либо доказательств того, что атомы Дальтона действительно существуют.
Это было даже сложнее, чем кажется на первый взгляд, если учесть тот факт, что было изобретено очень мало химической посуды, необходимой для таких точных измерений. Большую часть этого Берцелиус должен был изготовить сам.
Опыт Берцелиуса с выдуванием стекла имел дополнительный бонус: в 1824 году он обнаружил, что одним из компонентов стекла был новый элемент - кремний. Уже открыв три других элемента до кремния: торий, церий и селен Следующие десять лет Берцелиус провел, одержимо измеряя более двух тысяч химических соединений в поисках точных атомных весов элементов. В конце концов Берцелиус получил удивительно точные атомные веса для 45 элементов; его значение для хлора было с точностью до 0,2% от значения, которое мы знаем сегодня.
Однако к тому времени, когда Берцелиус представил свои результаты, другие ученые уже измеряли атомный вес - и получали противоречивые результаты. Фактически, ученые искали всевозможные узоры во всех элементах.
Триады Иоганна Доберейнера
Одним из таких охотников за образцами был немецкий химик. Иоганн Дёберейнер. Он считал, что ключ к пониманию элементов лежит не в их атомном весе, а в их химических свойствах. Он заметил, что часто можно выделить три элемента, обладающих схожими свойствами, например щелочные металлы, которые он назвал триады.
Проблема заключалась в том, что Триады Доберейнера работал только с некоторыми элементами и не дал ученым больше, чем атомный вес.
Дмитрий Менделеев переезжает в Санкт-Петербург
В 1848 году огромный пожар уничтожил фабрику вдовы Марии Менделеевой. Столкнувшись с нищетой, она решила отправиться в 1300-мильное путешествие из Западной Сибирь к Санкт-Петербург - пешком значительную часть маршрута - так сын Дмитрий Менделеев мог продолжить образование в столице Российская империя.
В то время научное сообщество решало проблему, как навести порядок в 63 элементах, которые теперь были известны. Менделеев был еще студентом, когда посещал первый в мире международный химический конгресс - созваны, чтобы разрешить путаницу вокруг атомных весов.
Стандарт Станислао Канниццаро для измерения атомного веса
Сицилийский химик Станислао Канниццаро все еще был убежден, что атомные веса являются ключом к порядку элементов, и нашел новый способ их измерения. Канниццаро знал, что равные объемы газов содержат равное количество частиц, поэтому вместо работы с твердыми телами и жидкостями и всей связанной с этим ненадежностью он предложил измерять плотности газов для измерения веса отдельных газообразных атомов.
В то время как результаты Берцелиуса никого не убедили, метод Канниццаро установил согласованный стандарт точного измерения атомного веса. Вскоре химики обнаружили, что даже при точном атомном весе элементы все еще кажутся неупорядоченными, но затем одинокий английский химик сделал любопытное открытие.
Октавы Джона Ньюлендса

В 1863 г. Джон Ньюлендс заметили, что при упорядочении по весу каждый восьмой элемент, казалось, обладал сходными свойствами, такими как углерод и кремний в последовательности: углерод, азот, кислород, фтор, натрий, магний и кремний. Он назвал это Закон октав.
Три года спустя, в 1866 году, он представил свои идеи Химическое общество к сожалению для Ньюлендса, музыкальная аналогия не была хорошо принята - аудитория предположила, что он с таким же успехом мог расположить элементы в алфавитном порядке.
Сегодня октавы Ньюлендса известны как Закон периодичности, и Менделеев думал в том же направлении.
Таблица Менделеева
К 1869 году Менделеев десять лет пытался найти порядок для элементов. Однажды ему пришла в голову идея составить колоду карт с названиями элементов и начать играть в игру, которую он назвал «химический пасьянс». Он начал раскладывать карты снова и снова, просто чтобы посмотреть, сможет ли он сформировать узор, в котором все совмещается.
На сегодняшний день химики пытались сгруппировать элементы одним из двух способов:
- По их атомным весам (атомные веса Берцелиуса и Канниццаро);
- По своим химическим свойствам (Триады Доберейнера и Октавы Ньюланда).
Гений Менделеева заключался в том, чтобы объединить эти два метода вместе. Однако шансы сложились против него - было обнаружено немногим больше половины известных элементов: он играл с неполной колодой карт.
Он не спал три дня и три ночи, а затем, наконец, 17 февраля 1869 года, он заснул и увидел во сне все 63 известных элемента, изложенных в большой стол.
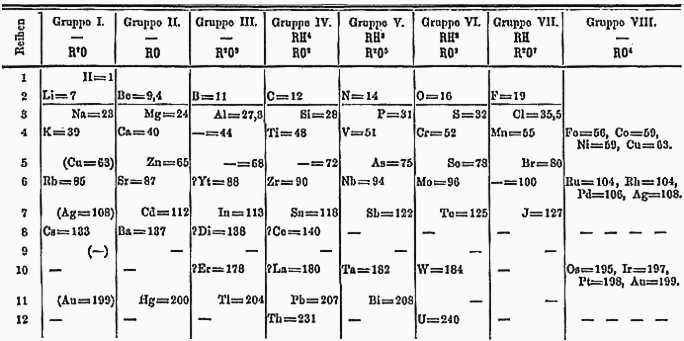
Таблица Менделеева показывает взаимосвязь между всеми элементами в их порядке:
- Атомные веса увеличивают чтение слева направо;
- Триады и октавы видны по столбцам.
Обратите внимание, что углерод и кремний относятся к Группе IV, а летучие газы фтор, хлор и бром - к Группе VII.
Менделеев был достаточно уверен в расположении своего стола, поэтому он был готов оставить зазоры для неизвестных элементов, чтобы узор соответствовал - полагая, что другие элементы будут позже будет обнаружен это заполнило пробелы.
- После кальция (Ca, вес 40) он оставил пробел, предсказав, что металлический элемент будет немного тяжелее кальция;
- После цинка (Zn, вес 65) он оставил пробел, предсказав металл с низкой температурой плавления и атомным весом 68;
- Сразу после этого промежутка он оставил еще один промежуток, предсказывая другой металл темно-серого цвета.
Итак, чтобы оправдать Менделеева, необходимо было заполнить пробелы, и, к счастью, в 1859 году были разработаны новые инструменты для обнаружения элементов.
Горелка Бунзена и спектрометр Кирхгофа
Роберт Бунзен знал, что, когда определенные элементы горят в пламени его горелки, каждый из них окрашивает пламя в другой цвет. Медь горела зеленым, стронциево-красным и калийно-сиреневым - Бунзен задавался вопросом, имеет ли каждый элемент уникальный цвет.
Бунзен присоединился к его исследованиям Густав Кирхгоф. Кирхгоф использовал концепцию рассеивания белого света призмой в изобретении спектроскоп, устройство с призмой в центре, которая разделяет свет от пламени Бунзена на отдельные полосы составляющих его цветов - цветов элемента спектральные линии.
Кирхгоф и Бунзен поняли, что эти спектральные линии уникальны для каждого элемента, и, используя эту технику, они обнаружили два новых элемента: цезий и рубидий.
Поль Эмиль Лекок де Буабодран обнаруживает галлий
В 1875 г. парижский химик Поль Эмиль Лекок де Буабодран использовал спектроскоп, чтобы обнаружить новый металлический элемент. Это был серебристо-белый, мягкий металл с атомная масса 68, который он назвал галлий, после родной Франции. Также оказалось, что очень низкая температура плавления, что соответствует всем ожидаемым свойствам элемента, который Менделеев ожидал заполнить пробел, который он оставил после цинка; действительно, это именно то место, где элемент был помещен в периодической таблице.
Несмотря на то, что Менделеев оставил необходимый промежуток для галлия, а также других элементов, становилось ясно, что целая группа отсутствует вовсе.
Пьер Янссен и Норман Локьер открывают гелий
В 1868 году французский астроном Пьер Янссен поехал в Индию вовремя солнечное затмение это произошло в августе того же года. Помимо телескопа, он также пошел со спектроскопом, чтобы изучить спектральные линии света, излучаемого солнцем. Обычно из-за интенсивности солнечного света многие более слабые спектральные линии не видны рядом с чрезмерной яркостью более сильных линий. Янссен надеялся, что он сможет наблюдать больше спектральных линий во время затмения, когда солнечный свет будет менее интенсивным.
Затмение позволило Янссену наблюдать невиданную ранее спектральную линию, которая не была связана ни с одним известным элементом. Эту же спектральную линию подтвердил английский астроном. Норман Локьер, который думал, что элемент существует только на солнце, назвал его гелий, в честь греческого бога Солнца.
Однако вскоре еще один британский ученый открыл на Земле гелий.
Уильям Рамзи открывает благородные газы
Растворяя клевеит радиоактивной руды в кислоте, Уильям Рамзи смог собрать газ, заключенный в камне, который имел атомный вес 4 и те же спектральные линии, которые наблюдал Локьер: гелий. До этого Рамзи уже изолировал новый газ от атмосферы; аргон, с атомным весом 40.
Теперь возникла проблема - Менделеев не оставил пробелов, которые подходили бы для любого из этих двух новых элементов, что привело Рамзи к выводу, что в периодической таблице отсутствует целая группа - только два из членов которой, как теперь известно, существуют, гелий и аргон.
Рэмси успешно обнаружил все другие стабильные элементы в группе, которую он назвал неон (Греч. Новое), криптон (По-гречески скрытый) и ксенон (По-гречески незнакомец). Все элементы этой новой группы обладали одной подавляющей характеристикой; их отсутствие реактивности. Именно эта особенность напомнила о названии новой группы: благородные газы.
Менделеев оправдан
Периодическая таблица Менделеева привела в порядок все элементы, что позволило ему делать прогнозы, которые будущие ученые проверили и подтвердили. К моменту смерти он был всемирно известным в области химии. Его таблица Менделеева была высечена в камне в Санкт-Петербурге, и в конечном итоге в его честь был назван элемент: менделевий.
Однако периодическая таблица не сообщает нам, почему одни элементы обладают высокой реакционной способностью, другие - полностью инертными, почему одни летучие, а другие - в меньшей степени. Лишь в начале 20-го века совершенно другая отрасль науки начала разгадывать ответы на эти вопросы.
Модель фиксированной оболочки Нильса Бора
В 1909 г. физик Эрнест Резерфорд предположил, что структура атома похожа на структуру Солнечной системы: в основном пустое пространство с электронами, плавающими вокруг плотного ядра.
Впоследствии датский физик Нильс Бор ввел идею о том, что электроны занимают «неподвижные оболочки» вокруг ядра, которая получила дальнейшее развитие, когда было предложено, что каждая такая оболочка может вместить только фиксированное количество электронов: 2 в первой оболочке; 8 во второй оболочке; 18 в третьей оболочке и так далее, каждая оболочка удерживает все большее количество электронов.
Химическое поведение всех элементов объясняется количеством электронов в их внешних оболочках: для увеличения энергетической стабильности своих электронных конфигураций атомы имеют тенденцию приобретать или терять электроны таким образом, чтобы получить полную внешнюю оболочку. Натрий, имеющий 11 электронов, один из которых находится в наиболее занятой внешней оболочке, будет переносить электрон в присутствии фтора на свою наиболее занятую внешнюю оболочку, содержащую семь электронов. В результате и натрий, и фтор теперь имеют полную внешнюю оболочку, и образуется фторид натрия.
Эта теория объяснила, почему все элементы реагируют именно так, и почему одни образуют соединения, а другие - нет. Это также объяснило, почему элементы обладают такими физическими свойствами, что, в свою очередь, объяснило, почему периодическая таблица имела такую форму. Однако остался без ответа один фундаментальный вопрос: сколько элементов было - может ли быть бесконечное количество элементов между водородом и ураном?
Протонные числа Генри Мозли
Химик начала 20 века Генри Мозли предположил, что ответ на количество протонов лежит в ядре. Запустив радиоактивный источник в меди, он смог выбить электроны из их атомов, выпустив взрыв энергии в виде рентгеновский снимок. При измерении рентгеновские лучи всегда имели одинаковую энергию, уникальную для меди. Он обнаружил, что каждый элемент испускает рентгеновские лучи разной энергии. Гениальность Мозли заключалась в том, чтобы понять, что энергия рентгеновского излучения связана с числом протонов внутри атома: атомный номер.
Поскольку это число протонов, атомный номер должен быть целым числом - дробных значений быть не может. Мозли понял, что порядок элементов определяется атомным номером, а не атомным весом. Более того, поскольку атомный номер увеличивается в целых числах от одного элемента к другому, не может быть никаких дополнительных элементов между водородом (атомный номер 1) и ураном (атомный номер 92) - может быть только 92 элемента, нет места для больше.
Мозли было всего 26 лет, когда он завершил это исследование. В возрасте 27 лет он погиб в бою во время Первой мировой войны - снайпер выстрелил ему в голову.
Эпизод 3: Сила стихий
Вступление
Всего 92 элемента образуют все соединения на Земле. Железо в сочетании с хромом, углеродом и никелем дает нержавеющая сталь. Стекло сделано из кремния и кислорода.
С доисторических времен люди занимались «ведерной химией» - складывали вместе всевозможные химические вещества, просто чтобы посмотреть, что произойдет. В результате многие ранние открытия в химии были случайными.
Генрих Дисбах производит первую синтетическую краску
В 18 веке Пруссия, Генрих Дисбах пытался произвести синтетическую красную краску. Он начал с нагревания поташа (карбонат калия), не подозревая, что его калий был загрязнен кровью. При нагревании белки в крови изменяются, позволяя им соединяться с железом в крови, в то время как карбонат реагирует с гемоглобином с образованием твердого вещества.
После нагревания полученного твердого вещества до золы, фильтрации и разбавления Дисбах добавил зеленый купорос (сульфат железа), чтобы создать комплексный ион: ферроцианид железа. Наконец, добавление спирта (соляной кислоты) приводит к яркому цвету: Берлинская лазурь.
Юстус фон Либих и Фридрих Вёлер сталкиваются с изомерией
Еще один немецкий химик, увидев в детстве фейерверк, Юстус фон Либих, были одержимы попытками лучше понять элементы, создавая взрывные комбинации. В частности, его интересовало взрывчатое вещество. гремящее серебро.
В 1825 г. он прочитал статью, написанную Фридрих Вёлер в котором он описывает соединение под названием цианат серебра, состоящее из равных частей серебра, углерода, азота и кислорода, которое он описал как безвредный и стабильный. Фон Либих немедленно написал в ответ яростное письмо, в котором осудил Велера как безнадежного аналитика: именно эти элементы, объединенные в равных пропорциях, и сделали взрывное серебро гремящим.
Вместо того, чтобы отступить, Велер предложил фон Либиху создать цианат серебра для себя. Результаты поразили бы его - те же самые элементы, которые объединились по методу фон Либиха, при объединении по методу Велера дали два совершенно разные соединения.
Велер и фон Либих случайно обнаружили изомерия: одинаковое количество атомов одинаковых элементов комбинируя по-разному сделать разные соединения. Со временем это объяснило бы, как всего 92 элемента могут образовать огромное количество соединений, которые мы знаем сегодня.
Химики начали понимать, что понимание расположения атомов внутри соединений имеет решающее значение, если они хотят создавать новые соединения, и первый шаг в этом направлении был сделан путем изучения углерода.
Smithson Tennant обнаруживает, из чего сделаны бриллианты
В 1796 г. Смитсон Теннант экспериментировал с бриллиантами, когда решил сжечь один. Используя только солнечный свет и увеличительное стекло, ему удалось зажечь алмаз настолько, чтобы из него образовался газ, который он собрал и смог идентифицировать как двуокись углерода.
Начав с алмаза и кислорода и получив газ, содержащий только углерод и кислород, Теннант обнаружил, что алмазы состоят из углерод.
В то время, не зная об атомной теории, ученые не могли объяснить, как углерод, уже известный как одно из самых мягких веществ в форме графит, также может быть единственным составным элементом самого твердого из известных веществ: алмаз.
Ровно 50 лет спустя молодой шотландский химик обнаружил, что за второе место в науке нет призов.
Арчибальд Скотт Купер формулирует теорию химических связей
В 1856 г. Арчибальд Скотт Купер пошел работать на французского химика, Шарль-Адольф Вюрц. Находясь в Париже, он придумал идею связи между атомами, которая могла бы объяснить, как отдельные атомы образуют соединения. Он назвал эти ссылки облигации. Каким-то образом Купер понял, что углерод может образовывать четыре связи, тем самым присоединяясь с разной силой к другим атомам углерода в соединении:
- В алмазе все четыре связи связаны с другими атомами углерода в трех измерениях, что делает его очень прочным.
- В графите только три связи связаны с другими атомами углерода в двухмерной гексагональной решетке, что позволяет слоям скользить друг по другу, делая графит мягким.
Способность углерода образовывать четыре связи также означает, что он может существовать в огромном разнообразии химических структур, таких как длинные цепи и даже кольца, что делает его редкостью среди элементов. Это помогло объяснить изобилие углерода во всех формах жизни, от белка и жира до ДНК и целлюлозы, и почему углерод существует в большем количестве соединений, чем любой другой элемент.
Все, что оставалось Куперу, - это опубликовать свою статью ...
Фридрих Кекуле формулирует ту же теорию химических связей.
Фридрих Кекуле was a German scientist who spent some time studying in London. It was apparently whilst riding a London bus he struck upon the idea of atoms ‘holding hands’ to form long chains. Kekulé rushed to compose a paper formalising his ideas on an equivalent theory of chemical bonds.
Meanwhile, in Paris, Wurtz had been slow to publish Couper's paper and Kekulé, whose work appeared in print first, claimed all the credit. When Couper discovered Wurtz had delayed in sending his paper to be published he flew into a rage and was promptly expelled from the laboratory by Wurtz.
The crushing disappointment at having lost out on his chance of scientific recognition led him first to withdraw from Science and then to suffer a nervous breakdown. He spent years in and out of an asylum.
However, now that scientists were beginning to understand the way carbon combines with itself and other elements, it was possible to create new compounds by design и industrial chemistry родился.
Wallace Carothers invents nylon
Two decades after the world's first plastic – Бакелит – had been invented in 1907, Уоллес Карозерс successfully drew off a fibre from the interface of two liquids: hexane-1,6-diamine and decanedioyl-dichloride, which could be spun into a very fine, very strong thread. Ему было дано имя нейлон.
Shockingly, only three weeks after the patent for nylon had been filed, a depressed Carothers slipped another carbon based compound into his own drink, potassium cyanide, and killed himself.
Evidently, industrial chemistry wasn’t without its downsides, and one chemist was arguably responsible for single-handedly polluting the entire Earth with вести.
Thomas Midgley Junior prevents engines from knocking
In his capacity as an engineer with Дженерал Моторс, Thomas Midgley experimented with a myriad of different compounds, which he added to petrol in an attempt to prevent engines from knocking. Eventually, he discovered one compound that worked brilliantly: тетраэтилсвинец.
By the 1970s the use of leaded petrol was ubiquitous worldwide, but research was emerging about the damage that it was doing to humans and the environment. В 1983 г. Королевская комиссия asked the question: "Is there any part of the Earth’s surface, or any form of life that remains uncontaminated?"
Today nearly all petrol is unleaded, although lead lives on in motor vehicles in their batteries.
Henri Becquerel discovers radioactivity
In 1896 the French scientist Анри Беккерель was working with уран crystals when he found UV light made them glow. Leaving the uranium crystals on an unexposed photographic plate overnight, he returned the next morning to discover they had caused the part of the plate they were sat on to develop.
Becquerel correctly reasoned the only source of energy that could have caused this was the crystals themselves. He had discovered радиоактивность, and a young Polish scientist began to investigate.
Marie Curie investigates radioactivity
Мари Кюри began her investigations by testing a uranium ore called уран with an electrometer. She discovered it was four times more radioactive than pure uranium, and wondered if this was due to the presence of an even more radioactive element in the pitchblende.
Curie began stockpiling tonnes of pitchblende, then in the most basic of workshops with primitive equipment she undertook a multitude of complex and dangerous procedures in an attempt to isolate this new element.
In the event, Curie discovered two new elements, полоний named after her native Poland and радий. Whilst these were naturally occurring elements, they fuelled a scientific desire to create entirely new, artificial elements.
Ernest Rutherford explains radioactivity
At the beginning of the 20th century it was widely believed that atoms never change: an atom of one element stayed that way forever. Резерфорд had already revealed the structure of an atom to consist mostly of empty space with a dense nucleus of protons at the centre, and Henry Mosley had shown that it is the number of protons that gives an atom its identity as a particular element. An atom of the element carbon has 6 protons, whilst an atom with 7 protons is one of nitrogen.
Rutherford came to the conclusion that the number of protons in a radioactive element мог change – through a process of decay where parts of the nucleus are ejected from the atom. Rutherford named these fragments of ejected nucleus альфа-частицы.
Rutherford realised that if an atom is losing protons, its identity is changing at the same time, since an atom's identity is governed by its proton number. Radioactive decay causes atoms of one element to transmute into atoms of a different элемент. He then sought to artificially engineer a specific transmutation.
Rutherford fixed a source of alpha particles – each of which contains two protons – at one end of a cylindrical chamber. At the other end he fixed a screen. Each time an alpha particle reached the screen it produced a flash. He then introduced nitrogen into the chamber and observed additional, different flashes on the screen. Occasionally, an alpha particle would collide with a nitrogen nucleus and get absorbed by it, knocking out a proton in the process. These protons then travelled on through the chamber to the screen to produce the additional flashes.
However, the nucleus of nitrogen – having absorbed two protons but lost only one – had gained a proton and become a nucleus of oxygen. Rutherford's work gave hope to scientists trying to create new elements, but one final discovery about the atom was necessary.
In 1932 the Cambridge scientist Джеймс Чедвик обнаружил neutron – electrically neutral particles which also sit inside the nucleus along with the protons.
Enrico Fermi claims to have made elements heavier than uranium
Now in Italy, Энрико Ферми – nicknamed ‘the pope’ by his colleagues for his infallibility, realised the potential of the newly discovered neutron in the search for elements heavier than uranium. Until now, scientists had been bombarding uranium with alpha particles in the hope they would enter the nucleus. Unfortunately, this was very unlikely because both alpha particles and nuclei are positively charged – the alpha particles could never overcome the electrostatic repulsion of the nucleus.
Fermi reasoned that because neutrons carried no electric charge, they would have a much better chance of penetrating the nucleus of a uranium atom. So Fermi set about firing neutrons at uranium. Fermi thought that this, coupled with his knowledge of бета-распад, whereby an unstable nucleus attempts stabilisation by converting one neutron to a proton and ejecting a newly formed electron, would result in an element with one extra proton than uranium: element 93.
Indeed, Fermi discovered elements he did not recognise. He tested for elements below uranium in the periodic table: radon, actinium, polonium, as far back as lead – it was none of these. So, in 1934, the infallible Fermi declared to the world he had created elements heavier than uranium.
Otto Hahn disproves Fermi’s claims
In 1938, a team of German scientists, led by Отто Хан, decided to investigate Fermi's bold claim. Unfortunately for Fermi, they quickly disproved his assertion; one of the elements produced was барий, which, with 56 protons, was nowhere near the 92 protons the nucleus started with when it was uranium.
Hahn wrote of his confusion to his colleague Lisa Meitner who, as an Austrian Jew, had recently fled Nazi Germany for Sweden.
Lise Meitner explains Fermi's work
Over Christmas 1938, Meitner considered the problem of the uranium nucleus, which she reasoned, given its relative size, must be quite unstable. She decided to model the nucleus as a drop of water, ready to divide with the impact of a single neutron. She realised the nucleus had split in half, and both Fermi and Hahn had witnessed what is now known as ядерное деление.
However, in doing the calculations for such an event, Meitner was unable to make the equations balance. She calculated that the products of the fission reaction were lighter than the initial uranium, by about one fifth of a proton. Somehow, a small amount of mass had disappeared. Then slowly, the solution to this discrepancy occurred to Meitner – Einstein and E = mc2 – the missing mass had been converted to energy.
Манхэттенский проект
Meitner's work was published in 1939, but as well generating interest amongst the scientific community, Meitner's revelations were also coming to the attention of governments on the verge of war. Fuelled by fears Nazi Germany was investigating nuclear weapons of its own, scientists were assembled in America to work on the Манхэттенский проект aimed at creating the first atomic bomb.
For an explosion to occur, there must be a rapid release of energy – a slow release of energy from uranium nuclei would give a uranium fire, but no explosion. Both sides poured their effort into creating the necessary conditions for a цепная реакция.
In 1942 Enrico Fermi, now living in America, successfully induced a chain reaction in uranium, but processing uranium for bombs was both difficult and costly. America had just come up with a different solution to win the atomic race.
Now finally, scientists’ dream of creating an element beyond the end of the periodic table was about to be realized.
Edwin McMillan and Philip H. Abelson create the first synthetic element
In California, scientists were trying to create a new element heavier than uranium using cyclotron машины. This involved using huge magnets to steer atoms round in circles faster and faster until they reached a tenth of the speed of light, whereupon they were smashed into a uranium target.
Эдвин Макмиллан и Philip H. Abelson blasted uranium with a beam of particles to create the first synthetic element, heavier than uranium – element 93, which they named нептуний.
The next synthetic element, плутоний, quickly followed in 1941, which scientists realized was readily able to undergo fission in a way capable of producing the desired chain reaction. It was soon being made into a bomb.
A mere seven years after the discovery of nuclear fission, on 6 August 1945, half a gram of uranium was converted into energy when the world's first atomic bomb was dropped on Хиросима. As Lisa Meitner's calculations suggested, this conversion released energy equivalent to 13,000 tons of TNT. A plutonium bomb was dropped on Нагасаки Через три дня.
GSI Центр исследований тяжелых ионов им. Гельмгольца
Using one of the world's largest particle accelerators, scientists working at the Heavy Ion Research facility in Darmstadt, Germany, have so far confirmed the existence of element 112, which they have named Copernicium, after Polish astronomer Nicholas Copernicus.
These physicists have become the new chemists – testing the foundations of the periodic table, and hence our understanding of the universe, in light of new discoveries.
In addition to producing new elements, scientists are also attempting to discern their properties. Copernicium is found to be a volatile metal that would be liquid at room temperature if enough were ever made – exactly what Mendeleev would predict for an element that sits directly beneath liquid mercury in the periodic table.
Вещание в США
It aired in the United States under the title "Unlocking the Universe."[1]
Выпуск DVD региона 2
The full series was released as a region 2 DVD set in 2015 by the Dutch company B-Motion.
