Координационный полимер - Coordination polymer

А координационный полимер является неорганический или же металлоорганический полимер структура, содержащая катионные центры металлов, связанные между собой лиганды. Более формально координационный полимер представляет собой координационное соединение с повторяющимися координационными элементами, простирающимися в 1, 2 или 3 измерениях.[1]
Его также можно описать как полимер, повторяющиеся звенья которого координационные комплексы. Координационные полимеры содержат координационные сети подкласса, которые представляют собой координационные соединения, простирающиеся через повторяющиеся координационные объекты в одном измерении, но с перекрестными связями между двумя или более отдельными цепями, петлями или спиросвязями, или координационное соединение, проходящее через повторяющиеся координационные объекты. в 2 или 3 измерениях. Подклассом из них являются металлоорганические каркасы, или MOF, которые представляют собой координационные сети с органическими лигандами, содержащими потенциальные пустоты.[1]
Координационные полимеры актуальны для многих областей, таких как органический и неорганическая химия, биохимия, материаловедение, электрохимия и фармакология, имеющая множество потенциальных применений.[2] Этот междисциплинарный характер привел к обширным исследованиям в последние несколько десятилетий.[3]
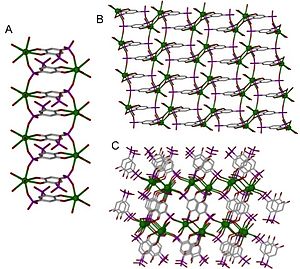
Координационные полимеры можно классифицировать множеством различных способов в зависимости от их структуры и состава. Одна важная классификация называется размерность. Структура может быть одно-, двух- или трехмерной, в зависимости от количества направлений в пространстве, в которое простирается массив. Одномерная структура проходит по прямой линии (вдоль оси x); двухмерная структура простирается в плоскости (два направления, оси x и y); а трехмерная структура простирается во всех трех направлениях (оси x, y и z).[4] Это изображено на рисунке 1.
История
Работа Альфред Вернер и его современники заложили основу для изучения координационных полимеров. Термины, используемые повсеместно, например координационный номер, были придуманы Вернером. Многие известные материалы теперь признаны координационными полимерами. К ним относятся цианидные комплексы Берлинская лазурь и Хофманн клатраты.[5]
Синтез и распространение
Координационные полимеры часто получают самосборка, с участием кристаллизация из металла соль с лигандом. Механизмы кристалл инженерия и молекулярная самосборка актуальны.[2]

Способы синтеза, используемые для получения координационных полимеров, как правило, аналогичны методам, используемым для выращивания любого кристалла. Обычно они включают наслоение растворителя (медленная диффузия), медленное испарение и медленное охлаждение. (Поскольку основным методом характеристики координационных полимеров является Рентгеновская кристаллография, выращивая кристалл достаточного размера и качества.)
Межмолекулярные силы и связь
Силы, определяющие комплексы металл-лиганд, включают: силы Ван дер Ваальса, пи-пи взаимодействия, водородная связь, и стабилизация пи-облигации поляризованными связями в дополнение к координационной связи, образованной между металлом и лигандом. Эти межмолекулярные силы имеют тенденцию быть слабыми, с большим равновесным расстоянием (длиной связи) по сравнению с ковалентные связи. Пи-пи взаимодействия между бензол кольца, например, имеют энергию примерно 5–10 кДж / моль и оптимальное расстояние 3,4–3,8 Ангстремс между параллельными гранями колец.
Координация
Кристаллическая структура и размерность координационного полимера определяются функциональностью линкера и координационной геометрией металлического центра. Размерность обычно определяется металлическим центром, который может иметь способность связываться с 16 функциональными сайтами на линкерах; однако это не всегда так, поскольку размерность может определяться линкером, когда линкер связывается с большим количеством металлических центров, чем металлический центр связывает линкеры.[6] Наибольшее известное координационное число координационного полимера составляет 14,[7] хотя координационные числа чаще всего составляют от 2 до 10.[8] Примеры различных координационных чисел показаны в плоской геометрии на рисунке 2. На рисунке 1 структура 1D является 2-скоординированной, планарная - 4-скоординированной, а 3D - 6-скоординированной.
Металлические центры
Металлические центры, часто называемые узлами или ступицами, соединяются с определенным количеством линкеров под четко определенными углами. Количество линкеров, привязанных к узлу, известно как координационный номер, что вместе с углами, под которыми они удерживаются, определяет размерность конструкции. В координационный номер и координационная геометрия металлического центра определяется неравномерным распределением электронная плотность вокруг него, и в целом координационное число увеличивается с размером катиона. Несколько моделей, в первую очередь гибридизация модель и теория молекулярных орбиталей, используйте уравнение Шредингера для предсказания и объяснения координационной геометрии, однако это сложно отчасти из-за сложного воздействия окружающей среды на электронная плотность распределение.[10]
Переходные металлы
Переходные металлы обычно используются как узлы. Частично заполнено d орбитали, либо в атом или же ион, может гибридизировать по-разному в зависимости от среды. Этот электронная структура заставляет некоторых из них проявлять несколько координационные геометрии, особенно ионы меди и золота, которые в качестве нейтральных атомов имеют полные d-орбитали в своих внешних оболочках.
Лантаноиды
Лантаноиды представляют собой большие атомы с координационными числами от 7 до 14. Их координационное окружение сложно предсказать, что затрудняет их использование в качестве узлов. Они предлагают возможность включения люминесцентных компонентов.
Щелочные металлы и щелочноземельные металлы
Щелочных металлов и щелочноземельные металлы существуют как стабильные катионы. Щелочные металлы легко образуют катионы со стабильными валентными оболочками, что придает им другое координационное поведение, чем лантаноиды и переходные металлы. На них сильно влияет противоион из соли, используемой в синтезе, чего трудно избежать. Все координационные полимеры, показанные на рисунке 3, представляют собой металлы второй группы. В этом случае размерность этих структур увеличивается с увеличением радиуса металла вниз по группе (от кальций к стронций к барий ).
Лиганды
В большинстве координационных полимеров a лиганд (атом или группа атомов) формально пожертвует одинокая пара из электроны к металлу катион и сформировать координационный комплекс через кислотно-щелочное соотношение Льюиса (Кислоты и основания Льюиса ). Координационные полимеры образуются, когда лиганд обладает способностью образовывать множественные координационные связи и действовать как мост между множественными металлическими центрами. Лиганды, которые могут образовывать одну координационную связь, называются монодентатными, но те, которые образуют несколько координационных связей, которые могут привести к образованию координационных полимеров, называются полидентатный. Полидентатные лиганды особенно важны, потому что именно через лиганды, которые соединяют несколько металлических центров вместе, образуется бесконечный массив. Полидентатные лиганды также могут образовывать множественные связи с одним и тем же металлом (который называется хелатирование ). Монодентатные лиганды также называют терминальными, потому что они не предлагают места для продолжения сети. Часто координационные полимеры состоят из комбинации поли- и монодентатных, мостиковых, хелатных и концевых лигандов.
Химический состав
Практически любой тип атома с неподеленной парой электронов может быть включен в состав лиганд. Лиганды, которые обычно встречаются в координационных полимерах, включают полипиридины, фенантролины, гидроксихинолины и поликарбоксилаты. Атомы кислорода и азота обычно встречаются в качестве сайтов связывания, но другие атомы, такие как сера[11] и фосфор,[12][13] наблюдались.
Лиганды и катионы металлов склонны следовать теории твердого и мягкого кислотного основания (HSAB ) тенденции. Это означает, что более крупные, более поляризуемые мягкие металлы будут легче координироваться с более крупными и более поляризуемыми мягкими лигандами, а небольшие неполяризуемые твердые металлы будут координироваться с небольшими неполяризуемыми твердыми лигандами.
Структурная ориентация

Лиганды могут быть гибкими или жесткими. Жесткий лиганд - это лиганд, который не имеет свободы вращаться вокруг связей или переориентировать структуру. Гибкие лиганды могут изгибаться, вращаться вокруг связей и переориентировать себя. Эти разные конформации создать больше разнообразия в структуре. Существуют примеры координационных полимеров, которые включают две конфигурации одного и того же лиганда в одной структуре,[14] а также две отдельные структуры, единственная разница между которыми заключается в ориентации лиганда.
Длина лиганда
Длина лиганда может быть важным фактором при определении возможности образования полимерной структуры по сравнению с неполимерными (моно- или олигомерными) структурами.[15]
Прочие факторы
Противоион
Помимо выбора металла и лиганда, на структуру координационного полимера влияет множество других факторов. Например, большинство металлических центров представляют собой положительно заряженные ионы, существующие в виде солей. В противоион в соли может повлиять на общую структуру. Например, соли серебра, такие как AgNO3, AgBF4, AgClO4, AgPF6, AgAsF6 и AgSbF6 все кристаллизованы с одним и тем же лигандом, структуры различаются с точки зрения координационного окружения металла, а также размерности всего координационного полимера.[16]
Среда кристаллизации
Кроме того, изменения в среде кристаллизации также могут изменить структуру. Изменения в pH,[17] воздействие света или изменения температуры[18] могут все изменить получившуюся структуру. Влияние на структуру из-за изменений в среде кристаллизации определяется в каждом конкретном случае.
Гостевые молекулы

В структуре координационных полимеров часто присутствуют пустоты в виде пор или каналов. Это пустое пространство является термодинамически невыгодным. Чтобы стабилизировать структуру и предотвратить коллапс, поры или каналы часто заняты молекулами-гостями. Молекулы-гости не образуют связей с окружающей решеткой, но иногда взаимодействуют посредством межмолекулярных сил, таких как водородные связи или пи-стэкинг. Чаще всего гостевой молекулой будет растворитель, в котором был кристаллизован координационный полимер, но на самом деле это может быть что угодно (другие присутствующие соли, атмосферные газы, такие как кислород, азот, углекислый газ и т. д.) Присутствие гостевой молекулы может иногда влиять на структуру, поддерживая пору или канал, где в противном случае их не существовало бы.
Приложения
Координационные полимеры продаются как красители. Особенно полезны производные аминофенол. Металлокомплексные красители с использованием меди или хрома обычно используются для получения матовых цветов. Тридентатный лиганд красители полезны, потому что они более стабильны, чем их двух- или монодентатные аналоги.[19][20]

Одним из первых коммерческих координационных полимеров являются соединения Гофмана, которые имеют формулу Ni (CN)4Ni (NH3)2. Эти материалы кристаллизуются с небольшими ароматическими гостями (бензол, некоторые ксилолы), и эта селективность коммерчески используется для разделения этих углеводородов.[21]
Направления исследований
Молекулярное хранение
Хотя это еще не практично, пористые координационные полимеры могут использоваться как молекулярные сита параллельно с пористым углеродом и цеолиты.[5] Размер и форма поры могут контролироваться размером линкера и длиной соединяющих лигандов и функциональные группы. Чтобы изменить размер пор для достижения эффективной адсорбции, нелетучие гости находятся вставленный в пористом пространстве координационного полимера для уменьшения размера пор. Активные гостиные поверхности также могут способствовать адсорбция. Например, MOF-177 с большими порами диаметром 11,8 Å может быть легирован C60 молекулы (6,83 Å в диаметре) или полимеры с сильно сопряженной системой с целью увеличения площади поверхности для H2 адсорбция.
Гибкие пористые координационные полимеры потенциально привлекательны для хранения молекул, поскольку их размер пор может изменяться в результате физических изменений. Пример этого можно увидеть в полимере, который содержит молекулы газа в нормальном состоянии, но при сжатии полимер разрушается и высвобождает хранящиеся молекулы. В зависимости от структуры полимера, возможно, что структура будет достаточно гибкой, чтобы схлопывание пор было обратимым, и полимер можно было повторно использовать для повторного поглощения молекул газа.[22] В Металлоорганический каркас На странице есть подробный раздел, посвященный H2 хранение газа.
Люминесценция
Люминесцентные координационные полимеры обычно содержат органические хромофорные лиганды, которые поглощают свет и затем передают энергию возбуждения иону металла. Координационные полимеры потенциально являются наиболее универсальными люминесцентными видами из-за их эмиссионных свойств в сочетании с гостевым обменом. Люминесцентные супрамолекулярные конструкции в последнее время вызывают большой интерес из-за их потенциального применения в оптоэлектронных устройствах или в качестве флуоресцентных датчиков и зондов. Координационные полимеры часто более стабильны (термо- и устойчивы к растворителям), чем чисто органические соединения. Для лигандов, которые флуоресцируют без присутствия металлического линкера (не из-за LMCT), интенсивное фотолюминесцентное излучение этих материалов обычно имеет величину порядка выше, чем у одного свободного лиганда. Эти материалы могут быть использованы для создания потенциальных кандидатов в светодиоды (ВЕЛ ) устройства. Резкое увеличение флуоресценции вызвано увеличением жесткости и асимметрии лиганда при координации с металлическим центром.[23]
Электрическая проводимость
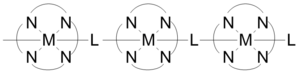
Координационные полимеры могут иметь в своей структуре короткие неорганические и сопряженные органические мостики, которые обеспечивают пути для электрическая проводимость. Некоторые одномерные координационные полимеры, построенные, как показано на рисунке, обладают проводимостью в диапазоне 1х10−6 до 2x10−1 См / см. Проводимость обусловлена взаимодействием между металлическими d-орбитальный и уровень pi * мостикового лиганда. В некоторых случаях координационные полимеры могут иметь полупроводник поведение. Трехмерные структуры, состоящие из листов серебросодержащих полимеров, демонстрируют полупроводимость, когда металлические центры выровнены, и проводимость уменьшается, когда атомы серебра переходят от параллельных к перпендикулярным.[23]
Магнетизм
Координационные полимеры проявляют много видов магнетизм. Антиферромагнетизм, ферримагнетизм, и ферромагнетизм являются кооперативными явлениями магнитных спинов внутри твердого тела, возникающими из-за связи между спинами парамагнитных центров. Чтобы обеспечить эффективное магнитное поле, ионы металлов должны быть соединены небольшими лигандами, обеспечивающими короткие контакты металл-металл (такие как оксо, циано и азидомосты).[23]
Возможности датчика
Координационные полимеры также могут показывать изменение цвета при изменении растворитель молекулы включены в структуру. Примером этого могут быть два координационных полимера Со [Re6S8(CN)6]4− кластер, содержащий водные лиганды, которые координируются с атомами кобальта. Этот первоначально оранжевый раствор становится фиолетовым или зеленым при замене воды на тетрагидрофуран, синий - при добавлении диэтилового эфира. Таким образом, полимер может действовать как датчик растворителя, который физически меняет цвет в присутствии определенных растворителей. Изменение цвета объясняется тем, что поступающий растворитель вытесняет водные лиганды на атомах кобальта, что приводит к изменению их геометрии с октаэдрической на тетраэдрическую.[23]
Рекомендации
- ^ а б Баттен, Стюарт Р .; Чампнесс, Нил Р .; Чен, Сяо-Мин; Гарсия-Мартинес, Хавьер; Китагава, Сусуму; Эрстрём, Ларс; О'Киф, Майкл; Suh, Myunghyun P .; Ридейк, янв (2013). «Терминология металлорганических каркасов и координационных полимеров (Рекомендации IUPAC 2013 г.)». Чистая и прикладная химия. 85 (8): 1715. Дои:10.1351 / PAC-REC-12-11-20.
- ^ а б Фромм, К. (2008). «Координационные полимерные сети с ионами металлов s-блока» (PDF). Coord. Chem. Rev. 252 (8–9): 856–885. Дои:10.1016 / j.ccr.2007.10.032.
- ^ Ян, Й .; Jiang, G .; Li, Y. Z .; Bai, J .; Pan, Y .; Вы, X. Z. (2006). «Синтез, структура и свойства бензол-1,4-диоксилацетатов щелочноземельных металлов с трехмерными гибридными сетками». Неорганика Chimica Acta. 359 (10): 3257. Дои:10.1016 / j.ica.2006.03.038.
- ^ Чен, Х; Е, Б .; Тонг, М. (2005). «Металлоорганические молекулярные структуры с 2,2'-бипиридил-подобными и карбоксилатными лигандами». Coord. Chem. Rev. 249 (5–6): 545–565. Дои:10.1016 / j.ccr.2004.07.006.
- ^ а б Kitagawa, S .; Китаура, Р .; Норо, С. И. (2004). «Функциональные пористые координационные полимеры». Angewandte Chemie International Edition. 43 (18): 2334. Дои:10.1002 / anie.200300610.
- ^ Ламминг, Гленн; Эль-Зубир, Усама; Колокотрони, Джеймс; МакГерк, Кристофер; Waddell, Paul G .; Проберт, Майкл Р .; Хоултон, Эндрю (2016-10-03). «Двумерные каркасы на основе образования связи Ag (I) –N: преобразование монокристалла в монолекулярный лист». Неорганическая химия. 55 (19): 9644–9652. Дои:10.1021 / acs.inorgchem.6b01365. ISSN 0020-1669.
- ^ Charpin, P .; Nierlich, M .; Vigner, D .; Lance, M .; Бодри, Д. (1987). «Структура второй кристаллической формы тетрагидробората урана (IV)». Acta Crystallographica Раздел C. 43 (8): 1465 – p1467. Дои:10.1107 / S0108270187091431.CS1 maint: использует параметр авторов (связь)
- ^ Робин, A. Y .; Фромм, К. М. (2006). «Координационные полимерные сети с O- и N-донорами: что это такое, почему и как они сделаны». Coord. Chem. Rev. 250 (15–16): 2127–2157. Дои:10.1016 / j.ccr.2006.02.013.CS1 maint: использует параметр авторов (связь)
- ^ Кот, А; Симидзу, Г. (2003). «Координационные твердые тела путем сборки адаптируемых компонентов: систематические структурные изменения в щелочноземельных органосульфонатных сетях». Chem. Евро. J. 9 (21): 5361–5370. Дои:10.1002 / chem.200305102. PMID 14613146.
- ^ Бернштейн, Джереми; Пол М. Фишбейн; Стивен Г. Гасиорович (3 апреля 2000 г.). Современная физика. Прентис-Холл. п. 624. ISBN 978-0-13-955311-0.
- ^ Wen, M .; Munakata, M .; Suenaga, Y .; Курода-Сова, Т .; Maekawa, M .; Ян, С. Г. (2001). «Координационные полимеры серебра (I) циклического серного лиганда, 2,2 ', 3,3'-тетрагидро-4,4'-дитиа-1,1'-бинафтилидена». Неорганика Chimica Acta. 322 (1–2): 133–137. Дои:10.1016 / S0020-1693 (01) 00556-4.
- ^ Hung-Low, F .; Klausmeyer, K. K .; Гэри, Дж. Б. (2009). «Влияние соотношения анионов и лигандов в самоорганизованных комплексах серебра (I) 4- (дифенилфосфинометил) пиридина и их производных с бипиридиновыми лигандами». Неорганика Chimica Acta. 362 (2): 426. Дои:10.1016 / j.ica.2008.04.032.
- ^ Ricci, G .; Sommazzi, A .; Маси, Ф .; Ricci, M .; Boglia, A .; Леоне, Г. (2010). «Четко определенные комплексы переходных металлов с фосфорными и азотными лигандами для полимеризации 1,3-диенов». Обзоры координационной химии. 254 (5–6): 661. Дои:10.1016 / j.ccr.2009.09.023.
- ^ Knaust, J.M .; Келлер, С. В. (2002). «Координационный полимер со смешанными лигандами, полученный in situ изомеризацией бис (4-пиридил) этилена, опосредованной Cu (I)». Неорганическая химия. 41 (22): 5650–2. Дои:10.1021 / ic025836c. PMID 12401066.
- ^ Бувайло, Андрей И .; Гумиенна-Контекка, Эльжбета; Павлова, Светлана В .; Фрицкий, Игорь Олегович; Хаукка, Матти (2010). "Димерный против полимерная координация в катионных комплексах меди (ii) с бис (хелатирующими) оксимом и амидными лигандами ». Dalton Transactions. 39 (27): 6266–75. Дои:10.1039 / C0DT00008F. PMID 20520918.
- ^ Carlucci, L .; Ciani, G .; Proserpio, D.M .; Риццато, С. (2002). «Новые полимерные сети от самосборки солей серебра (i) и гибкого лиганда 1,3-бис (4-пиридил) пропана (bpp). Систематическое исследование эффектов противоионов и обзор координационных полимеров на основе bpp ". CrystEngComm. 4 (22): 121. Дои:10.1039 / b201288j.
- ^ Ni, L.B .; Zhang, R.H .; Лю, К. X .; Xia, W. S .; Wang, H .; Чжоу, З. Х. (2009). «Зависимое от pH и мольного соотношения образование координационных полимеров цинка (II) с иминодиуксусной кислотой: синтез, спектроскопические исследования, исследования кристаллической структуры и термические исследования». Журнал химии твердого тела. 182 (10): 2698–2706. Bibcode:2009JSSCh.182.2698N. Дои:10.1016 / j.jssc.2009.06.042. ЧВК 2778864. PMID 20161370.
- ^ Тонг, М. Л .; Hu, S .; Wang, J .; Kitagawa, S .; Нг, С. В. (2005). «Супрамолекулярная изомерия в фазах гидроксида кадмия. Температурно-зависимый синтез и структура фотолюминесцентных координационных полимеров α- и β-Cd».2(ОЙ)2(2,4-пыда) ». Рост кристаллов и дизайн. 5 (3): 837. Дои:10.1021 / cg049610r.
- ^ Грыхтол, К .; Меннике, В. (2002) "Металл-комплексные красители". В Энциклопедия промышленной химии Ульмана. Wiley-VCH. Дои:10.1002 / 14356007.a16_299.
- ^ Голод, К .; Mischke, P .; Rieper, W .; Raue, R .; Kunde, K .; Энгель, А. (2002) «Азокрасители». В Энциклопедия промышленной химии Ульмана. Wiley-VCH. Дои:10.1002 / 14356007.a03_245.
- ^ Этвуд, Дж. Л. (2012) «Соединения включения» в Энциклопедия промышленной химии Ульмана. Wiley-VCH, Weinheim. Дои: 10.1002 / 14356007.a14_119
- ^ Bureekaew, S .; Shimomura, S .; Китагава, С. (2008). «Химия и применение гибких пористых координационных полимеров». Наука и технология перспективных материалов. 9 (1): 014108. Bibcode:2008STAdM ... 9a4108B. Дои:10.1088/1468-6996/9/1/014108. ЧВК 5099803. PMID 27877934.
- ^ а б c d Баттен, Стюарт Р. (2008). Координационные полимеры: дизайн, анализ и применение. Издательство РСК. С. 297–307, 396–407. Дои:10.1039/9781847558862. ISBN 978-0-85404-837-3.
