Гемоглобин Хопкинса-2 - Hemoglobin Hopkins-2
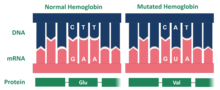
Гемоглобин Хопкинса-2 (Hb Hop-2) представляет собой мутацию белка гемоглобин, который отвечает за транспортировку кислорода через кровь от легких к мускулатуре тела позвоночных. Специфическая мутация в гемоглобине Хопкинса-2 приводит к появлению двух аномальных α-цепей (человеческий гемоглобин состоит из 2 α и 2 β полипептидов, обычно называемых цепями).[1] Мутация является результатом гистидин 112 заменяется на аспарагиновая кислота в полипептидной последовательности белка.[1] Кроме того, в одной из мутировавших альфа-цепей есть замены в точках 114 и 118, двух точках аминокислотной цепи.[2] Эта мутация может вызвать серповидноклеточная анемия.[3]
После первоначального открытия гемоглобина два исследователя, работавшие в Больница Джона Хопкинса в середине двадцатого века Эрнест В. Смит и Дж. В. Торберт открыли мутацию гемоглобина Гопкинса-2.[4] Работа Харви А. Итано и Элизабет А. Робинсон в 1960 году подтвердили открытие Смита и Торберта и подчеркнули важность альфа-локусов в мутации.[5] Позже, в двадцатом веке, Сэмюэл Чараш, еще один ученый и врач, работавший с Хопкинсом, изучил физиологическое влияние этого варианта на здоровье.[6] Его результаты показывают, что этот вариант не имеет клинического эффекта.[7]
История
В середине 1900-х годов многие факторы побудили исследовать гемоглобин в Балтимор, Мэриленд и в конечном итоге привело к открытию гемоглобина Хопкинса-2. Во-первых, разработка новых технологий, в том числе рентгеновская кристаллография и химия белков, которую можно было бы использовать в исследованиях молекулярной биологии, катализирующих исследования.[8] Кроме того, большое присутствие талассемия (Hb H), заболевание, при котором альфа-ген является дисфункциональным, в Юго-Восточной Азии и Южном Китае дополнительно беспокоило исследователей, поскольку, если его не лечить, мутация может привести к деформации костей. отек селезенки, замедленная скорость роста, или сердечная дисфункция.[9][10] Кроме того, Макс Перуц исследователем из Кембриджа, открытие основного гемоглобина третичная структура в 1962 г. стал катализатором исследований в области гематологии.[11] Вернон Инграм исследования вокруг серповидноклеточная анемия в 1956 году показали, что варианты или мутации в РНК гемоглобина приводят к серповидноклеточная анемия.[8][3]

Эрнест В. Смит и Дж. В. Норберт изучили открытие Ингрэма и в 1958 году обнаружили мутацию гемоглобина Хопкинса-2. Смит и Торберт, научные сотрудники, работающие в лаборатории Локкарда Конли. Гематология Исследовательский отдел Университета Джона Хопкинса доказал, что рекомбинация неаллельные гены привели к двум вариантам гена, продуцирующего гемоглобин. Варианты «нормального» гена гемоглобина приводят к мутации продуцируемых гемоглобинов.[4] Другими словами, исследователи обнаружили две версии гемоглобин: [Hb-Hop2] и Варианты S.[8]
Выводы Смита и Торберта были подтверждены и основаны на Харви А. Итано и Элизабет А. Робинсон в 1960 году. В своей статье Генетический контроль a- и b-цепей гемоглобина, Итано и Робинсон объяснил, что и альфа, и бета места участвуют в регуляции гемоглобина. Рекомбинация альфа-локусов в гене, кодирующем гемоглобин, приводит к мутации белка гемоглобина. Исследователи называют этот мутировавший белок разновидностью гемоглобина Хопкинса-2.[5]
Дальнейшие исследования генетической мутации Хопкинса-2 были проведены врачами Джона Хопкинса, которые продолжали заниматься исследованиями в области гематологии, несмотря на общее смещение акцента с гематологии в медицинском сообществе. Выдающийся исследователь Хопкинса Сэмюэл Чараш был одним из многих ученых Хопкинса, которые исследовали кровь и его компоненты в конце двадцатого века.[8] В частности, Charache хорошо известен своей работой с Джорджем Дувером, другим исследователем Хопкинса; вместе они обнаружили вариант лечения серповидноклеточная анемия. Однако Шараш также занимался исследованием гемоглобина Хопкинса-2. В его Природа статья, озаглавленная Клинические исследования и физиологические свойства гемоглобина-2 Хопкинса, Шараш объявил о своих открытиях, касающихся варианта гемоглобина. Чараш сосредоточился на физических последствиях варианта, а не на самой генетике. В конце концов, Charache утверждает в своей статье, что вариант не выделяется. фенотипически и играет незаметно или не влияет на здоровье человека.
Гемоглобин и гематология в Хопкинсе

Гематологические исследования проводились в больнице Джона Хопкинса до открытия варианта гемоглобина Хопкинса-2. После наблюдения за клетками под микроскоп, Сэр Уильям Ослер связал концепцию дисфункциональных тромбоцитов с развитием язвенного эндокардита и тромбоз. Первоначальные наблюдения Ослера за тромбоцитами послужили катализатором изучения крови и гематологии в Хопкинсе и других исследовательских средах.[12] Тромбоциты были независимо открыты Максом Шульце в 1865 году.[13] и Г. Бицзозеро в 1882 г.[14]
Начиная с 1920 года врачи больницы Джона Хопкинса проводили исследования серповидноклеточная анемия, или серповидноклеточная анемия. Хотя их выводы относительно болезни устарели, доктора Талиаферро и Гек обнаружили скрытый форма серповидноклеточной анемии. Их исследование серповидно-клеточной анемии было первым из многих, проведенных в Хопкинсе. В 1940 году Ирвинг Шерман, студент-медик Университета Джонса Хопкинса, правильно определил деоксигенация гемоглобина у пациентов с серповидноклеточными клетками после того, как он отметил преломление паттерны, характерные для деоксигенации, когда свет проходит через белок.[15] Деоксигенация гемоглобина у пациентов с серповидными клетками имеет серьезные последствия для носителей мутации. Белки гемоглобина, присутствующие у людей с серповидно-клеточной анемией, не могут переносить кислород к органам и другим тканям человеческого тела. Это приводит к болевые кризы и болезнь приводит к сокращенному продолжительность жизни 40–60 лет.[16]
Эрнест В. Смит и Торберт сыграли важную роль в открытии гемоглобина-2 Хопкинса, а также многих других гематологических мутаций и состояний.[4] Два ученых работали вместе в Хопкинсе, чтобы идентифицировать мутацию гемоглобина N-Балтимора в 1958 году.[17] Также называемая мутацией Хопкинса-I, Дженкинса, N-Мемфиса или Кенвуда, мутация N-Балтимора является точечной мутацией, в которой глицин кодон заменяется на аденозин кодон. Мутация N-Baltimore связана с мутациями C и S гемоглобина.[18]
Смит провел обширное исследование совместно с Локлардом Конли, одним из боссов Смита во время открытия варианта Гемоглобина-2 Хопкинса. Локкард Конли, которого обычно называли «Локком», был Джонс Хопкинс студент и Колумбия обученный врач. В 1947 году Конли стал первым директором отделения гематологии в Хопкинсе и оставался на этой должности 33 года. Находясь там, он изучал связанные с кровью болезни, такие как коагуляция крови и серповидноклеточная анемия, и изобрел оборудование для анализа молекулярных видов.[19] В частности, он и Смит создали устройство, которое позволило отделить варианты гемоглобина от стандартных молекул гемоглобина. Таким образом, влияние Конли на гематологию было не только научным открытием; но также технологическое открытие, которое позволило расширить гематологическое поле.[20] Конли оставался доктором и профессором в Больница Джона Хопкинса до его смерти в 2010 году.[19]
Хотя значительный объем гематологических исследований был завершен в 1950-х и 1960-х годах, ученые сомневались, можно ли завершить дополнительные исследования без разработки более передовых технологий. В конечном итоге это сомнение привело к тому, что в середине двадцатого века все меньше ученых проводило исследования в области гематологии.[8] Несмотря на нехватку исследователей, были сделаны новые открытия в области генетики и гемоглобина. Однако исследования продолжались в крупных медицинских лабораториях, таких как Хопкинс.[21]
В середине и конце двадцатого века оба доктора Джордж Дж. Довер и Сэмюэл Чараш изучали патологию серповидно-клеточной анемии в больнице Джонса Хопкинса.[7] Вместе они реализовали лечение болезни с помощью лекарства от рака, гидроксимочевина; препарат был успешным в облегчении некоторых болезненных приступов, связанных с серповидноклеточная анемия, в добавление к легочный симптомы, связанные с заболеванием. Дувр, детский гематолог и эксперт по гемоглобин плода, положила начало использованию этого белка для лечения серповидно-клеточной анемии у взрослых.
Медицинские последствия
Вариант гемоглобина Гопкинса-2 имеет сродство к кислороду в организме, что означает увеличение распространения кислорода по телу из-за того, что Ho-2 несет большее количество кислорода.[22] Эффект эритроцитов у Ho-2 отсутствует по сравнению с Гемоглобин S, который меняет форму клетки на серповидную. Вариант гемоглобина Гопкинса-2 не участвует в формировании серповидные клетки. Фенотипическая экспрессия Ho-2 с точки зрения серповидно-клеточной недостаточности отсутствует, поэтому у человека с серповидно-клеточной анемией и гемоглобином Hopkins-2 симптомы не проявляются.
Генетическая основа
Вариант Хопкинса 2 гемоглобин это результат мутации. В частности, мутировавший белок состоит из двух альфа-цепей. Мутация варианта гемоглобина Гопкинса-2 расположена на поверхности молекулы. В варианте Ho-2 аспарагиновая кислота заменяет гистидин в позиции 112 альфа-цепи.[2] Доктор Макс Перуц исследовали аспарагиновую кислоту в альфа 112, утверждая, что карбоксильная группа аминокислоты образует водородную связь с гидроксилом феноликс, что, в свою очередь, стабилизирует структуру молекулы и увеличивает сродство к кислороду. Гемоглобин Ho-2 имеет высокий уровень кислорода, который восполняет недостаток кислорода в красных кровяных тельцах. Ho-2 похож на Гемоглобин А, который является нормальным гемоглобином и также содержит две α-цепи. Это дает объяснение того, как вариант гемоглобина Гопкинса-2 связан с симптомами серповидная клетка.
Hopkins-2 также может специфически взаимодействовать с гемоглобином S. Гемоглобин S является наиболее распространенным вариантом аномального гемоглобина. Гемоглобин S - это вариант, вызывающий серповидная клетка - заболевание, при котором красные кровяные тельца разрушаются и принимают неправильную форму. Гемоглобин S имеет две бета-цепи, тогда как гемоглобин Хопкинс-2 имеет две альфа-цепи. Хопкинс-2 составляет 22% гемолизатов одиночных гетерозигот; следовательно, у этих пациентов есть нормальная версия гена. Гемолизаты - это продукты разрушения красных кровяных телец. Ho-2 также содержит 11% гемолизатов в «двойных» гетерозиготах, когда ген содержит как Hopkins-2, так и гемоглобин S.[23]
В настоящее время существует множество возможных объяснений того, как работает вариант Хопкинса-2 с гемоглобином. Одно объяснение, которое придумали ученые, состоит в том, что Ho-2 создается из-за точечной мутации, вызывающей замену гистидина аспарагиновой кислотой.[23] Другое объяснение состоит в том, что существует неравный кроссинговер между двумя α-генами, который объясняет замену гистидина аспарагиновой кислотой.[23] Затем это привело к делеции, происходящей в хромосоме, содержащей Ho-2. Эта делеция удаляет область, в которой N-конец находится в основной α-цепи, а где c-конец расположен на минорной α-цепи.[23] Удаление N-конца инактивирует ферменты и прекращает их способность разрезать цепи в определенных областях, что неизбежно повреждает цепь.
Тематические исследования
Были завершены тематические исследования некоторых пациентов, несущих генетическую мутацию гемоглобина Хопкинса-2 Сэмюэлем Шарашем и другими. После завершения исследований исследователи пришли к выводу, что многие носители мутации бессимптомны по серповидно-клеточной анемии и в целом довольно здоровы. Любые медицинские проблемы не имели отношения к серповидно-клеточной анемии. Эти исследования проводились в 1970-х годах.[8]
Семья Фуллер-Карр
Было пять носителей гемоглобина Хопкинса 2 в семье Фуллера-Карра и десять двойных гетерозигот Ho-2 и гемоглобина S.[24] Все носители были здоровы и имели нормальные гематологические анализы. Из тех, кто несет гемоглобин S и Ho-2 не было анемичный; но некоторые из исследованных показали повышенное количество ретикулоцитов.[24] Это измеряется с помощью анализа крови, который анализирует скорость производства красных кровяных телец костным мозгом и их выброса в кровь. В семье не было подозрений на симптоматическую серповидно-клеточную анемию.
Неизвестный ребенок
Было исследование на трехлетнем ребенке, который был носителем гемоглобинового варианта Хопкинса-2. У ребенка была легкая анемия и ретикулоцитоз, которые обычно наблюдаются при анемии.[25] Однако в крови не было обнаружено серповидных клеток, и у них не было никаких симптомов, связанных с серповидно-клеточным действием. Также был уменьшен средний корпускулярный объем (MCV), который является средним объемом эритроцит считать.[25]
Рекомендации
- ^ а б Клегг JB, Charache S (1978). «Структура гемоглобина Хопкинса-2». Гемоглобин. 2 (1): 85–8. Дои:10.3109/03630267808999194. PMID 646867.
- ^ а б Rucknagel DL, Winter WP (ноябрь 1974 г.). «Дублирование структурных генов альфа- и бета-цепей гемоглобина у человека». Летопись Нью-Йоркской академии наук. 241: 80–92. Bibcode:1974НЯСА.241 ... 80Р. Дои:10.1111 / j.1749-6632.1974.tb21868.x. PMID 4611311.
- ^ а б Блум М (1995). Понимание серповидноклеточной болезни. США: Университетское издательство Миссисипи. стр.3–6. ISBN 978-0878057450.
- ^ а б c Хилл Р.Л., Свенсон Р.Т., Шварц Х.С. (ноябрь 1960 г.). «Характеристика химического отклонения гемоглобина G». Журнал биологической химии. 235: 3182–7. PMID 13714317.
- ^ а б Итано Х.А., Робинсон Э.А. (ноябрь 1960 г.). «ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ альфа- и бета-цепей гемоглобина». Труды Национальной академии наук Соединенных Штатов Америки. 46 (11): 1492–501. Bibcode:1960PNAS ... 46.1492I. Дои:10.1073 / pnas.46.11.1492. ЧВК 223072. PMID 16590776.
- ^ Sugg DK (31 января 1995 г.). "Хопкинс находит лечение серповидными клетками". Балтимор Сан. Получено 8 марта, 2017.
- ^ а б Charache S, Ostertag W, von Ehrenstein G (декабрь 1971 г.). «Клинические исследования и физиологические свойства гемоглобина Хопкинса-2». Природа. 234 (51): 248–51. Дои:10.1038 / newbio234248a0. PMID 5288820.
- ^ а б c d е ж Уизералл, Д. Дж. (2001). «К молекулярной медицине; воспоминания о поле гемоглобина, 1960-2000». Британский журнал гематологии. 115 (4): 729–738. Дои:10.1046 / j.1365-2141.2001.03227.x. PMID 11843803.
- ^ "Что такое талассемия?". Детская больница UCSF Benioff. Получено 8 марта, 2017.
- ^ «Симптомы и причины - клиника Мэйо». Клиника Майо. Получено 2017-04-15.
- ^ Стинсма Д.П., Шампо М.А., Кайл Р.А. (август 2015 г.). «Макс Перуц и структура гемоглобина». Труды клиники Мэйо. 90 (8): e89. Дои:10.1016 / j.mayocp.2015.04.026. PMID 26250737.
- ^ Стоун MJ (октябрь 2003 г.). «Наследие Уильяма Ослера и его вклад в гематологию». Британский журнал гематологии. 123 (1): 3–18. Дои:10.1046 / j.1365-2141.2003.04615.x. PMID 14510937.
- ^ Брюэр ДБ (май 2006 г.). «Макс Шульце (1865 г.), Г. Бицзозеро (1882 г.) и открытие тромбоцитов». Британский журнал гематологии. 133 (3): 251–8. Дои:10.1111 / j.1365-2141.2006.06036.x. PMID 16643426.
- ^ Рибатти Д., Кривеллато Е. (октябрь 2007 г.). «Джулио Бицзозеро и открытие тромбоцитов». Исследование лейкемии. 31 (10): 1339–41. Дои:10.1016 / j.leukres.2007.02.008. PMID 17383722.
- ^ «Открытие и биологическая основа». www.nslc.wustl.edu. Получено 2017-04-15.
- ^ «Что такое серповидноклеточная болезнь? - NHLBI, NIH». www.nhlbi.nih.gov. Получено 2017-04-20.
- ^ Лоренцо-Медина М., Де-Ла-Иглесиа С., Роперо П., Ногейра-Салгейро П., Сантана-Бенитес Дж. (Ноябрь 2014 г.). «Влияние вариантов гемоглобина на значения a1c гемоглобина, измеренные с помощью метода высокоэффективной жидкостной хроматографии». Журнал диабетической науки и технологий. 8 (6): 1168–76. Дои:10.1177/1932296814538774. ЧВК 4455477. PMID 25355712.
- ^ "N-Baltimore.html". globin.bx.psu.edu. Получено 2017-03-30.
- ^ а б «Медицинские архивы - личные бумажные коллекции: коллекция К. Локкарда Конли». www.medicalarchives.jhmi.edu. Получено 2017-03-30.
- ^ "К. Локкард Лок Конли, Мэриленд (1915-2010)". www.matology.org. 2010-04-27. Получено 2017-03-30.
- ^ Макканн С (2016). История гематологии: от Геродота до ВИЧ. Издательство Оксфордского университета. ISBN 978-0-19-102713-0.[страница нужна ]
- ^ Хьюисман, Титус Х. Дж., Марианна Ф. Х. Карвер и Георгий Ефремов. Программа вариантов человеческого гемоглобина (1996). Огаста, Джорджия, США: Фонд серповидной анемии, 1996. Печать.[страница нужна ]
- ^ а б c d Ostertag W, von Ehrenstein G, Charache S (май 1972 г.). «Дублированные гены альфа-цепи в гемоглобине Хопкинса-2 человека и доказательства неравного кроссинговера между ними». Природа. 237 (72): 90–4. Дои:10.1038 / newbio237090a0. PMID 4503919.
- ^ а б Charache S, Ostertag W, von Ehrenstein G (май 1972 г.). «Клинические исследования и физиологические свойства гемоглобина Хопкинса-2». Природа. 237 (72): 88–90. Дои:10.1038 / newbio237088a0. PMID 4503918.
- ^ а б Стейнберг, Мартин Х. и др. Нарушения гемоглобина: генетика, патофизиология и клиническое ведение. Издательство Кембриджского университета, 2009.[страница нужна ]
