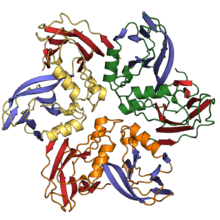
Желейный рулет - Jelly roll fold

В желе-ролл или же Свернуть швейцарский рулет это белковая складка или же сверхвторичная структура состоит из восьми бета-нити уложены в два четырехжильных листа. Название структуры ввел Джейн С. Ричардсон в 1981 году, что отражает его сходство с желе или рулет с вареньем торт.[2] Складка - это разработка Греческий ключевой мотив и иногда считается формой бета-баррель. Это очень распространено в вирусные белки, особенно вирусный капсид белки.[3][4] Взятые вместе, рулет из желе и ключевые греческие структуры составляют около 30% полностью бета-белки аннотируется в Структурная классификация белков (SCOP) база данных.[5]
Структура
Базовая структура желейного рулета состоит из восьми бета-нити расположены в два четырехжильных антипараллельный бета-листы, которые упаковываются в гидрофобный интерфейс. Нити традиционно обозначаются буквами от B до H по той исторической причине, что первая решенная структура белка капсида желе из рулона вирус кустистого трюка томата, имел дополнительную прядь А вне общего ядра складки.[6][7] Листы состоят из прядей BIDG и CHEF, сложенных таким образом, что прядь B упаковывается напротив пряди C, I - напротив H и т. Д.[4][8]
Вирусные белки
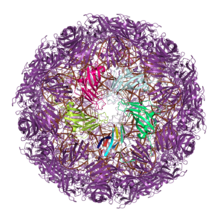
Большое количество вирусы строить их внешний вид капсиды из белков, содержащих одинарную или двойную складку желе. Считается, что эта общая капсидная архитектура отражает древние эволюционные отношения, возможно, возникшие до последний универсальный общий предок (LUCA) клеточной жизни.[8][9][10] (Сами закрытые белковые капсиды, вероятно, эволюционировали как минимум дважды, поскольку другие вирусные линии используют эволюционно неродственные белки для создания своих капсидов.[9][11])
Капсидные белки в виде рулета из одного желе
Белки капсида одного желе-ролла (JRC) обнаружены по крайней мере в шестнадцати различных вирусных семьи, в основном с икосаэдр структуры капсида и включая оба РНК-вирусы и ДНК-вирусы.[12] Однако большинство одиночных вирусов JRC одноцепочечные РНК-вирусы с положительным смыслом, и единственный двухцепочечные ДНК-вирусы с одинарными капсидами JRC являются Папилломавирусы и Polyomaviridae, оба довольно маленькие. Архитектура собранного капсида ориентирует ось рулона с желе параллельно или «горизонтально» относительно поверхности капсида.[11]
Двойной желейный рулет из белков
Этот раздел должен быть обновлено. Причина в следующем: известны недвойные вертикальные JR (Helvetiavirae ); нужно перефразировать. (Май 2020 г.) |

Капсидные белки двойного рулона желе состоят из двух одиночных складок рулона мармелада, соединенных короткой линкерной областью. Они встречаются исключительно в двухцепочечные ДНК-вирусы не менее девяти различных вирусных семейств, включая вирусы, поражающие все области жизни, и охватывающий широкий диапазон размеров капсидов.[4][11] В архитектуре капсида с двойным валком с желе ось валка с желе ориентирована перпендикулярно или «вертикально» относительно поверхности капсида. Считается, что белки двойного рулета желе произошли от белков одинарного рулета желе путем дупликация гена; однако, из-за основных различий в архитектуре и сборке, неясно, произошел ли капсид двойного рулона с желе непосредственно из капсида с одним рулетом с желе или две формы капсида представляют собой отдельные клоны адаптации от общих предковых белков рулона с желе.[11][14] Однако степень структурного сходства капсидов вирусов двойного желе-ролла привела к выводу, что эти вирусы, вероятно, имеют общее эволюционное происхождение, несмотря на их разнообразие по размеру и диапазону хозяев; это стало известно как PRD1 -аденовирус родословная (Bamfordvirae ).[14][15] Хотя большинство членов этой группы являются икосаэдрами, некоторые семьи, такие как Поксвириды и Ascoviridae имеют зрелые вирионы овальной или кирпичной формы; поксвирусы, такие как Вакцина претерпевают драматические конформационные изменения, опосредованные высокопроизводительными белками двойного желеобразного валика во время созревания и, вероятно, происходят от икосаэдрического предка.[11][16] Общие капсидные белки двойного желеобразного валика, наряду с другими гомологичными белками, также были процитированы в поддержку предложенного порядок Megavirales содержащий нуклеоцитоплазматические большие ДНК-вирусы (NCLDV).[17]
Белки двойного желе в клеточных белках не наблюдались; они кажутся уникальными для вирусов.[11] По этой причине обнаружение четких гомология чтобы удвоить желеобразные белки в последовательности полинтон / Maverick сменные элементы Широкое распространение в геномах эукариот считается свидетельством тесного эволюционного родства этих генетических элементов с вирусами.[18]
Некапсидные белки
Одиночные булочки с желе также встречаются в некапсидных вирусных белках, включая второстепенные компоненты собранных вирион а также невионные белки, такие как многогранник.[11]
Клеточные белки
В то время как двойные булочки с желе не встречаются в белках клеточного происхождения, встречаются одиночные булочки с желе.[11][19] Одним из таких классов клеточных белков является нуклеоплазмины, которые служат молекулярный шаперон белки для гистон сборка в нуклеосомы. В N-концевой домен нуклеоплазминов имеет единую складку желеобразного валика и собирается в пентамер.[20] Подобные структуры с тех пор были зарегистрированы в дополнительных группах хроматин ремоделирование белков.[21] Мотивы рулонов желе с идентичной связью с бета-листами также встречаются в фактор некроза опухоли лиганды[22] и белки из бактерий Иерсиний псевдотуберкулез которые принадлежат к классу вирусных и бактериальных белков, известных как суперантигены.[23][24]
В более широком смысле, члены чрезвычайно разнообразных надсемейство купинов также часто называют рулетами из желе; хотя общее ядро доменной структуры купина содержит только шесть бета-цепей, многие купины имеют восемь.[25] Примеры включают не-гем диоксигеназа ферменты[26][27] и JmjC -семья гистоновые деметилазы.[28][29]
Эволюция
Сравнительные исследования белков, классифицируемых как желейный рулет и Греческий ключ структуры предполагают, что ключевые греческие белки эволюционировали значительно раньше, чем их более топологически сложные аналоги в желе.[5] Структурная биоинформатика исследования, сравнивающие белки желеобразного капсида вируса с другими белками известной структуры, показывают, что белки капсида образуют хорошо разделенный кластер, предполагая, что они подвержены определенному набору эволюционных ограничений.[4] Одной из наиболее примечательных особенностей белков в виде желейного рулона вирусного капсида является их способность образовывать олигомеры в повторяющемся мозаичном образце с образованием закрытой белковой оболочки; клеточные белки, наиболее похожие по складке и топологии, в большинстве своем также являются олигомерами.[4] Было высказано предположение, что капсидные белки вирусного желе-ролла произошли из клеточных белков-желе-роллов, возможно, в нескольких независимых случаях, на самых ранних стадиях клеточной эволюции.[19]
История и номенклатура
Название «желейный рулет» впервые было использовано для структуры, состоящей из разработки Греческий ключевой мотив к Джейн С. Ричардсон в 1981 году и должен был отражать сходство структуры с желе или рулет с вареньем торт.[2] Структура получила множество описательных названий, включая клин, бета-ствол и бета-валок. Края двух листов не сходятся, образуя правильные водородная связь паттерны, и поэтому это часто не считается истинным бета-баррель.[3] Клеточные белки, содержащие структуры, похожие на желеобразные, можно описать как купин сгиб, а JmjC складка или двухцепочечная бета-спираль.[27]
Рекомендации
- ^ а б Ларсон, Стивен Б.; День, Джон С .; Макферсон, Александр (29 августа 2014 г.). «Спутниковый вирус табачной мозаики с разрешением 1,4 Å». Acta Crystallographica Раздел D. 70 (9): 2316–2330. Дои:10.1107 / S1399004714013789. ЧВК 4157444. PMID 25195746.
- ^ а б Ричардсон, Дж. С. (1981). «Анатомия и таксономия структуры белка». Достижения в химии белков Том 34. Успехи в химии белков. 34. С. 167–339. Дои:10.1016 / S0065-3233 (08) 60520-3. ISBN 9780120342341. PMID 7020376.
- ^ а б Челванаягам, Гарет; Геринга, Яап; Аргос, Патрик (ноябрь 1992 г.). «Анатомия и эволюция белков, отображающих топологию вирусного капсида». Журнал молекулярной биологии. 228 (1): 220–242. Дои:10.1016 / 0022-2836 (92) 90502-Б. PMID 1447783.
- ^ а б c d е Ченг, Шаньшань; Брукс, Чарльз Л .; Livesay, Деннис Р. (7 февраля 2013 г.). «Белки вирусного капсида разделены в пространстве структурной складки». PLoS вычислительная биология. 9 (2): e1002905. Bibcode:2013PLSCB ... 9E2905C. Дои:10.1371 / journal.pcbi.1002905. ЧВК 3567143. PMID 23408879.
- ^ а б Эдвардс, Ханна; Абельн, Санне; Дин, Шарлотта М .; Оренго, Кристина А. (14 ноября 2013 г.). "Изучение предпочтений складчатого пространства новорожденных и древних белковых суперсемейств". PLoS вычислительная биология. 9 (11): e1003325. Дои:10.1371 / journal.pcbi.1003325. ЧВК 3828129. PMID 24244135.
- ^ Harrison, S.C .; Олсон, А. Дж .; Schutt, C.E .; Winkler, F.K .; Бриконь, Г. (23 ноября 1978 г.). «Вирус кустистого каскадерства томатов с разрешением 2,9 Å». Природа. 276 (5686): 368–373. Bibcode:1978Натура 276..368H. Дои:10.1038 / 276368a0. PMID 19711552.
- ^ Россманн, Майкл Г .; Абад-Сапатеро, Селерино; Murthy, Mathur R.N .; Лиляс, Ларс; Джонс, Т. Олвин; Страндберг, Брор (апрель 1983 г.). «Структурные сравнения некоторых маленьких сферических вирусов растений». Журнал молекулярной биологии. 165 (4): 711–736. Дои:10.1016 / S0022-2836 (83) 80276-9. PMID 6854630.
- ^ а б Бенсон, Стейси Д .; Bamford, Jaana K.H .; Bamford, Dennis H .; Бернетт, Роджер М. (декабрь 2004 г.). «Обнаруживает ли общая архитектура вирусное происхождение, охватывающее все три области жизни?». Молекулярная клетка. 16 (5): 673–685. Дои:10.1016 / j.molcel.2004.11.016. PMID 15574324.
- ^ а б Фортер, Патрик; Прангишвили, Давид (сентябрь 2009 г.). «Происхождение вирусов». Исследования в области микробиологии. 160 (7): 466–472. Дои:10.1016 / j.resmic.2009.07.008. PMID 19647075.
- ^ Холмс, Э. К. (30 марта 2011 г.). «Что эволюция вирусов говорит нам о происхождении вирусов?». Журнал вирусологии. 85 (11): 5247–5251. Дои:10.1128 / JVI.02203-10. ЧВК 3094976. PMID 21450811.
- ^ а б c d е ж грамм час Крупович, Март; Бэмфорд, Деннис Х (август 2011 г.). «Двухцепочечные ДНК-вирусы: 20 семейств и только пять различных архитектурных принципов сборки вирионов». Текущее мнение в вирусологии. 1 (2): 118–124. Дои:10.1016 / j.coviro.2011.06.001. PMID 22440622.
- ^ Крупович М (2013). «Сети эволюционных взаимодействий, лежащие в основе полифилетического происхождения вирусов оцДНК». Текущее мнение в области вирусологии. 3 (5): 578–586. Дои:10.1016 / j.coviro.2013.06.010. PMID 23850154.
- ^ а б Abrescia, Nicola G.A .; Граймс, Джонатан М .; Kivelä, Hanna M .; Ассенберг, Рене; Саттон, Джефф Ч .; Мясник, Сара Дж .; Bamford, Jaana K.H .; Bamford, Dennis H .; Стюарт, Дэвид I. (сентябрь 2008 г.). «Понимание эволюции вирусов и биогенеза мембран на основе структуры морского липид-содержащего бактериофага PM2». Молекулярная клетка. 31 (5): 749–761. Дои:10.1016 / j.molcel.2008.06.026. PMID 18775333.
- ^ а б Крупович, Март; Бэмфорд, Деннис Х. (декабрь 2008 г.). «Эволюция вируса: как далеко простирается вирусная линия с двойным β-стволом?». Обзоры природы Микробиология. 6 (12): 941–948. Дои:10.1038 / nrmicro2033. PMID 19008892.
- ^ Кунин Е.В., Доля В.В., Крупович М., Варсани А., Вольф Ю.И., Ютин Н., Зербини М., Кун Дж. Х. (октябрь 2019 г.). «Создать мегатаксономическую структуру, заполняющую все основные таксономические ранги, для ДНК-вирусов, кодирующих главные белки капсида вертикального желеобразного типа». Предложение ICTV (Taxoprop): 2019.003G. Дои:10.13140 / RG.2.2.14886.47684.
- ^ Bahar, Mohammad W .; Грэм, Стивен С .; Стюарт, Дэвид I; Граймс, Джонатан М. (июль 2011 г.). «Понимание эволюции сложного вируса из кристаллической структуры вируса осповакцины D13». Структура. 19 (7): 1011–1020. Дои:10.1016 / j.str.2011.03.023. ЧВК 3136756. PMID 21742267.
- ^ Колсон, Филипп; Де Ламбальери, Ксавье; Ютин Наталья; Асгари, Сасан; Фанат, Ив; Бидеши, Деннис К .; Чэн, Сяо-Вэнь; Federici, Brian A .; Ван Эттен, Джеймс Л .; Кунин, Евгений В .; Ла Скола, Бернар; Рауль, Дидье (29 июня 2013 г.). ""Megavirales ", предлагаемый новый порядок для эукариотических нуклеоцитоплазматических больших ДНК-вирусов". Архив вирусологии. 158 (12): 2517–2521. Дои:10.1007 / s00705-013-1768-6. ЧВК 4066373. PMID 23812617.
- ^ Крупович, Март; Бэмфорд, Деннис Н; Кунин, Евгений V (2014). «Сохранение основных и второстепенных белков капсида желе в транспозонах Polinton (Maverick) предполагает, что они являются настоящими вирусами». Биология Директ. 9 (1): 6. Дои:10.1186/1745-6150-9-6. ЧВК 4028283. PMID 24773695.
- ^ а б Крупович, М; Кунин, Е.В. (2017). «Множественное происхождение белков вирусного капсида от предков клеток». Proc Natl Acad Sci U S A. 114 (12): E2401 – E2410. Дои:10.1073 / pnas.1621061114. ЧВК 5373398. PMID 28265094.
- ^ Дутта, Шучисмита; Akey, Ildikó V .; Дингуолл, Колин; Хартман, Кари Л .; Лауэ, Том; Нолти, Роберт Т .; Head, Джеймс Ф .; Эйки, Кристофер В. (октябрь 2001 г.). «Кристаллическая структура ядра нуклеоплазмина». Молекулярная клетка. 8 (4): 841–853. Дои:10.1016 / S1097-2765 (01) 00354-9. PMID 11684019.
- ^ Эдлих-Мут, Кристиан; Артеро, Жан-Батист; Кэллоу, Фил; Przewloka, Marcin R .; Уотсон, Александра А .; Чжан, Вэй; Гловер, Дэвид М .; Дебски, Януш; Дадлез, Михал; Round, Adam R .; Форсайт, В. Тревор; Лауэ, Эрнест Д. (май 2015 г.). «Пентамерная нуклеоплазминовая складка присутствует в FKBP39 дрозофилы и в большом количестве белков, связанных с хроматином». Журнал молекулярной биологии. 427 (10): 1949–1963. Дои:10.1016 / j.jmb.2015.03.010. ЧВК 4414354. PMID 25813344.
- ^ Бодмер, Жан-Люк; Шнайдер, Паскаль; Цхопп, Юрг (январь 2002 г.). «Молекулярная архитектура суперсемейства TNF» (PDF). Тенденции в биохимических науках. 27 (1): 19–26. Дои:10.1016 / S0968-0004 (01) 01995-8. PMID 11796220.
- ^ Донадини, Роберта; Лью, Чу Вай; Kwan, Ann H.Y .; Mackay, Joel P .; Поля, Барри А. (март 2004 г.). «Кристаллы и структуры раствора суперантигена из Yersinia pseudotuberculosis обнаруживают складку желе-валика». Структура. 12 (1): 145–156. Дои:10.1016 / j.str.2003.12.002. PMID 14725774.
- ^ Фрейзер, Джон Д .; Профт, Томас (октябрь 2008 г.). «Бактериальный суперантиген и суперантигеноподобные белки». Иммунологические обзоры. 225 (1): 226–243. Дои:10.1111 / j.1600-065X.2008.00681.x. PMID 18837785.
- ^ Хури, S; Баккер, FT; Данвелл, JM (апрель 2001 г.). «Филогения, функция и эволюция купинов, структурно консервативного, функционально разнообразного суперсемейства белков». Молекулярная биология и эволюция. 18 (4): 593–605. Дои:10.1093 / oxfordjournals.molbev.a003840. PMID 11264412.
- ^ Озер, Абдулла; Бруик, Ричард К. (март 2007 г.). «Негемовые диоксигеназы: клеточные сенсоры и регуляторы желе в одном флаконе?». Природа Химическая Биология. 3 (3): 144–153. Дои:10.1038 / nchembio863. PMID 17301803.
- ^ а б Айк, ВэйШен; МакДонаф, Майкл А; Талхаммер, Армин; Чоудхури, Рашедуззаман; Шофилд, Кристофер Дж (декабрь 2012 г.). «Роль складки желе-ролла в связывании субстрата 2-оксоглутарат оксигеназами». Текущее мнение в структурной биологии. 22 (6): 691–700. Дои:10.1016 / j.sbi.2012.10.001. PMID 23142576.
- ^ Чен, Чжунчжоу; Занг, Цзянье; Ветстин, Джонатан; Хун, Ся; Давразу, Фотейни; Кутателадзе, Татьяна Г .; Симпсон, Майкл; Мао, Цилун; Пан, Чхол-Хо; Дай, Шаодун; Хэгмен, Джеймс; Хансен, Кирк; Ши, Ян; Чжан, Гунъи (май 2006 г.). «Структурное понимание деметилирования гистонов членами семьи JMJD2». Клетка. 125 (4): 691–702. Дои:10.1016 / j.cell.2006.04.024. PMID 16677698.
- ^ Клозе, Роберт Дж .; Чжан И (7 марта 2007 г.). «Регулирование метилирования гистонов путем деметилирования и деметилирования». Обзоры природы Молекулярная клеточная биология. 8 (4): 307–318. Дои:10.1038 / nrm2143. PMID 17342184.
внешняя ссылка
- Антипараллельные β-домены, раздел из Анатомия и таксономия структуры белка Джейн С. Ричардсон
- Желейный рулет жизни Жаклин Хамфрис в Мелочи учтены, блог, спонсируемый Американское общество микробиологии