N-Гидроксифталимид - N-Hydroxyphthalimide - Wikipedia
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2-гидроксиизоиндол-1,3-дион | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.007.600 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C8ЧАС5NО3 | |
| Молярная масса | 163.132 г · моль−1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
N-Гидроксифталимид это N-гидроксипроизводное фталимид. Соединение используется, среди прочего, так как катализатор за реакции окисления, в частности, для селективного окисления (например, алканы к спирты ) с молекулярный кислород в мягких условиях.[1][2]
Возникновение и производство
Синтез N-гидроксифталимид из фталоилхлорид и гидроксиламина гидрохлорид в присутствии карбоната натрия в водном растворе впервые сообщил Лассар Кон в 1880 году (называемый «фталилгидроксиламин»).[3]
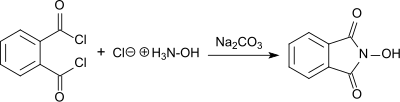
Продукт имеет красный цвет. натриевая соль в базовых условиях, пока белый N-гидроксифталимид выпадает в осадок с выходом 55%, так как раствор подкисленный. N-гидроксифталимид также получают реакцией гидрохлорида гидроксиламина с диэтилфталат в присутствии ацетат натрия,[4] или с фталевый ангидрид в присутствии карбонат натрия с подогревом. В последнем случае общий выход 76% получается после очистки с помощью перекристаллизация.[5]
Микроволновое облучение фталевого ангидрида и гидрохлорида гидроксиламина в пиридин производит N-гидроксифталимид с выходом 81%.[6] Даже в отсутствие основания фталевый ангидрид и фосфат гидроксиламина реагируют с образованием N-гидроксифталимид с выходом 86% при нагревании до 130 ° C.[7]

Характеристики
N-Гидроксифталимид представляет собой кристаллический порошок от бесцветного до желтого цвета без запаха, растворимый в воде и органических растворителях, таких как уксусная кислота, ацетат этила и ацетонитрил.[8] Состав существует в двух разных цветах. моноклинные кристаллические формы. В случае бесцветной белой формы NГруппа -ОН повернута примерно на 1,19 ° от плоскости молекулы, в то время как в желтой форме она намного ближе к планарности (поворот на 0,06 °).[9]
Цвет синтезированного N-гидроксифталимид зависит от типа используемого растворителя; переход цвета от белого к желтому необратим.[10] N-гидроксифталимид образует сильно окрашенные, в основном желтые или красные соли с щелочь и тяжелые металлы, аммиак и амины.[11] Гидролиз N-гидроксифталимид путем добавления сильных оснований образует моно фталевую кислоту.гидроксамовая кислота к добавление воды через одну из связей углерод – азот.[4] N-гидроксифталимидные эфиры, с другой стороны, бесцветны и обеспечивают О-алкилгидроксиламины щелочным гидролизом или расщеплением через гидразингидрат.
Известно, что «фталилгидроксиламин», о котором сообщил Кон, обладает молекулярная формула из C
8ЧАС
5НЕТ
3 но точная структура неизвестна.[3] Обсуждались три возможности, которые показаны на рисунке ниже:оксим фталевого ангидрида («фталоксим», я), расширенный кольцо с двумя гетероатомами, (2,3-бензоксазин-1,4-дион, II), и N-гидроксифталимид (III).[10][12] Только в 1950-х годах продукт Кона был определенно продемонстрирован как (III), N-гидроксифталимид.[13]

Заявки и реакции
Нефкенс и Тессер разработали методику генерации активные эфиры из N-гидроксифталимид[14] для использования в пептидный синтез,[15] подход, позже расширенный до использования N-гидроксисукцинимид.[16] Сложноэфирная связь образуется между N-гидроксифталимид и карбоновая кислота к устранение воды, сцепление достигается с N,N '-дициклогексилкарбодиимид (DCC). Для пептидного синтеза N-конце растущего пептида защищенный с терт-бутилоксикарбонил в то время как его C-конце (Z-NH-CH (R) -COOH) соединяется с N-гидроксифталимид. An сложный эфир следующего аминокислота в желаемой пептидной последовательности встряхивают с активированным сложным эфиром, добавляя к цепи и вытесняя N-гидроксифталимид. Эта реакция является количественной и почти мгновенной при 0 ° C.[15][17] Образовавшийся сложный эфир необходимо гидролизовать перед повторением цикла.

В N-гидроксифталимид можно удалить встряхиванием с бикарбонат натрия,[15] но N-гидроксисукцинимидный подход демонстрирует большую реакционную способность и удобство и обычно является предпочтительным.[16][17]
Сложные эфиры N-гидроксифталимид и активированный сульфоновые кислоты Такие как ангидрид трифторметансульфоновой кислоты или же п-толуолсульфонилхлорид используются как так называемые фотокислоты, которые отщепляют протоны при УФ-облучении.

Генерируемые протоны служат для целевой локальной деградации кислоточувствительных фоторезисты.[18]
N-гидроксифталимид можно превратить винилацетатом в присутствии ацетата палладия (II) в N-винилоксифталимид, который количественно гидрируется до N-этоксифталимид и после очистки расщеплением с получением О-этилгидроксиламин.[19]

Различные функциональные группы могут быть окислены аминооксильный радикал (фталимид-N-оксил, ПИНО)[20] образованный отрывом атома водорода от N-гидроксифталимид в мягких условиях (аналогично ТЕМП ):[1]
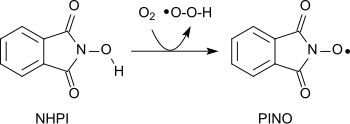
Используя молекулярный кислород, алканы могут быть окислены с образованием спиртов, вторичные спирты - до кетонов, ацеталей - до сложных эфиров и алкенов - до эпоксиды.[21][22][23] Амиды могут быть превращены в карбонильные соединения с N-гидроксифталимид и соли кобальта (II) в мягких условиях.[24]

Особый технический интерес представляют эффективные реакции окисления предшественников важных основных химических веществ. Например, ε-капролактам может быть получен с использованием NHPI из так называемого масла КА (масло «кетон-спирт», смесь циклогексанола и циклогексанона), которое получают при окислении циклогексана. Реакция протекает через гидропероксид циклогексанола, который реагирует с аммиаком с образованием пероксидициклогексиламина с последующей перегруппировкой в присутствии каталитических количеств хлорида лития.[22][25]

Использование N-гидроксифталимид в качестве катализатора при окислении масла КА позволяет избежать образования нежелательного побочного продукта сульфата аммония, который получают обычным синтезом ε-капролактама (Перестановка Бекмана оксима циклогексанона с серная кислота ).
Алканы превращаются в нитроалканы в присутствии диоксида азота.[26]
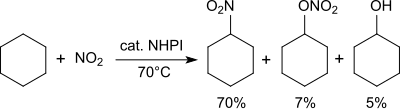
Циклогексан преобразуется при 70 ° C диоксидом азота / воздухом в смесь нитроциклогексана (70%), циклогексилнитрата (7%) и циклогексанола (5%).
Кроме того, приложения N-гидроксифталимид как окислитель в фотографические разработчики[27] и в качестве агентов контроля заряда в тонерах[28] были описаны в патентной литературе.
Фталимидо-N-оксил (PINO)
Радикал, полученный удалением H-атома из N-гидроксифталимид называется N-фталимидо-N-оксил, аббревиатура Пино. Это мощный агент абстрагирования атомов водорода.[1] Энергия диссоциации связи NHPI (то есть PINO-H) составляет 88-90 ккал / моль, в зависимости от растворителя.[29]
Рекомендации
- ^ а б c Рекуперо, Франческо; Пунта, Карло (2007). "Свободнорадикальная функционализация органических соединений, катализируемая N-Гидроксифталимид ». Chem. Ред. 107 (9): 3800–3842. Дои:10.1021 / cr040170k. PMID 17848093.
- ^ Мелоне, Лючио; Пунта, Карло (2013). «Безметалловое аэробное окисление, опосредованное N-гидроксифталимид. Краткий обзор ». Beilstein J. Org. Chem. 9: 1296–1310. Дои:10.3762 / bjoc.9.146. PMID 23843925.
- ^ а б Кон, Лассар (1880). «Phthalylhydroxylamin: Ueberführung der Phthalsäure in Salicylsäure» [N-гидроксифталимид: превращение фталевой кислоты в салициловую кислоту]. Justus Liebigs Ann. Chem. (на немецком). 205 (3): 295–314. Дои:10.1002 / jlac.18802050304.
- ^ а б Бауэр, Людвиг; Мярка, Стэнли В. (1957). "Химия N-Гидроксифталимид ». Варенье. Chem. Soc. 79 (8): 1983–1985. Дои:10.1021 / ja01565a061.
- ^ Gross, H .; Кейтель, И. (1969). "Zur Darstellung von N-Гидроксифталимид унд N-Гидроксисукцинимид »[О препарате N-гидроксифталимид и N-гидроксисукцинимид]. J. Prakt. Chem. (на немецком). 311 (4): 692–693. Дои:10.1002 / prac.19693110424.
- ^ Сугамото, Кадзухиро; Мацусита, Йох-ичи; Камеда, Ю-хей; Сузуки, Масахико; Мацуи, Таканао (2005). "Синтез с помощью СВЧ N-Гидроксифталимид производные ». Synth. Commun. 35 (1): 67–70. Дои:10.1081 / SCC-200046498.
- ^ Заявка на Европейский патент 1085013, Эльке Фриц-Лангхалс, "Verfahren zur Herstellung cyclischer" N-Гидроксидикарбоксимид (процесс получения циклического N-гидроксидикарбоксимиды) », опубликовано 21 марта 2001 г., передано Consortium für elektrochemische Industrie GmbH
- ^ Гамбаротти, Кристиан; Пунта, Карло; Рекуперо, Франческо; Злоторжинская Мария; Сэммис, Гленн (2013). «N-гидроксифталимид». N-Гидрофталимид. Энциклопедия реагентов для органического синтеза. Дои:10.1002 / 047084289X.rn00598.pub2. ISBN 978-0471936237.
- ^ Райхельт, Хендрик; Faunce, Chester A .; Paradies, Генрих Х. (2007). «Неуловимые формы и структуры N-гидроксифталимид: бесцветные и желтые кристаллические формы N-гидроксифталимид ». J. Phys. Chem. А. 111 (13): 2587–2601. Дои:10.1021 / jp068599y. PMID 17388355.
- ^ а б Эймс, Д. Э .; Грей, Т. Ф. (1955). "N-Гидроксиимиды. Часть II. Производные гомофталевой и фталевой кислот ». J. Chem. Soc.: 3518–3521. Дои:10.1039 / JR9550003518.
- ^ Порчедду, Андреа; Джакомелли, Джампаоло (2009). «Синтез оксимов и гидроксамовых кислот». В Раппапорте, Цви; Либерман, Джоэл Ф. (ред.). Химия гидроксиламинов, оксимов и гидроксамовых кислот, часть 1. Чичестер: Wiley. С. 224–226. ISBN 978-0-470-51261-6.
- ^ Брэдли, Оскар Л .; Бейкер, Лесли С.; Гольдштейн, Ричард Ф .; Харрис, Сэмюэл (1928). «LXVIII. - Изомерия оксимов. Часть XXXIII. Оксимы опиановой кислоты и фталевого ангидрида». J. Chem. Soc.: 529–539. Дои:10.1039 / JR9280000529.
- ^ Херд, Чарльз Д.; Бесс, Чарльз М .; Бауэр, Людвиг (1954). «Янтарная и фтало-гидроксамовая кислоты». J. Org. Chem. 19 (7): 1140–1149. Дои:10.1021 / jo01372a021.
- ^ Nefkens, G.H.L .; Tesser, G.I .; Нивард, Р. Дж. Ф. (1962). «Синтез и реакции сложных эфиров N-гидроксифталимид и N-защищенные аминокислоты ». Рекл. Trav. Чим. Pays-Bas. 81 (8): 683–690. Дои:10.1002 / recl.19620810807.
- ^ а б c Nefkens, G.H.L .; Тессер, Г. И. (1961). «Новый активированный эфир в синтезе пептидов». Варенье. Chem. Soc. 83 (5): 1263. Дои:10.1021 / ja01466a068.
- ^ а б Андерсон, Джордж В .; Циммерман, Джоан Э .; Каллахан, Фрэнсис М. (1964). "Использование сложных эфиров N-Гидроксисукцинимид в синтезе пептидов ». Варенье. Chem. Soc. 86 (9): 1839–1842. Дои:10.1021 / ja01063a037.
- ^ а б Бодански, Миклош (1993). «Активация и связь». Принципы синтеза пептидов (2-е изд.). Springer-Verlag. С. 9–61. Дои:10.1007/978-3-642-78056-1_2. ISBN 9783642780561.
- ^ 0919867, К. Элиан, Э. Гюнтер, Р. Лойшнер
- ^ 1995025090, D.M.C. Каллант, A.M.C.F. Castelijns, J.G. De Vries
- ^ С. Козери (2009), «Фталимид-N-оксил (PINO) радикал, мощный каталитический агент: его создание и универсальность в отношении различных органических субстратов», Катал. Rev. Sci. Англ., 51 (2), стр. 218–292, Дои:10.1080/01614940902743841
- ^ Ю. Исии, К. Накаяма, М. Такено, С. Сакагути, Т. Ивахама, Ю. Нишияма (1995), "Новый катализатор" N-Гидроксифталимид в окислении органических субстратов молекулярным кислородом », J. Org. Chem., 60 (13), стр. 3934–3935, Дои:10.1021 / jo00118a002CS1 maint: несколько имен: список авторов (связь)
- ^ а б «Открытие катализатора образования углеродного радикала и его применение в органическом синтезе» (PDF). TCIMAIL, номер 116. Tokyo Chemical Industry Co. Ltd. Апрель 2003 г.. Получено 2016-08-11.
- ^ Б. Б. Вентцель, M.P.J. Доннерс, П. Альстерс, М. Feiters, R.J.M. Нолти (2000) "N-Гидроксифталимид / кобальт (II), катализируемый низкотемпературным бензильным окислением с использованием молекулярного кислорода », Тетраэдр, 56 (39), стр. 7797–7803, Дои:10.1016 / S0040-4020 (00) 00679-7CS1 maint: несколько имен: список авторов (связь)
- ^ Ф. Миниски, К. Пунта, Ф. Рекуперо, Ф. Фонтана, Г. Ф. Педулли (2002), "Аэробное окисление N-Алкиламиды, катализируемые N-Гидроксифталимид в мягких условиях. Полярные и энтальпийные эффекты », J. Org. Chem., 67 (8), стр. 2671–2676, Дои:10.1021 / jo016398e, PMID 11950315CS1 maint: несколько имен: список авторов (связь)
- ^ О. Фукуда, С. Сакагути, Ю. Исии (2001), «Новая стратегия каталитического окисления Байера-Виллигера КА-масла молекулярным кислородом с использованием N-гидроксифталимид », Tetrahedron Lett., 42 (20), стр. 3479–3481, Дои:10.1016 / S0040-4039 (01) 00469-5CS1 maint: несколько имен: список авторов (связь)
- ^ С. Сакагути, Ю. Нишиваки, Т. Китамура, Ю. Исии (2001), «Эффективное каталитическое нитрование алканов с NO2 на воздухе с помощью N-гидроксифтальмид », Энгью. Chem., Int. Редактировать., 40 (1), стр. 222–224, Дои:10.1002 / 1521-3773 (20010105) 40: 1 <222 :: AID-ANIE222> 3.0.CO; 2-WCS1 maint: несколько имен: список авторов (связь)
- ^ Заявка EP 0664479, W. Ishikawa & T. Sampei, "Метод обработки галогенидсеребряного фотографического светочувствительного материала", опубликованный 1994-7-26, передан Konica Corp.
- ^ США 5332637, Дж. К. Уилсон; С.М. Bonser & H.W. Osterhoudt, "Электростатографические сухие композиции тонера и проявителя с гидроксифталимидом", выпущенный 1994-7-26, переуступленный Eastman Kodak Co.
- ^ Козери, Серджиу (2009). «Фталимид-N-оксил (PINO) радикал, мощный каталитический агент: его создание и универсальность для различных органических субстратов». Обзоры катализа. 51 (2): 218–292. Дои:10.1080/01614940902743841.
