Фомоксантон А - Phomoxanthone A
 | |
| Имена | |
|---|---|
| Название ИЮПАК [(3R, 4R, 4aR) -5 - [(5R, 6R, 10aR) -5-Ацетилокси-10a- (ацетилоксиметил) -1,9-дигидрокси-6-метил-8-оксо-6,7-дигидро- 5H-ксантен-4-ил] -4-ацетилокси-8,9-дигидрокси-3-метил-1-оксо-3,4-дигидро-2H-ксантен-4a-ил] метилацетат | |
| Другие имена PXA | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Свойства | |
| C38ЧАС38О16 | |
| Молярная масса | 750,70 г / моль |
| Внешность | желтое твердое вещество |
| Плотность | ~ 1,53 г / см3 |
| не растворим | |
| Растворимость в ДМСО | хорошо, но нестабильно[1] |
| Растворимость в EtOH | умеренный[1] |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
В микотоксин фомоксантон А, или PXA короче, это токсичный натуральный продукт что влияет на митохондрии. Это наиболее токсичный и наиболее изученный из встречающихся в природе фомоксантоны. Недавно было показано, что PXA вызывает быстрое неканоническое деление митохондрий вызывая митохондриальный матрикс фрагментировать, пока внешняя митохондриальная мембрана может оставаться нетронутым. Было показано, что этот процесс не зависит от деления митохондрий и слияние регуляторы DRP1 и OPA1.[1]
Свойства и структура

Фомоксантоны названы в честь гриба. Фомопсис, от которого они были впервые изолированы, а после их ксантоноид структура, что означает, что они имеют структуру, аналогичную составу ксантон (на фото слева). Химически фомоксантоны являются димерами двух тетрагидроксантонов, что означает, что они состоят из двух субъединиц ксантоноидов, которые имеют четыре гидроксильные группы каждый. Две субъединицы фомоксантонов: ковалентно связаны друг с другом. Сам PXA является гомодимером, что означает, что он состоит из двух идентичных субъединиц. Обе эти субъединицы диацетилированный тетрагидроксантоны, поэтому две из их гидроксильных групп были заменены на ацетильные группы. Положение связи между двумя димерными субъединицами - единственное структурное различие между PXA и его менее токсичными изомерами. фомоксантон B (PXB) и dicerandrol C: В PXA два ксантоноидных мономера симметрично связаны в положении C-4,4 ', в то время как в PXB они асимметрично связаны в положении C-2,4', а в дицерандроле C они симметрично связаны в положении C-2. , 2 '. В остальном эти три соединения структурно идентичны.[2][3] Фомоксантоны структурно тесно связаны с секалоновые кислоты, еще один класс димерных тетрагидроксантоновых микотоксинов, с которыми они имеют несколько общих свойств. Примечательно, что и фомоксантоны, и секалоновые кислоты нестабильны при растворении в полярные растворители такие как ДМСО, с Ковалентная связь между двумя мономерами, переходящими между 2,2'-, 2,4'- и 4,4'-связями.[4] Таким образом, два фомоксантона PXA и PXB могут медленно изомеризация друг в друга, а также в практически нетоксичный дицерандрол C, что приводит к потере активности PXA с течением времени при растворении в полярном растворителе.[1]
Вхождение
Так как натуральные продукты, PXA и другие фомоксантоны встречаются как вторичные метаболиты у грибов одноименного рода Фомопсис, особенно у видов Фомопсис лонгиколла.[2][3] Этот грибок эндофит мангровых растений Sonneratia caseolaris.[5][3] Однако он также был идентифицирован как патоген и у других растений, таких как соя растение, у которого вызывает заболевание, называемое Фомопсис гниль семян (PSD).[6][7]
Подготовка
И PXA, и PXB были открыты в 2001 году, и их получение путем изоляции от Фомопсис грибковые культуры описаны в соответствующей публикации.[2] Вкратце MeOH выписка из Фомопсис культура смешана с ЧАС2О и промыт гексан. Затем водную фазу сушат и остаток растворяют в EtOAc, промытый H2O, концентрированный и повторно очищенный эксклюзионная хроматография. Полученная смесь PXA и PXB разделяется ВЭЖХ. В 2013 году был описан модифицированный метод, при котором начальная экстракция выполняется EtOAc вместо MeOH, а этап сушки пропускается.[3]
Использует
Фомоксантон А был впервые обнаружен при скрининге на противомалярийный соединения.[2] Он показал сильную антибиотическую активность против множественная лекарственная устойчивость штамм основного возбудителя малярия, то простейшие паразит Плазмодий falciparum. В том же исследовании также сообщалось об антибиотической активности PXA против Микобактерии туберкулеза и против трех линий клеток животных, две из которых были получены из раковых клеток человека.[2] Эти результаты не только показали, что PXA обладает антибиотической активностью в отношении самых разных организмов, но также вызвали дальнейшие исследования, в которых PXA рассматривалась как потенциальная антибиотик или противораковый препарат. В более позднем исследовании также сообщалось об активности антибиотика PXA против водорослей. Хлорелла фуска, гриб Ustilago violacea, а бактерия Bacillus megaterium.[8] Этот широкий диапазон активности делает его непригодным как специфический антибиотик, который можно использовать для лечения инфекционные заболевания, однако надежда на то, что его можно использовать как противораковое средство, оставалась. Предварительные результаты исследования раковых и нераковых клеток человека показали, что PXA может быть более токсичным для первых, чем для вторых, хотя результаты исследований in vivo еще не представлены.[3][9]
Помимо потенциального медицинского применения, недавние открытия показывают, что PXA может найти применение в качестве исследовательского инструмента для изучения динамики митохондриальных мембран, особенно неканонического деления митохондрий и ремоделирования митохондриального матрикса.[1]
Биологическая активность
Поскольку PXA обладает антибиотической активностью против таких разнообразных организмов, как бактерии, простейшие, грибки, растения и клетки животных, включая раковые клетки человека, он должен влиять на клеточные свойства, которые эволюционно высоко консервативны. Недавнее исследование показало, что PXA напрямую влияет на митохондрии, нарушая как их биохимические функции, так и архитектуру их мембран.[1] Митохондрии клеточные органеллы которые присутствуют почти во всех эукариоты. Согласно теории симбиогенез, они получены из бактерий и имеют много общих с ними характеристик, включая некоторые свойства их мембранного состава.[10][11]
Одна из основных функций митохондрий - производить клеточную энергетическую валюту. АТФ через процесс окислительного фосфорилирования (OxPhos). OxPhos зависит от митохондриальной мембранный потенциал, который порождается электронная транспортная цепь (ETC) за счет потребления кислород. Было показано, что PXA влияет на все эти функции митохондрий: он не только снижает синтез АТФ и деполяризует митохондрии, но также подавляет ETC и потребление клеточного кислорода. Это отличает его от разобщающие агенты такие как протонофоры. Хотя они также уменьшают синтез АТФ и деполяризуют митохондрии, они одновременно увеличивают дыхание из-за повышенной активности ETC в попытке восстановить мембранный потенциал.[1]
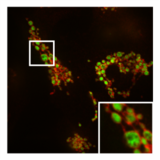
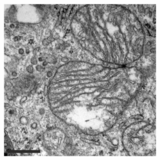
Помимо этого ингибирования функции митохондрий, PXA также нарушает архитектуру их мембран. Во многих типах клеток митохондрии обычно образуют сложную трубчатую сеть, которая подвергается постоянному процессу сбалансированного деления митохондрий и митохондриальное слияние. Лечение PXA или многими другими митохондриальными стрессорами, такими как протонофоры, вызывает чрезмерное деление, которое приводит к фрагментации митохондрий. В случае PXA, однако, было показано, что этот процесс фрагментации отличается от канонической фрагментации, вызванной другими агентами, такими как протонофоры, несколькими способами: во-первых, он происходит значительно быстрее, приводя к полной фрагментации в течение минуты, а не примерно 30–60 минут на каноническую фрагментацию; во-вторых, он не зависит от регуляторов деления и слияния митохондрий DRP1 и OPA1; и, в-третьих, в то время как PXA вызывает фрагментацию как внешняя митохондриальная мембрана (OMM) и митохондриальный матрикс в дикого типа клеток, это вызывает исключительную фрагментацию матрицы в клетках, в которых отсутствует DRP1.[1] Эта последняя особенность особенно необычна, поскольку у высших эукариот не известен активный механизм эксклюзивного деления матрицы.[12] Исследование ультраструктуры митохондрий показало, что PXA вызывает кристы нарушение и полное искажение митохондриального матрикса. Вероятно, благодаря этому эффекту PXA вызывает запрограммированную гибель клеток в виде апоптоз.[1]
- Влияние PXA на морфологию и ультраструктуру митохондрий
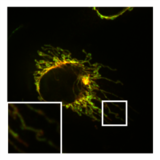
Нормальная трубчатая морфология митохондрий в HeLa ячейка, в которой посредник деления DRP1 был выбит. Наложение изображения митохондриальный матрикс (зеленый) и OMM (красный).
использованная литература
- ^ а б c d е ж г час я j Бёлер, Филипп; Штульдрейер, Фабиан; Ананд, Ручика; Кондади, Арун Кумар; Шлютерманн, Дэвид; Берлет, Никлас; Дейтерсен, Яна; Валлот-Хиеке, Нора; Ву, Вэньсянь; Франк, Мэриан; Ниманн, Хендрик; Весбуер, Элизабет; Барбиан, Андреас; Люйтен, Томас; Парис, Ян Б. Вайдткамп-Петерс, Стефани; Борхардт, Андреа; Райхерт, Андреас С; Пенья-Бланко, Аида; Гарсиа-Саес, Ана Дж; Ицканов, Самуил; Ван дер Блик, Александр М; Прокш, Петр; Вессельборг, Себастьян; Аист, Бьорн (2018). «Микотоксин фомоксантон А нарушает форму и функцию внутренней митохондриальной мембраны». Смерть и болезнь клеток. 9 (3): 286. Дои:10.1038 / s41419-018-0312-8. ЧВК 5833434. PMID 29459714.
- ^ а б c d е Исака, Масахико; Джатурапат, Амонлая; Руксери, Камолчанок; Данвисетканджана, Каннават; Тантичароэн, Моракот; Фебтаранонт, Йодхатхай (2001). "Фомоксантоны A и B, новые димеры ксантона из эндофитных грибов" Фомопсис Виды ». Журнал натуральных продуктов. 64 (8): 1015–8. Дои:10.1021 / np010006h. PMID 11520217.
- ^ а б c d е Ренсберг, Дэвид; Деббаб, Абдессамад; Манди, Аттила; Васильева, Вера; Бёлер, Филипп; Аист, Бьёрн; Энгельке, Лаура; Хамахер, Александра; Савадого, Ричард; Дидерих, Марк; Рэй, Виктор; Линь, Вэньхань; Кассак, Маттиас Ю; Яняк, Кристоф; Шой, Стефани; Вессельборг, Себастьян; Куртан, Тибор; Али, Амаль Х; Прокш, Питер (2013). «Проапоптотические и иммуностимулирующие димеры тетрагидроксантона из эндофитного грибка Фомопсис лонгиколла". Журнал органической химии. 78 (24): 12409–25. Дои:10.1021 / jo402066b. PMID 24295452.
- ^ Цинь, Тянь; Ивата, Такаяки; Рэнсом, Таня Т; Бейтлер, Джон А; Порко, Джон А (2015). «Синтезы димерных тетрагидроксантонов с различными связями: исследование свойств, изменяющих форму». Журнал Американского химического общества. 137 (48): 15225–33. Дои:10.1021 / jacs.5b09825. ЧВК 4863954. PMID 26544765.
- ^ Xing, X.K; Чен, Дж; Xu, M.J; Lin, W.H; Го, S.X (2011). «Эндофиты грибов, связанные с мангровыми растениями Sonneratia (Sonneratiaceae) на южном побережье Китая». Лесная патология. 41 (4): 334. Дои:10.1111 / j.1439-0329.2010.00683.x.
- ^ Хоббс, Томас В; Шмиттеннер, А. Ф; Кутер, Джеффри А. (1985). «Новый вид фомопсиса из сои». Микология. 77 (4): 535. Дои:10.2307/3793352. JSTOR 3793352.
- ^ Ли, Шусянь; Дарвиш, Омар; Алхаруф, Надим В .; Мусунгу, Брайан; Мэтьюз, Бенджамин Ф (2017). «Анализ последовательности генома Phomopsis longicolla: грибкового патогена, вызывающего гниение семян Phomopsis в сое». BMC Genomics. 18. Дои:10.1186 / с12864-017-4075-х. PMID 28870170.
- ^ Эльзэссер, Бригитта; Крон, Карстен; Флёрке, Ульрих; Рут, Наталья; Ауст, Ханс-Юрген; Дрегер, Зигфрид; Шульц, Барбара; Антус, Шандор; Куртан, Тибор (2005). «Определение структуры рентгеновских лучей, абсолютной конфигурации и биологической активности фомоксантона А». Европейский журнал органической химии. 2005 (21): 4563. Дои:10.1002 / ejoc.200500265.
- ^ Франк, М; Niemann, H; Böhler, P; Аист, Б; Wesselborg, S; Линь, Вт; Прокщ, П (2015). «Фомоксантон А - от мангровых лесов до противораковой терапии». Современная лекарственная химия. 22 (30): 3523–32. Дои:10.2174/0929867322666150716115300. PMID 26179997.
- ^ Мартин, Уильям Ф; Гарг, Шрирам; Зиморский, Верена (2015). "Эндосимбиотические теории происхождения эукариот". Философские труды Королевского общества B: биологические науки. 370 (1678): 20140330. Дои:10.1098 / rstb.2014.0330. ЧВК 4571569. PMID 26323761.
- ^ Милейковская, Е; Dowhan, W (2009). «Кардиолипиновые мембранные домены у прокариот и эукариот». Biochimica et Biophysica Acta. 1788 (10): 2084–2091. Дои:10.1016 / j.bbamem.2009.04.003. ЧВК 2757463. PMID 19371718.
- ^ Ван дер Блик, А. М; Шен, Q; Каваджири, S (2013). «Механизмы деления и слияния митохондрий». Перспективы Колд-Спринг-Харбор в биологии. 5 (6): a011072. Дои:10.1101 / cshperspect.a011072. ЧВК 3660830. PMID 23732471.
внешние ссылки
 СМИ, связанные с Фомоксантон в Wikimedia Commons
СМИ, связанные с Фомоксантон в Wikimedia Commons