Фосфоглюкомутаза - Phosphoglucomutase
| Фосфоглюкомутаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 5.4.2.2 | ||||||||
| Количество CAS | 9001-81-4 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Фосфоглюкомутаза (EC 5.4.2.2 ) является фермент который передает фосфатная группа на α-D-глюкоза мономер от положения 1 'до 6' в прямом направлении или от положения 6 'до 1' в обратном направлении.
Точнее, это способствует взаимному преобразованию глюкозо-1-фосфат и глюкозо-6-фосфат.
Биологическая функция
Роль в гликогенолизе
После гликогенфосфорилаза катализирует фосфоролитическое отщепление глюкозильного остатка от гликоген полимер, освобожденная глюкоза имеет фосфат группа на его 1-углеродном. Это глюкозо-1-фосфат молекула Сама по себе не является полезным промежуточным продуктом метаболизма, но фосфоглюкомутаза катализирует превращение этого глюкозо-1-фосфата в глюкозо-6-фосфат (механизм этой реакции см. ниже).
Метаболическая судьба глюкозо-6-фосфата зависит от потребностей клетка в момент его создания. Если в клетке мало энергии, то глюкозо-6-фосфат будет перемещаться вниз по гликолитический путь, в конечном итоге давая две молекулы аденозинтрифосфат. Если клетке необходимы промежуточные продукты биосинтеза, глюкозо-6-фосфат попадет в пентозофосфатный путь, где он претерпит серию реакций, чтобы дать рибозы и / или НАДФН, в зависимости от клеточных условий.
Если в печени происходит гликогенолиз, глюкозо-6-фосфат может быть превращается в глюкозу ферментом глюкозо-6-фосфатаза; глюкоза, производимая в печени, затем попадает в кровоток для использования в других органах. Мышечные клетки, напротив, не имеют фермента глюкозо-6-фосфатазы, поэтому они не могут делиться своими запасами гликогена с остальным телом.
Роль в гликогенезе
Фосфоглюкомутаза также действует противоположным образом при высоком уровне глюкозы в крови. В этом случае фосфоглюкомутаза катализирует превращение глюкозо-6-фосфата (который легко образуется из глюкозы под действием гексокиназа ) до глюкозо-1-фосфата.
Этот глюкозо-1-фосфат может затем реагировать с UTP уступить UDP-глюкоза в реакции, катализируемой UDP-глюкозо-пирофосфорилаза. Если активирован инсулин, гликогенсинтаза продолжит закрепление глюкозы из комплекса UDP-глюкоза на полимере гликогена.
Механизм реакции
Фосфоглюкомутаза влияет на сдвиг фосфорильной группы, заменяя фосфорильную группу на субстрат.[1] Изотопная маркировка эксперименты подтвердили, что эта реакция протекает через глюкозо-1,6-бисфосфат средний.[2]
Первым этапом прямой реакции является перенос фосфорильной группы от фермента на глюкозо-1-фосфат с образованием глюкозо-1,6-бисфосфата и выходом дефосфорилированной формы фермента.[2] Затем фермент подвергается быстрой диффузионной переориентации, чтобы правильно расположить 1-фосфат бисфосфатного промежуточного соединения относительно дефосфорилированного фермента.[3] Взаимосвязь субстрата и скорости и тесты индуцированного транспорта показали, что дефосфорилированный фермент затем облегчает перенос фосфорильной группы от промежуточного глюкозо-1,6-бисфосфата к ферменту, регенерируя фосфорилированную фосфоглюкомутазу и давая глюкозо-6-фосфат (в прямом направлении ).[4][5] Более поздние структурные исследования подтвердили, что единственным участком фермента, который фосфорилируется и дефосфорилируется, является кислород активный сайт серин остаток (см. диаграмму ниже).[6][7] Бивалентный металл ион, обычно магний или же кадмий, необходим для ферментативной активности, и было показано, что он непосредственно образует комплекс с фосфорильной группой, этерифицированной до серина в активном центре.[8]
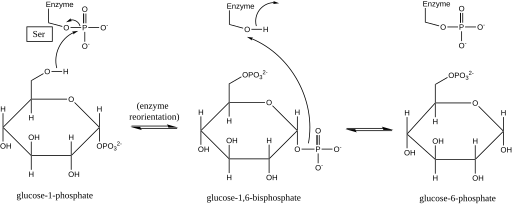
Это образование промежуточного глюкозо-1,6-бисфосфата аналогично взаимному превращению 2-фосфоглицерат и 3-фосфоглицерат катализируется фосфоглицератмутаза, в котором 2,3-бисфосфоглицерат генерируется как промежуточное звено.[9]
Структура
В то время как фосфоглюкомутаза из мышц кролика послужила прототипом для большей части выяснения структуры этого фермента, более новые бактерия -производные кристаллические структуры демонстрируют многие из тех же определяющих характеристик.[10] Каждый мономер фосфоглюкомутазы можно разделить на четыре домена последовательности, I-IV, в зависимости от пространственной конфигурации фермента по умолчанию (см. Изображение справа).[11]
Каждый мономер состоит из четырех различных структурных единиц α / β, каждая из которых содержит одну из четырех цепей в каждой цепи мономера. β-лист и состоит только из остатков в заданном домене последовательности (см. изображение справа).[11] Захоронение активного центра (включая Ser-116, критический остаток фермента, который фосфорилируется и дефосфорилируется) в гидрофобный внутренняя часть фермента служит для исключения воды из непродуктивного гидролизующий важные фосфоэфирные связи, при этом позволяя субстрату получить доступ к активному центру.[12]
Актуальность болезни
Мышцы человека содержат две фосфоглюкомутазы с почти идентичными каталитическими свойствами, PGM I и PGM II.[13] Одна или другая из этих форм отсутствует у некоторых людей врожденно.[14]
Дефицит PGM - чрезвычайно редкое заболевание, не имеющее набора хорошо описанных физиологических симптомов. Это состояние может быть обнаружено in vitro исследование анаэробный гликолиз, который обнаруживает блок на пути к молочная кислота производство после глюкозо-1-фосфата, но до глюкозо-6-фосфата.[15]
Дефицит PGM1 известен как Синдром CDG тип 1t (CDG1T, ранее известный как болезнь накопления гликогена тип 14 (GSD XIV).[16]
Гены
Смотрите также
Рекомендации
Эта статья не хватает ISBN для книг, перечисленных в нем. (Июнь 2011 г.) |
- ^ Джаганнатан, V; Удача, JM (1949). «Фосфоглюкомутаза; механизм действия». Журнал биологической химии. 179 (2): 569–75. PMID 18149991.
- ^ а б Наджар, В. А .; Пуллман, М. Э. (1954). «Возникновение группового переноса с участием фермента (фосфоглюкомутаза) и субстрата». Наука. 119 (3097): 631–4. Bibcode:1954Научный ... 119..631N. Дои:10.1126 / science.119.3097.631. PMID 13156640.
- ^ Рэй WJ, Пек EJ (1972). «Фосфомутазы». Ферменты. Нью-Йорк: Academic Press.[страница нужна ]
- ^ Рэй, Уильям Дж .; Роскелли, Гертруда А. (1964). «Кинетическое исследование пути фосфоглюкомутазы». Журнал биологической химии. 239 (4): 1228–36. PMID 14165931.
- ^ Britton, HG; Кларк, Дж. Б. (1968). «Механизм фосфоглюкомутазной реакции. Исследования фосфоглюкомутазы в мышцах кролика с помощью методов флюса». Биохимический журнал. 110 (2): 161–80. Дои:10.1042 / bj1100161. ЧВК 1187194. PMID 5726186.
- ^ Райджр, Вт; Милдван, А; Груцнер, Дж (1977). «Исследования фосфоглюкомутазы и ее комплексов с ионами металлов» на фосфорном ядерном магнитном резонансе. Архивы биохимии и биофизики. 184 (2): 453–63. Дои:10.1016/0003-9861(77)90455-6. PMID 23074.
- ^ Рэй-младший, WJ; Хермодсон, Массачусетс; Puvathingal, JM; Махони, WC (1983). «Полная аминокислотная последовательность фосфоглюкомутазы мышц кролика». Журнал биологической химии. 258 (15): 9166–74. PMID 6223925.
- ^ Рью, Гьюнг Им; Рэй-младший, Уильям; Маркли, Джон Л. (1984). «Ферментно-связанные промежуточные продукты в превращении глюкозо-1-фосфата в глюкозо-6-фосфат фосфоглюкомутазой. Исследования ЯМР фосфора». Биохимия. 23 (2): 252–60. Дои:10.1021 / bi00297a013. PMID 6230103.
- ^ Сазерленд, EW; Кон, М. (1949). «Механизм фосфоглюкомутазной реакции». Журнал биологической химии. 180 (3): 1285–95. PMID 18148026.
- ^ Мехра-Чаудхари, Ритча; Мик, Джейкоб; Таннер, Джон Дж .; Henzl, Michael T .; Бимер, Леса Дж. (2011). «Кристаллическая структура бактериальной фосфоглюкомутазы, фермента, участвующего в вирулентности множества патогенов человека». Белки: структура, функции и биоинформатика. 79 (4): 1215–29. Дои:10.1002 / prot.22957. ЧВК 3066478. PMID 21246636.
- ^ а б Дай, JB; Лю, Y; Рэй-младший, WJ; Конно, М. (1992). «Кристаллическая структура мышечной фосфоглюкомутазы уточнена с разрешением 2,7 ангстрем». Журнал биологической химии. 267 (9): 6322–37. PMID 1532581.
- ^ Рэй, Уильям Дж .; Puvathingal, Joseph M .; Лю, Ивэй (1991). «Формирование комплексов субстрата и аналога переходного состояния в кристаллах фосфоглюкомутазы после удаления кристаллизационной соли». Биохимия. 30 (28): 6875–85. Дои:10.1021 / bi00242a011. PMID 1829964.
- ^ Джоши, JG; Хэндлер, П. (1969). «Фосфоглюкомутаза. VI. Очистка и свойства фосфоглюкомутаз из мышц человека». Журнал биологической химии. 244 (12): 3343–51. PMID 4978319.
- ^ Браун Д.Х. (1986). «Метаболизм гликогена и гликолиз в мышцах». Миология. Нью-Йорк: Макгроу-Хилл. С. 673–95.
- ^ Суги, H; Кобаяши, Дж; Суги, Y; Ичимура, М; Миямото, Р. Ито, Т; Симидзу, К; Игараси, Y (1988). «Инфантильная болезнь накопления гликогена в мышцах: дефицит фосфоглюкомутазы с пониженным уровнем карнитина в мышцах и сыворотке». Неврология. 38 (4): 602–5. Дои:10.1212 / WNL.38.4.602. PMID 2965317.
- ^ Орфанет: болезнь накопления гликогена из-за дефицита фосфоглюкомутазы
внешняя ссылка
- Фосфоглюкомутаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)

