Фоторедокс-катализ - Photoredox catalysis
Фоторедокс-катализ это филиал катализ который использует энергию свет ускорить химическая реакция через одноэлектронный перенос События.[1][2][3][4][5] Эта область названа как комбинация «фото-» со ссылкой на свет и редокс, сжатое выражение для химических процессов снижение и окисление. В частности, для фотоокислительного катализа используются небольшие количества светочувствительного соединения, которое при возбуждении светом может опосредовать перенос электроны между химическими соединениями, которые обычно вообще не вступают в реакцию. Фотоокислительные катализаторы обычно получают из трех классов материалов: комплексов переходных металлов, органических красителей и полупроводники. Хотя в 1990-х и начале 2000-х годов преобладали органические фотоокислительные катализаторы,[6] растворимые комплексы переходных металлов сегодня более широко используются.
![Принципиальная схема [Ru (bipy) 3] 2+, типичного фотоокислительного катализатора](http://upload.wikimedia.org/wikipedia/commons/thumb/3/32/Ru%28bipy%29_Schematic.png/220px-Ru%28bipy%29_Schematic.png)
Изучение этой области катализа привело к разработке новых методов осуществления известных и новых химических превращений. Катализаторы фотоокислительного восстановления обычно гораздо менее токсичны, чем традиционные реагенты, используемые для получения свободные радикалы, Такие как оловоорганическое вещество соединения. Кроме того, фотоокислительные катализаторы генерируют сильные окислительно-восстановительные агенты при воздействии света, они не реагируют при нормальных условиях. Таким образом, фотоокислительные катализаторы на основе комплексов переходных металлов более привлекательны, чем стехиометрический окислительно-восстановительные агенты, такие как хиноны. Свойства фотоокислительных катализаторов на основе переходных металлов зависят от лигандов и металла и могут быть изменены для различных целей.
Фоторедокс-катализ часто применяется для получения известных реакционноспособных промежуточных продуктов новым способом и привел к открытию новых органических реакций, таких как первая прямая функционализация β-арилирование насыщенных альдегиды. В то время как D3-симметричные комплексы переходных металлов, используемые во многих фотоокислительно-каталитических реакциях, являются хиральный, энантиообогащенные фотоокислительные катализаторы привели только к низким уровням энантиоселективность в реакции ариларильного сочетания, катализируемой фотоокислительным катализатором, что позволяет предположить, что хиральная природа этих катализаторов все еще плохо переносит стереохимический Информация.[7] Хотя синтетически полезные уровни энантиоселективности не были достигнуты с использованием одних хиральных фотоокислительных катализаторов, энантиоселективность была получена за счет синергетической комбинации фотоокислительного катализа с хиральными органокатализаторами, такими как вторичные амины и кислоты Бренстеда.[8]
Фотохимия сенсибилизаторов переходных металлов
Сенсибилизаторы поглощают свет, создавая окислительно-восстановительные возбужденные состояния. Для многих сенсибилизаторов на основе металлов возбуждение реализуется как перенос заряда от металла к лиганду, посредством чего электрон перемещается из металла (например, d-орбитали) на орбиталь, локализованную на лигандах (например, π * орбитальный ароматического лиганда). Начальное возбужденное электронное состояние релаксирует до синглетного возбужденного состояния с наименьшей энергией через внутренняя конверсия, процесс, при котором энергия рассеивается в виде энергии колебаний, а не электромагнитного излучения. Это синглетное возбужденное состояние может далее релаксировать посредством двух различных процессов: катализатор может флуоресценция, излучающий фотон и возвращающийся в синглетное основное состояние, или он может перейти в возбужденное триплетное состояние с наименьшей энергией (состояние, в котором два неспаренных электрона имеют одинаковый спин) посредством второго безызлучательного процесса, называемого межсистемный переход.
Прямая релаксация возбужденного триплета в основное состояние, названная фосфоресценция, требует как испускания фотона, так и инверсии спина возбужденного электрона. Этот путь медленный, потому что он запрещено вращать поэтому триплетное возбужденное состояние имеет значительное среднее время жизни. Для обычного фотосенсибилизатора трис- (2,2’-бипиридил) рутений (сокращенно [Ru (bipy)3]2+ или [Ru (bpy)3]2+) время жизни триплетного возбужденного состояния составляет примерно 1100 нс. Этого времени жизни достаточно для того, чтобы другие пути релаксации (в частности, пути переноса электронов) произошли до распада катализатора до его основного состояния.

Долгоживущее триплетное возбужденное состояние, доступное при фотовозбуждении, является более мощным. Восстановитель и более мощный окислитель чем основное состояние катализатора. Поскольку сенсибилизатор координационно насыщен, перенос электронов должен происходить через внешняя сфера процесс, где электрон туннели между катализатором и подложкой.
Перенос электрона во внешнюю сферу
Маркус теория внешнего переноса электрона предсказывает, что такой процесс туннелирования будет происходить наиболее быстро в системах, где перенос электронов является термодинамически благоприятным (то есть между сильными восстановителями и окислителями) и где перенос электронов имеет низкий внутренний барьер.
Внутренний барьер переноса электрона возникает из-за Принцип Франка – Кондона, утверждая, что электронный переход происходит быстрее, учитывая большее перекрытие между начальным и конечным электронными состояниями. В широком смысле этот принцип предполагает, что барьер электронного перехода связан со степенью, в которой система стремится к реорганизации. Для электронного перехода с системой барьер связан с «перекрытием» между начальной и конечной волновыми функциями возбужденного электрона, т.е. степень, в которой электрон должен «двигаться» при переходе.
В межмолекулярном переносе электрона аналогичную роль играет степень, в которой ядра стремятся двигаться в ответ на изменение их нового электронного окружения. Сразу после переноса электрона ядерное устройство молекулы, ранее находившееся в равновесии, теперь представляет собой колебательно-возбужденное состояние и должно релаксировать до своей новой равновесной геометрии. Жесткие системы, геометрия которых не сильно зависит от степени окисления, поэтому испытывают меньшее колебательное возбуждение во время переноса электрона и имеют более низкий внутренний барьер. Фотокатализаторы, такие как [Ru (bipy)3]2+, удерживаются в жестком положении плоскими бидентатными лигандами, расположенными в восьмигранный геометрия вокруг металлического центра. Следовательно, комплекс не подвергается значительной реорганизации при переносе электрона. Поскольку перенос электронов в этих комплексах происходит быстро, он, вероятно, имеет место в течение продолжительности активного состояния катализатора, то есть во время жизни триплетного возбужденного состояния.

Регенерация катализатора
Заключительным этапом фотокаталитического цикла является регенерация фотокатализатора в его основном состоянии. На этой стадии катализатор существует в основном состоянии в окисленной или восстановленной формах, в зависимости от того, передал он или принял электрон. Эти состояния окисления имеют сильную движущую силу для возврата к их равновесному состоянию окисления и действуют как мощный одноэлектронный восстановитель или окислитель, удовлетворяя эту движущую силу.
Чтобы восстановить исходное основное состояние, катализатор должен участвовать во втором внешнесферном переносе электрона. Во многих случаях этот перенос электрона происходит с помощью стехиометрического двухэлектронного восстановителя или окислителя, хотя в некоторых случаях на этом этапе задействован второй реагент. Цикл восстановительного гашения - это когда катализатор в возбужденном состоянии сначала восстанавливается, а затем окисляется, чтобы вернуться в свое состояние покоя. И наоборот, цикл окислительного гашения - это когда катализатор в возбужденном состоянии сначала окисляется, а затем восстанавливается, чтобы вернуться в свое состояние покоя. Эти два цикла можно различить Эксперимент Стерна – Фольмера.
Поскольку этап переноса электрона каталитического цикла происходит из триплетного возбужденного состояния, он конкурирует с фосфоресценцией как путь релаксации. Эксперимент Штерна-Фольмера измеряет интенсивность фосфоресценции при изменении концентрации каждого возможного гасящего агента. Когда концентрация действующего гасящего агента изменяется, это влияет на скорость переноса электронов и степень фосфоресценции. Эта связь моделируется уравнением:
Здесь я0 и I обозначают интенсивность излучения в присутствии тушителя и без него, kq константа скорости процесса закалки, τ0 время жизни возбужденного состояния в отсутствие гасящего агента и [Q] концентрация гасящего агента. Таким образом, если время жизни в возбужденном состоянии фотоокислительного катализатора известно из других экспериментов, константа скорости гашения в присутствии одного компонента реакции может быть определена путем измерения изменения интенсивности излучения при изменении концентрации гасящего агента.
Фотофизические свойства
Редокс-потенциалы
Окислительно-восстановительные потенциалы фотоокислительных катализаторов должны быть согласованы с другими компонентами реакции. В то время как окислительно-восстановительные потенциалы основного состояния легко измерить с помощью циклическая вольтамперометрия или другие электрохимические методы, измерение окислительно-восстановительного потенциала электронно-возбужденного состояния не может быть выполнено непосредственно этими методами.[9] Однако существуют два метода, которые позволяют оценивать окислительно-восстановительные потенциалы возбужденного состояния, и один метод существует для прямого измерения этих потенциалов. Чтобы оценить окислительно-восстановительные потенциалы возбужденного состояния, одним из методов является сравнение скоростей переноса электронов из возбужденного состояния в ряд реагентов основного состояния, окислительно-восстановительные потенциалы которых известны. Более распространенный метод оценки этих потенциалов - использовать уравнение, разработанное Ремом и Веллером, которое описывает потенциалы возбужденного состояния как поправку потенциалов основного состояния:
В этих формулах E *1/2 представляет собой восстановительный или окислительный потенциал возбужденного состояния, E1/2 представляет собой восстановительный или окислительный потенциал основного состояния, E0,0 представляет собой разницу в энергии между нулевыми колебательными состояниями основного и возбужденного состояний, а wр представляет рабочая функция, электростатическое взаимодействие, которое возникает из-за разделения зарядов, которое происходит во время переноса электрона между двумя химическими соединениями. Энергия возбуждения, равная нулю, E0,0 обычно аппроксимируется соответствующим переходом в спектре флуоресценции. Этот метод позволяет рассчитывать приблизительные окислительно-восстановительные потенциалы возбужденного состояния на основе более легко измеряемых окислительно-восстановительных потенциалов основного состояния и спектроскопических данных.
Прямое измерение окислительно-восстановительных потенциалов возбужденного состояния возможно с помощью метода, известного как фазомодулированный. вольтамперометрия. Этот метод работает, направляя свет на электрохимическую ячейку, чтобы генерировать желаемые частицы в возбужденном состоянии, но для модуляции интенсивности света. синусоидально, так что концентрация возбужденного состояния непостоянна. Фактически, концентрация частиц в возбужденном состоянии в ячейке должна изменяться точно по фазе с интенсивностью света, падающего на электрохимическую ячейку. Если потенциал, приложенный к клетке, достаточно силен для переноса электронов, изменение концентрации окислительно-восстановительного возбужденного состояния можно измерить как переменный ток (AC). Кроме того, фазовый сдвиг переменного тока относительно интенсивности падающего света соответствует среднему времени жизни разновидности возбужденного состояния до того, как она участвует в переносе электрона.
Таблицы окислительно-восстановительных потенциалов для наиболее распространенных фотоокислительных катализаторов доступны для быстрого доступа.[10]
Электроотрицательность лиганда
Относительную восстановительную и окислительную природу этих фотокатализаторов можно понять, учитывая электроотрицательность лигандов и металлический центр каталитического комплекса. Более электроотрицательные металлы и лиганды могут стабилизировать электроны лучше, чем их менее электроотрицательные аналоги. Следовательно, комплексы с большим количеством электроотрицательных лигандов являются более окислительными, чем комплексы с менее электроотрицательными лигандами. Например, лиганды 2,2'-бипиридин и 2,2'-фенилпиридин представляют собой изоэлектронные структуры, содержащие одинаковое количество и расположение электронов. Фенилпиридин заменяет один из атомов азота в бипиридине на атом углерода. Углерод менее электроотрицателен, чем азот, поэтому он менее плотно удерживает электроны. Поскольку остальная часть молекулы лиганда идентична, а фенилпиридин удерживает электроны менее плотно, чем бипиридин, он является более электронодонорным и менее электроотрицательным в качестве лиганда. Следовательно, комплексы с фенилпиридиновыми лигандами более сильно восстанавливают и менее сильно окисляют, чем эквивалентные комплексы с бипиридиновыми лигандами.
Точно так же фторированный фенилпиридиновый лиганд более электроотрицателен, чем фенилпиридин, поэтому комплексы с фторсодержащими лигандами более сильно окисляют и менее сильно восстанавливают, чем эквивалентные незамещенные фенилпиридиновые комплексы. Электронное влияние металлического центра на комплекс более сложное, чем влияние лиганда. Согласно Шкала Полинга электроотрицательности, как рутений и иридий имеют электроотрицательность 2,2. Если бы это был единственный фактор, относящийся к окислительно-восстановительным потенциалам, то комплексы рутения и иридия с одними и теми же лигандами должны быть одинаково мощными фотоокислительными катализаторами. Однако, учитывая уравнение Рема-Веллера, спектроскопические свойства металла играют роль в определении окислительно-восстановительных свойств возбужденного состояния.[11] В частности, параметр E0,0 связано с длиной волны излучения комплекса и, следовательно, с величиной стоксова сдвига - разницы в энергии между максимальным поглощением и излучением молекулы. Как правило, комплексы рутения имеют большие стоксовы сдвиги и, следовательно, низкую длину волны излучения и малую энергию возбуждения, равную нулю, по сравнению с комплексами иридия. Фактически, в то время как комплексы рутения в основном состоянии могут быть сильными восстановителями, комплекс в возбужденном состоянии является гораздо менее сильным восстановителем или окислителем, чем его эквивалентный комплекс иридия. Это делает иридий предпочтительным для развития общих органических превращений, поскольку более высокие окислительно-восстановительные потенциалы возбужденного катализатора позволяют использовать более слабые стехиометрические восстановители и окислители или использовать менее реакционноспособные субстраты.[11]
Приложения
Восстановительное дегалогенирование
Восстановительное дегалогенирование удаление галоген атомы из молекулы. Однако традиционный метод дегалогенирования использует стехиометрические оловоорганические реагенты, такие как гидрид трибутилолова. Хотя эта реакция мощная с высоким функциональная группа толерантности, оловоорганические реагенты очень токсичны. Расщепление активированных и восстановительно лабильных функциональных групп, включая сульфоний и галогены, является самым ранним применением фотоокислительного катализа в органическом синтезе, но ранние попытки были ограничены необходимостью в конкретных субстратах или образованием димерных продуктов связывания.[12][13][14][15][16] Известны более общие методы.[17] В одном методе используется [Ru (bipy)3]2+ в качестве фотокатализатора и стехиометрического аминного восстановителя для восстановления «активированных» углерод-галогеновых связей, таких как связи с соседней карбонильной группой или ареном. Эти связи считаются активированными, поскольку радикал, который они образуют при фрагментации, стабилизируется конъюгацией с карбонильной группой или ареном соответственно. Стехиометрический восстановитель, присутствующий в этой реакции, переносит электрон, чтобы восстановить катализатор в возбужденном состоянии до степени окисления Ru (I). Восстановленный катализатор затем перемещает перенесенный электрон на галогенированный субстрат, уменьшая слабую связь C-X и вызывая фрагментацию.
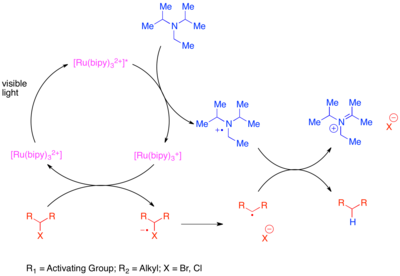
Неактивированные углерод-йодные связи можно восстановить, используя сильно восстанавливающий фотокатализатор трис- (2,2’-фенилпиридин ) иридий (Ir (ppy)3).[18] Эта реакция механически отличается от предыдущего превращения активированных бромидов и хлоридов. Повышенный восстановительный потенциал Ir (ppy)3 по сравнению с [Ru (bipy)3]2+ позволяет прямое восстановление связи углерод-иод без взаимодействия со стехиометрическим восстановителем. Таким образом, комплекс иридия переносит электрон на подложку, вызывая фрагментацию подложки и окисляя катализатор до степени окисления Ir (IV). Окисленный фотокатализатор возвращается в исходное состояние окисления за счет окисления реакционных добавок.

Подобно опосредованным оловом реакциям радикального дегалогенирования, фотокаталитическое восстановительное дегалогенирование может быть использовано для инициирования каскадных циклизаций с целью быстрого создания молекулярной сложности.[19] В этой работе радикальная каскадная циклизация, которая закрывает два пятичленных цикла и формирует два новых стереоцентра, дает хороший выход. Этот протокол восстановительного дегалогенирования был ключевым этапом в полном синтезе натурального продукта (+) - глиокладина С.[20]

Окислительная генерация ионов иминия
Иминиум ионы сильные электрофилы полезен для создания связей C-N в сложных молекулах. Однако конденсация амины с карбонил соединений с образованием ионов иминия часто бывает неблагоприятным, иногда требуя жестких условий дегидратации. Таким образом, альтернативные методы получения иминиевого иона, в частности, окислением из соответствующего амина, являются ценным инструментом синтеза. Иминий-ионы могут быть получены из активированных аминов с использованием Ir (dtbbpy) (ppy)2ПФ6 в качестве фотоокислительного катализатора.[21] Предполагается, что это превращение происходит путем окисления амина до аминий радикальный катион возбужденным фотокатализатором. Далее следует перенос атома водорода к суперстехиметрическому окислителю, такому как трихлорметильный радикал (CCl3 с образованием иминиевого иона). Затем иминиевый ион гасится реакцией с нуклеофилом. Связанные превращения аминов с широким спектром других нуклеофилы были исследованы, например, цианид (Реакция Стрекера ), силиловые эфиры енола (Реакция Манниха ), диалкилфосфаты, аллилсиланы (аза-Сакураи реакция ), индолы (Реакция Фриделя-Крафтса ) и ацетилиды меди.[22][23][24][25][26]

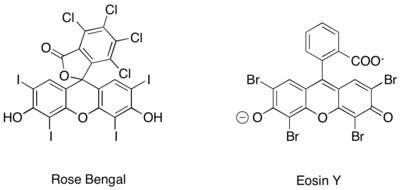
Аналогичное фотоокислительное генерирование ионов иминия, кроме того, было достигнуто с использованием чисто органических фотоокислительных катализаторов, таких как Роза Бенгалия и Eosin Y.[27][28][29]
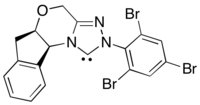
Асимметричный вариант этой реакции использует эквиваленты ацильных нуклеофилов, образованные N-гетероциклический карбен катализ.[30] Этот метод реакции позволяет обойти проблему плохой энантиоиндукции хиральных фотоокислительных катализаторов за счет перемещения источника энантиоселективности на N-гетероциклический карбен.
Окислительное образование ионов оксокарбения
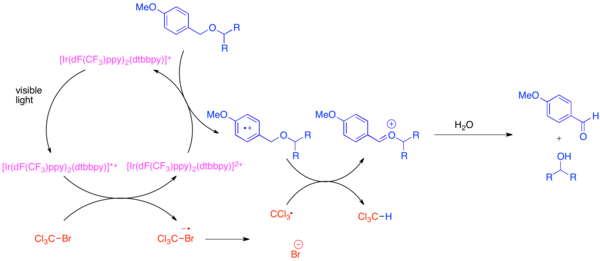
Создание ортогональных защитных групп является проблемой в органическом синтезе, потому что эти защитные группы позволяют каждому экземпляру общей функциональной группы, такой как гидроксил группа, выделяемая при синтезе сложной молекулы. Очень распространенной защитной группой для гидроксильной функциональной группы является параграф-метоксибензиловый (PMB) эфир. Эта защитная группа химически похожа на менее богатый электронами бензиловый эфир. Обычно для селективного расщепления простого эфира PMB в присутствии бензилового эфира используются сильные стехиометрические окислители, такие как 2,3-дихлор-5,6-дициано-1,4-бензохинон (DDQ) или аммиачная селитра церия (МОЖЕТ). Простые эфиры PMB намного более подвержены окислению, чем бензиловые эфиры, поскольку они более богаты электронами. Селективное снятие защиты с эфиров PMB может быть достигнуто за счет использования бис- (2- (2 ', 4'-дифторфенил) -5-трифторметилпиридин) - (4,4'-дитретбутилбипиридин) иридия (III) гексафторфосфата (Ir [dF (CF3) ppy]2(dtbbpy) PF6) и мягкий стехиометрический окислитель, такой как бромтрихлорметан, BrCCl3.[31] Фотовозбужденный иридиевый катализатор восстанавливает достаточно, чтобы фрагментировать бромтрихлорметан с образованием трихлорметильного радикала, бромид-аниона и комплекса Ir (IV). Бедные электронами фторированные лиганды делают иридиевый комплекс достаточно окисляющимся, чтобы принимать электрон от богатого электронами арена, такого как эфир PMB. После окисления арена он будет легко участвовать в переносе атома водорода с трихлорметильным радикалом с образованием хлороформа и оксокарбений ион, который легко гидролизуется с образованием свободного гидроксида. Было продемонстрировано, что эта реакция ортогональна многим обычным защитным группам, когда добавляли основание для нейтрализации продуцируемого HBr.
Циклоприсоединения
Циклоприсоединения и другие перициклические реакции являются мощными преобразователями в органическом синтезе из-за их способности быстро генерировать сложные молекулярные архитектуры и, в частности, из-за их способности устанавливать несколько смежных стереоцентры строго контролируемым образом. Однако в термических условиях разрешены только определенные циклоприсоединения в соответствии с Правила Вудворда – Хоффмана орбитальной симметрии или другие эквивалентные модели, такие как пограничная теория молекулярных орбиталей (FMO) или модель Дьюара-Циммермана. Циклоприсоединение, которое не допускается термически, такое как [2 + 2] циклоприсоединение, может быть активировано фотохимической активацией реакции. В некаталитических условиях эта активация требует использования высокой энергии. ультрафиолетовый свет способны изменять орбитальные популяции реакционноспособных соединений. В качестве альтернативы сообщалось, что металлические катализаторы, такие как кобальт и медь, катализируют термически запрещенные [2 + 2] циклоприсоединения посредством переноса одного электрона.
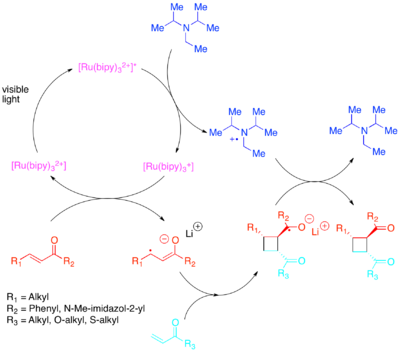
Требуемое изменение населенностей орбит может быть достигнуто переносом электронов с помощью фотокатализатора, чувствительного к видимому свету с меньшей энергией.[32][33][34][35][36] Юн продемонстрировал эффективные внутри- и межмолекулярные [2 + 2] циклоприсоединения активированных олефины: особенно Enones и стиролы. Было обнаружено, что эноны или олефины с низким содержанием электронов реагируют по радикально-анионному пути, используя диизопропилэтиламин как кратковременный источник электронов. Для этого электронного переноса [Ru (bipy)3]2+ было обнаружено, что он является эффективным фотокатализатором. Анионная природа циклизации оказалась решающей: проведение реакции в кислоте, а не с противоионом лития, благоприятствовало пути не циклоприсоединения.[37] Zhao et al. аналогичным образом обнаружил, что еще один путь циклизации доступен для халконы с самарий противоион.[38] Напротив, стиролы, богатые электронами, реагируют по катион-радикальному механизму, используя метилвиологен или молекулярный кислород в качестве переходного стока электронов. Пока [Ru (bipy)3]2+ оказался компетентным катализатором внутримолекулярной циклизации с использованием метилвиологен, его нельзя было использовать с молекулярным кислородом в качестве стока электронов или для межмолекулярной циклизации. Для межмолекулярной циклизации Yoon et al. обнаружил, что более сильно окисляющий фотокатализатор [Ru (bpm)3]2+ и молекулярный кислород обеспечивает каталитическую систему, лучше подходящую для доступа к катион-радикалу, необходимому для того, чтобы происходило циклоприсоединение. [Ru (bpz)3]2+, еще более сильно окисляющий фотокатализатор, оказался проблематичным, потому что, хотя он мог катализировать желаемое [2 + 2] циклоприсоединение, он также был достаточно сильным, чтобы окислять циклоаддукт и катализировать ретро- [2 + 2] реакцию. Это сравнение фотокатализаторов подчеркивает важность настройки окислительно-восстановительных свойств фотокатализатора для реакционной системы, а также демонстрирует ценность полипиридильных соединений в качестве лигандов из-за легкости, с которой они могут быть изменены для регулирования окислительно-восстановительных свойств их комплексов.

[2 + 2] -циклоприсоединения, катализируемые фотоокислением, также могут быть осуществлены с помощью трифенилпирилиевого органического фотоокислительного катализатора.[39]

Помимо термически запрещенного [2 + 2] циклоприсоединения, фотоокислительный катализ может применяться к [4 + 2] циклизации (Реакция Дильса – Альдера ). Бис-еноны, подобные субстратам, используемым для фотоокислительной [2 + 2] -циклизации, но с более длинным линкером, соединяющим две еноновые функциональные группы, вступают в внутримолекулярные анион-радикальные гетеро-гетеро-реакции Дильса-Альдера быстрее, чем [2 + 2] циклоприсоединение.[40]

Точно так же богатые электронами стиролы участвуют во внутри- или межмолекулярных циклизациях Дильса-Альдера через механизм катион-радикалов.[41][42] [Ru (bipy)3]2+ был компетентным катализатором межмолекулярной, но не внутримолекулярной циклизации Дильса-Альдера. Эта реакция Дильса-Альдера, катализируемая фотоокислительной реакцией, позволяет циклоприсоединение между двумя электронно несовпадающими субстратами. Нормальный электронный спрос на реакцию Дильса-Альдера требует наличия богатого электронами диен реагировать с бедным электронами олефином (или «диенофилом»), в то время как обратная реакция Дильса-Альдера с недостатком электронов имеет место между противоположным случаем бедного электронами диена и очень богатого электронами диенофила. Случай фоторедокс, поскольку он протекает по другому механизму, чем термическая реакция Дильса-Альдера, позволяет циклоприсоединение между богатым электронами диеном и богатым электронами диенофилом, открывая доступ к новым классам аддуктов Дильса-Альдера.

Синтетическая ценность реакции Дильса-Альдера, катализируемой фотоокислительной реакцией Юна, была продемонстрирована посредством полного синтеза природного продукта Хейтциамида А.[41] Этот синтез демонстрирует, что термическая реакция Дильса-Альдера благоприятствует образованию нежелательного региоизомера, но реакция, катализируемая фотоокислительным катализатором, дает желаемый региоизомер с улучшенным выходом.

Фоторедокс органокатализ
Органокатализ Это подраздел катализа, в котором исследуется потенциал малых органических молекул в качестве катализаторов, особенно для энантиоселективного создания хиральных молекул. Одна из стратегий в этой подполе - использование хиральных вторичных аминов для активации карбонильных соединений. В этом случае конденсация амина с карбонильным соединением дает нуклеофильную енамин. Хиральный амин сконструирован таким образом, что одна поверхность енамина стерически экранирована, и только незащищенная поверхность может свободно реагировать. Несмотря на способность этого подхода катализировать энантиоселективную функционализацию карбонильных соединений, некоторые ценные превращения, такие как каталитическое энантиоселективное α-алкилирование альдегиды, остался неуловимым. Комбинация методов органокатализа и фотоокисления обеспечивает каталитическое решение этой проблемы.[43] В этом подходе для α-алкилирования альдегидов [Ru (bipy)3]2+ восстановительно фрагментирует активированный алкилгалогенид, такой как броммалонат или фенацил бромид, который затем можно энантиоселективно добавлять к каталитически образованному енамину. Окисленный фотокатализатор затем окислительно гасит образовавшийся α-аминорадикал с образованием иминиевого иона, который гидролизуется с образованием функционализированного карбонильного соединения. Было показано, что это фотоокислительное превращение механистически отличается от другого радикального органокаталитического процесса, называемого катализом на основе однократно занятых молекулярных орбиталей (SOMO). В катализе SOMO используются сверхстехиометрические аммиачная селитра церия (CAN) для окисления каталитически образованного енамина до соответствующего катион-радикала, который затем может быть добавлен к подходящему партнеру сочетания, такому как аллилсилан. Этот тип механизма исключен для реакции фотокаталитического алкилирования, потому что, в то время как катион-радикал енамина, как наблюдалось, циклизуется на боковых олефинах и открытых циклопропановых радикальных часах при катализе SOMO, эти структуры не вступали в реакцию в фотоокислительной реакции.
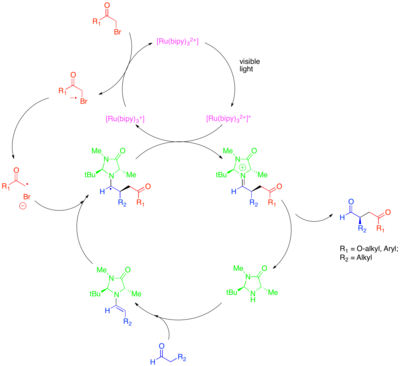
Это превращение включает алкилирование с другими классами активированных алкилгалогениды синтетический интерес. В частности, использование фотокатализатора Ir (dtbbpy) (ppy)2+ позволяет энантиоселективное α-трифторметилирование альдегидов при использовании Ir (ppy)3 позволил энантиоселективное связывание альдегидов с бедными электронами бензильными бромидами.[44][45] Zeitler et al. также исследовали продуктивное слияние фотоокислительных и органокаталитических методов для достижения энантиоселективного алкилирования альдегидов.[46] Тот же хиральный имидазолидиноновый органокатализатор использовали для образования енамина и введения хиральности. Однако вместо рутениевого или иридиевого комплекса использовался органический фотоокислительный катализатор Eosin Y.
Прямое β-арилирование насыщенных альдегидов и кетоны может быть достигнуто за счет комбинации фотоокислительных и органокаталитических методов.[47] Предыдущий метод для выполнения прямой β-функционализации насыщенного карбонила состоит из двухстадийного процесса, состоящего из двухстадийного процесса, оба катализируемых вторичным аминным органокатализатором: стехиометрическое восстановление альдегида с помощью IBX с последующим добавлением активированного алкилнуклеофила. в бета-позицию полученного Enal.[48] Это превращение, которое, как и другие процессы фотоокисления, происходит по радикальному механизму, ограничивается добавлением высокоэлектрофильных аренов в бета-положение. Строгое ограничение объема ареновых компонентов в этой реакции обусловлено, прежде всего, необходимостью в анион-радикале арена, который достаточно стабилен, чтобы не реагировать напрямую с енамином или катион-радикалом енамина. В предложенном механизме активированный фотоокислительный катализатор гасится окислительно с помощью электронодефицитного арена, такого как 1,4-дицианобензол. Затем фотокатализатор окисляет частицы енамина, временно образующиеся в результате конденсации альдегида с вторичным аминным сокатализатором, таким как оптимальный изопропилбензиламин. Образующийся в результате катион-радикал енамина обычно реагирует как 3 π-электронная система, но из-за стабильности партнеров по радикальному взаимодействию депротонирование положения β-метилена приводит к образованию 5 π-электронной системы с сильным радикальным характером во вновь полученном доступе. β-углерод. Хотя эта реакция основана на использовании вторичного аминного органокатализатора для образования разновидностей енамина, которые окисляются по предложенному механизму, энантиоселективного варианта этой реакции не существует.

Развитие этого прямого β-арилирования альдегидов привело к родственным реакциям β-функционализации циклических кетонов. В частности, β-арилирование циклических кетонов достигается в аналогичных условиях реакции, но с использованием азепан в качестве вторичного аминного сокатализатора. Фотокаталитическая «гомоальдольная» реакция работает для циклических кетонов, позволяя связывать бета-положение кетона с ipso-углеродом арилкетонов, таких как бензофенон и ацетофенон.[49] В дополнение к азепановому сокатализатору эта реакция требует использования более сильно восстанавливающего фотоокислительного катализатора Ir (ppy).3 и добавка гексафторарсенида лития (LiAsF6) для ускорения одноэлектронного восстановления арилкетона.
Добавки к олефинам
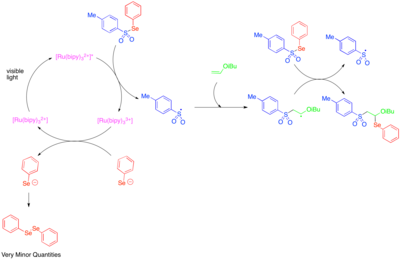
Использование фотоокислительного катализа для создания реактивных радикалов, центрированных на гетероатомах, было впервые исследовано в 1990-х годах.[50] [Ru (bipy)3]2+ Было обнаружено, что он катализирует фрагментацию тозилфенилселенида до фенилселенолат-аниона и тозильного радикала, и что механизм роста радикальной цепи позволяет присоединять тозильный радикал и фенилселено-радикал через двойную связь богатых электронами алкилвиниловых эфиров. Поскольку фенилселенолят-анион легко окисляется до дифенилдиселенида, наблюдаемые низкие количества дифенилдиселенида были приняты как указание на то, что катализируемая фотоокислением фрагментация тозилфенилселенида важна только как стадия инициирования, и что большая часть реакционной способности обусловлена радикально-цепным процессом.
Гетероароматические добавки к олефинам включают реакции многокомпонентного окси- и аминотрифторметилирования.[51][52] В этих реакциях используется реагент Умемото, сульфониевая соль, которая служит электрофильным источником трифторметильной группы и которая, как предполагается, реагирует по пути одноэлектронного переноса. Таким образом, одноэлектронное восстановление реагента Умемото высвобождает трифторметильный радикал, который присоединяется к реакционноспособному олефину. Впоследствии одноэлектронное окисление алкильного радикала, образующегося в результате этого присоединения, дает катион, который может быть захвачен водой, спиртом или нитрилом. Для достижения высоких уровней региоселективности эта реакционная способность была исследована в основном для стиролов, которые склонны к образованию промежуточного бензильного радикала.

Гидротрифторметилирование стиролов и алифатических алкенов может осуществляться с помощью мезитилакридинового органического фотоокислительного катализатора и реагента Ланглуа в качестве источника CF3 радикальный.[53] В этой реакции было обнаружено, что трифторэтанол и субстехиометрические количества ароматического тиола, такого как метилтиосалицилат, используемые в тандеме, служат лучшим источником водородного радикала для завершения каталитического цикла.
Внутримолекулярная гидроэтерификация и гидроаминирование протекают с антимарковниковской селективностью.[54][55] One mechanism invokes the single-electron oxidation of the olefin, trapping the radical cation by a pendant hydroxyl or amine functional group, and quenching the resulting alkyl radical by H-atom transfer from a highly labile donor species. Extensions of this reactivity to intermolecular systems have resulted in i) a new synthetic route to complex tetrahydrofurans by a "polar-radical-crossover cycloaddition" (PRCC reaction) of an allylic alcohol with an olefin, and ii) the anti-Markovnikov addition of carboxylic acids to olefins.[56][57]
Рекомендации
- ^ Tucker, Joseph W.; Stephenson, Corey R. J. (17 February 2012). "Shining Light on Photoredox Catalysis: Theory and Synthetic Applications". Журнал органической химии. 77 (4): 1617–1622. Дои:10.1021/jo202538x. PMID 22283525.
- ^ Prier, Christopher K.; Rankic, Danica A.; MacMillan, David W. C. (10 July 2013). "Visible Light Photoredox Catalysis with Transition Metal Complexes: Applications in Organic Synthesis". Химические обзоры. 113 (7): 5322–5363. Дои:10.1021/cr300503r. ЧВК 4028850. PMID 23509883.
- ^ Yoon, Tehshik P.; Ischay, Michael A.; Du, Juana (23 June 2010). "Visible light photocatalysis as a greener approach to photochemical synthesis". Химия природы. 2 (7): 527–532. Дои:10.1038/NCHEM.687. PMID 20571569.
- ^ Xuan, Jun; Xiao, Wen-Jing (9 July 2012). "Visible-Light Photoredox Catalysis". Angewandte Chemie International Edition. 51 (28): 6828–6838. Дои:10.1002/anie.201200223.
- ^ Fagnoni, Maurizio; Dondi, Daniele; Ravelli, Davide; Albini, Angelo (June 2007). "Photocatalysis for the Formation of the C−C Bond". Химические обзоры. 107 (6): 2725–2756. Дои:10.1021/cr068352x. PMID 17530909.
- ^ Romero, Nathan A.; Nicewicz, David A. (10 June 2016). "Organic Photoredox Catalysis". Химические обзоры. 2016 (116): 10075–10166. Дои:10.1021/acs.chemrev.6b00057. PMID 27285582.
- ^ Hamada, Taisuke; Ishida, Hitoshi; Usui, Satoshi; Watanabe, Yoshiro; Tsumura, Kazunori; Ohkubo, Katsutoshi (1993). "A novel photocatalytic asymmetric synthesis of (R)-(+)-1,1?-bi-2-naphthol derivatives by oxidative coupling of 3-substituted-2-naphthol with ?-[Ru(menbpy)3]2+[menbpy = 4,4?-di(1R,2S,5R)-(?)-menthoxycarbonyl-2,2?-bipyridine], which possesses molecular helicity". Журнал химического общества, химические коммуникации (11): 909. Дои:10.1039/C39930000909.
- ^ Rono, Lydia J.; Yayla, Hatice G.; Wang, David Y.; Armstrong M, ichael F.; Knowles, Robert R. (27 November 2013). "Enantioselective Photoredox Catalysis Enabled by Proton-Coupled Electron Transfer: Development of an Asymmetric Aza-Pinacol Cyclization". Журнал Американского химического общества. 135 (47): 17735–17738. Дои:10.1021/ja4100595. PMID 24215561.
- ^ Jones, Wayne E.; Fox, Marye Anne (May 1994). "Determination of Excited-State Redox Potentials by Phase-Modulated Voltammetry". Журнал физической химии. 98 (19): 5095–5099. Дои:10.1021/j100070a025.
- ^ "Electrochemical Series of Photocatalysts and Common Organic Compounds" (PDF). Merck. Получено 15 апреля 2019.
- ^ а б Tucker, Joseph W.; Stephenson, Corey R. J. (2012). "Shining Light on Photoredox Catalysis: Theory and Synthetic Applications". Журнал органической химии. 77 (4): 1617–1622. Дои:10.1021/jo202538x. PMID 22283525.
- ^ Hedstrand, David M.; Kruizinga, Wim H.; Kellogg, Richard M. (January 1978). "Light induced and dye accelerated reductions of phenacyl onium salts by 1,4-dihydropyridines". Буквы Тетраэдра. 19 (14): 1255–1258. Дои:10.1016/S0040-4039(01)94515-0.
- ^ Willner, Itamar; Tsfania, Tamar; Eichen, Yoav (April 1990). "Photocatalyzed and electrocatalyzed reduction of vicinal dibromides and activated ketones using ruthenium(I) tris(bipyridine) as electron-transfer mediator". Журнал органической химии. 55 (9): 2656–2662. Дои:10.1021/jo00296a023.
- ^ Hironaka, Katsuhiko; Fukuzumi, Shunichi; Tanaka, Toshio (1984). "Tris(bipyridyl)ruthenium(II)-photosensitized reaction of 1-benzyl-1,4-dihydronicotinamide with benzyl bromide". Journal of the Chemical Society, Perkin Transactions 2 (10): 1705. Дои:10.1039/P29840001705.
- ^ Kern, Jean-Marc; Sauvage, Jean-Pierre (1987). "Photoassisted C?C coupling via electron transfer to benzylic halides by a bis(di-imine) copper(I) complex". Журнал химического общества, химические коммуникации (8): 546. Дои:10.1039/C39870000546.
- ^ Fukuzumi, Shunichi.; Mochizuki, Seiji.; Tanaka, Toshio. (January 1990). "Photocatalytic reduction of phenacyl halides by 9,10-dihydro-10-methylacridine: control between the reductive and oxidative quenching pathways of tris(bipyridine)ruthenium complex utilizing an acid catalysis". Журнал физической химии. 94 (2): 722–726. Дои:10.1021/j100365a039.
- ^ Narayanam, Jagan M. R.; Joseph W. Tucker; Corey R. J. Stephenson (June 5, 2009). "Electron-Transfer Photoredox Catalysis: Development of a Tin-Free Reductive Dehalogenation Procedure". JACS. 131 (25): 8756–8757. Дои:10.1021/ja9033582. PMID 19552447.
- ^ Nguyen, John D.; D'Amato, Erica M.; Narayanam, Jagan M. R.; Stephenson, Corey R. J. (2012). "Engaging unactivated alkyl, alkenyl and aryl iodides in visible-light-mediated free radical reactions". Химия природы. 4 (10): 854–859. Дои:10.1038/nchem.1452. PMID 23001000.
- ^ Tucker, Joseph W.; Nguyen, John D.; Narayanam, Jagan M. R.; Krabbe, Scott W.; Stephenson, Corey R. J. (28 May 2010). "Tin-free radical cyclization reactions initiated by visible light photoredox catalysis". Химические коммуникации. 46 (27): 4985–4987. Дои:10.1039/c0cc00981d. PMID 20512181.
- ^ Furst, Laura; Narayanam, Jagan M. R.; Stephenson, Corey R. J. (4 October 2011). "Total Synthesis of (+)-Gliocladin C Enabled by Visible-Light Photoredox Catalysis". Angewandte Chemie International Edition. 50 (41): 9655–9659. Дои:10.1002/anie.201103145. ЧВК 3496252. PMID 21751318.
- ^ Condie, Allison G.; González-Gómez, José C.; Stephenson, Corey R. J. (10 February 2010). "Visible-Light Photoredox Catalysis: Aza-Henry Reactions via C−H Functionalization". Журнал Американского химического общества. 132 (5): 1464–1465. Дои:10.1021/ja909145y. PMID 20070079.
- ^ Rueping, Magnus; Zhu, Shaoqun; Koenigs, René M. (2011). "Visible-light photoredox catalyzed oxidative Strecker reaction". Химические коммуникации. 47 (47): 12709–11. Дои:10.1039/C1CC15643H. PMID 22041859.
- ^ Zhao, Guolei; Ян, Чао; Guo, Lin; Sun, Hongnan; Chen, Chao; Xia, Wujiong (2012). "Visible light-induced oxidative coupling reaction: easy access to Mannich-type products". Химические коммуникации. 48 (17): 2337–9. Дои:10.1039/C2CC17130A. PMID 22252544.
- ^ Rueping, Magnus; Zhu, Shaoqun; Koenigs, René M. (2011). "Photoredox catalyzed C–P bond forming reactions—visible light mediated oxidative phosphonylations of amines". Химические коммуникации. 47 (30): 8679–81. Дои:10.1039/C1CC12907D. PMID 21720622.
- ^ Freeman, David B.; Furst, Laura; Condie, Allison G.; Stephenson, Corey R. J. (6 January 2012). "Functionally Diverse Nucleophilic Trapping of Iminium Intermediates Generated Utilizing Visible Light". Органические буквы. 14 (1): 94–97. Дои:10.1021/ol202883v. ЧВК 3253246. PMID 22148974.
- ^ Rueping, Magnus; Koenigs, René M.; Poscharny, Konstantin; Fabry, David C.; Leonori, Daniele; Vila, Carlos (23 April 2012). "Dual Catalysis: Combination of Photocatalytic Aerobic Oxidation and Metal Catalyzed Alkynylation Reactions-C≡C Bond Formation Using Visible Light". Химия: европейский журнал. 18 (17): 5170–5174. Дои:10.1002/chem.201200050.
- ^ Pan, Yuanhang; Wang, Shuai; Kee, Choon Wee; Dubuisson, Emilie; Yang, Yuanyong; Loh, Kian Ping; Tan, Choon-Hong (2011). "Graphene oxide and Rose Bengal: oxidative C–H functionalisation of tertiary amines using visible light". Зеленая химия. 13 (12): 3341. Дои:10.1039/C1GC15865A.
- ^ Fu, Weijun; Guo, Wenbo; Zou, Guanglong; Xu, Chen (August 2012). "Selective trifluoromethylation and alkynylation of tetrahydroisoquinolines using visible light irradiation by Rose Bengal". Журнал химии фтора. 140: 88–94. Дои:10.1016/j.jfluchem.2012.05.009.
- ^ Hari, Durga Prasad; König, Burkhard (5 August 2011). "Eosin Y Catalyzed Visible Light Oxidative C–C and C–P bond Formation". Органические буквы. 13 (15): 3852–3855. Дои:10.1021/ol201376v. PMID 21744842.
- ^ DiRocco, Daniel A.; Rovis, Tomislav (16 May 2012). "Catalytic Asymmetric α-Acylation of Tertiary Amines Mediated by a Dual Catalysis Mode: N-Heterocyclic Carbene and Photoredox Catalysis". Журнал Американского химического общества. 134 (19): 8094–8097. Дои:10.1021/ja3030164. ЧВК 3354013. PMID 22548244.
- ^ Tucker, Joseph W.; Narayanam, Jagan M. R.; Shah, Pinkey S.; Stephenson, Corey R. J. (2011). "Oxidative photoredox catalysis: mild and selective deprotection of PMB ethers mediated by visible light". Химические коммуникации. 47 (17): 5040–5042. Дои:10.1039/c1cc10827a. PMID 21431223.
- ^ Ischay, Michael A.; Anzovino, Mary E.; Du, Juana; Yoon, Tehshik P. (October 2008). "Efficient Visible Light Photocatalysis of [2+2] Enone Cycloadditions". Журнал Американского химического общества. 130 (39): 12886–12887. Дои:10.1021/ja805387f. PMID 18767798.
- ^ Du, Juana; Yoon, Tehshik P. (21 October 2009). "Crossed Intermolecular [2+2] Cycloadditions of Acyclic Enones via Visible Light Photocatalysis". Журнал Американского химического общества. 131 (41): 14604–14605. Дои:10.1021/ja903732v. ЧВК 2761970. PMID 19473018.
- ^ Ischay, Michael A.; Lu, Zhan; Yoon, Tehshik P. (30 June 2010). "[2+2] Cycloadditions by Oxidative Visible Light Photocatalysis". Журнал Американского химического общества. 132 (25): 8572–8574. Дои:10.1021/ja103934y. ЧВК 2892825. PMID 20527886.
- ^ Tyson, Elizabeth L.; Farney, Elliot P.; Yoon, Tehshik P. (17 February 2012). "Photocatalytic [2 + 2] Cycloadditions of Enones with Cleavable Redox Auxiliaries". Органические буквы. 14 (4): 1110–1113. Дои:10.1021/ol3000298. ЧВК 3288794. PMID 22320352.
- ^ Ischay, Michael A.; Ament, Michael S.; Yoon, Tehshik P. (2012). "Crossed intermolecular [2 + 2] cycloaddition of styrenes by visible light photocatalysis". Химическая наука. 3 (9): 2807–2811. Дои:10.1039/c2sc20658g. ЧВК 3439822. PMID 22984640.
- ^ Du, Juana; Espelt, Laura Ruiz; Guzei, Ilia A.; Yoon, Tehshik P. (2011). "Photocatalytic reductive cyclizations of enones: Divergent reactivity of photogenerated radical and radical anion intermediates". Химическая наука. 2 (11): 2115–2119. Дои:10.1039/c1sc00357g. ЧВК 3222952. PMID 22121471.
- ^ Zhao, Guolei; Ян, Чао; Guo, Lin; Sun, Hongnan; Lin, Run; Xia, Wujiong (20 July 2012). "Reactivity Insight into Reductive Coupling and Aldol Cyclization of Chalcones by Visible Light Photocatalysis". Журнал органической химии. 77 (14): 6302–6306. Дои:10.1021/jo300796j. PMID 22731518.
- ^ Riener, Michelle; Nicewicz, David A. (2013). "Synthesis of cyclobutane lignans via an organic single electron oxidant–electron relay system". Химическая наука. 4 (6): 2625. Дои:10.1039/c3sc50643f. ЧВК 3862357. PMID 24349680.
- ^ Hurtley, Anna E.; Cismesia, Megan A.; Ischay, Michael A.; Yoon, Tehshik P. (June 2011). "Visible light photocatalysis of radical anion hetero-Diels–Alder cycloadditions". Тетраэдр. 67 (24): 4442–4448. Дои:10.1016/j.tet.2011.02.066. ЧВК 3110713. PMID 21666769.
- ^ а б Lin, Shishi; Ischay, Michael A.; Fry, Charles G.; Yoon, Tehshik P. (7 December 2011). "Radical Cation Diels–Alder Cycloadditions by Visible Light Photocatalysis". Журнал Американского химического общества. 133 (48): 19350–19353. Дои:10.1021/ja2093579. ЧВК 3227774. PMID 22032252.
- ^ Lin, Shishi; Padilla, Christian E.; Ischay, Michael A.; Yoon, Tehshik P. (June 2012). "Visible light photocatalysis of intramolecular radical cation Diels–Alder cycloadditions". Буквы Тетраэдра. 53 (24): 3073–3076. Дои:10.1016/j.tetlet.2012.04.021. ЧВК 3375996. PMID 22711942.
- ^ Nicewicz, D. A.; MacMillan, D. W. C. (3 October 2008). "Merging Photoredox Catalysis with Organocatalysis: The Direct Asymmetric Alkylation of Aldehydes". Наука. 322 (5898): 77–80. Дои:10.1126/science.1161976. ЧВК 2723798. PMID 18772399.
- ^ Nagib, David A .; Скотт, Марк Э .; MacMillan, David W. C. (12 August 2009). «Энантиоселективное α-трифторметилирование альдегидов с помощью фоторедокс-органокатализа». Журнал Американского химического общества. 131 (31): 10875–10877. Дои:10.1021 / ja9053338. ЧВК 3310169. PMID 19722670.
- ^ Shih, Hui-Wen; Vander Wal, Mark N.; Grange, Rebecca L.; MacMillan, David W. C. (6 October 2010). "Enantioselective α-Benzylation of Aldehydes via Photoredox Organocatalysis". Журнал Американского химического общества. 132 (39): 13600–13603. Дои:10.1021/ja106593m. ЧВК 3056320. PMID 20831195.
- ^ Neumann, Matthias; Füldner, Stefan; König, Burkhard; Zeitler, Kirsten (24 January 2011). "Metal-Free, Cooperative Asymmetric Organophotoredox Catalysis with Visible Light". Angewandte Chemie International Edition. 50 (4): 951–954. Дои:10.1002/anie.201002992. PMID 20878819.
- ^ Pirnot, M. T.; Rankic, D. A.; Martin, D. B. C.; MacMillan, D. W. C. (28 March 2013). "Photoredox Activation for the Direct -Arylation of Ketones and Aldehydes". Наука. 339 (6127): 1593–1596. Дои:10.1126/science.1232993. ЧВК 3723331. PMID 23539600.
- ^ Zhang, Shi-Lei; Xie, He-Xin; Zhu, Jin; Ли, Хао; Zhang, Xin-Shuai; Li, Jian; Wang, Wei (1 March 2011). "Organocatalytic enantioselective β-functionalization of aldehydes by oxidation of enamines and their application in cascade reactions". Nature Communications. 2: 211. Дои:10.1038/ncomms1214. PMID 21364550.
- ^ Petronijević, Filip R.; Nappi, Manuel; MacMillan, David W. C. (22 November 2013). "Direct β-Functionalization of Cyclic Ketones with Aryl Ketones via the Merger of Photoredox and Organocatalysis". Журнал Американского химического общества. 135 (49): 131122154626007. Дои:10.1021/ja410478a. ЧВК 3934322. PMID 24237366.
- ^ Barton, Derek H.R.; Csiba, Maria A.; Jaszberenyi, Joseph Cs. (Май 1994). "Ru(bpy)32+-mediated addition of Se-phenyl p-tolueneselenosulfonate to electron rich olefins". Буквы Тетраэдра. 35 (18): 2869–2872. Дои:10.1016/S0040-4039(00)76646-9.
- ^ Yasu, Yusuke; Koike, Takashi; Akita, Munetaka (17 September 2012). "Three-component Oxytrifluoromethylation of Alkenes: Highly Efficient and Regioselective Difunctionalization of C=C Bonds Mediated by Photoredox Catalysts". Angewandte Chemie International Edition. 51 (38): 9567–9571. Дои:10.1002/anie.201205071. PMID 22936394.
- ^ Yasu, Yusuke; Koike, Takashi; Akita, Munetaka (3 May 2013). "Intermolecular Aminotrifluoromethylation of Alkenes by Visible-Light-Driven Photoredox Catalysis". Органические буквы. 15 (9): 2136–2139. Дои:10.1021/ol4006272. PMID 23600821.
- ^ Wilger, Dale J.; Gesmundo, Nathan J.; Nicewicz, David A. (2013). "Catalytic hydrotrifluoromethylation of styrenes and unactivated aliphatic alkenes via an organic photoredox system". Химическая наука. 4 (8): 3160. Дои:10.1039/c3sc51209f.
- ^ Hamilton, David S.; Nicewicz, David A. (14 November 2012). "Direct Catalytic Anti-Markovnikov Hydroetherification of Alkenols". Журнал Американского химического общества. 134 (45): 18577–18580. Дои:10.1021/ja309635w. ЧВК 3513336. PMID 23113557.
- ^ Nguyen, Tien M .; Nicewicz, David A. (3 July 2013). "Anti-Markovnikov Hydroamination of Alkenes Catalyzed by an Organic Photoredox System". Журнал Американского химического общества. 135 (26): 9588–9591. Дои:10.1021/ja4031616. ЧВК 3754854. PMID 23768239.
- ^ Grandjean, Jean-Marc M.; Nicewicz, David A. (2 April 2013). "Synthesis of Highly Substituted Tetrahydrofurans by Catalytic Polar-Radical-Crossover Cycloadditions of Alkenes and Alkenols". Angewandte Chemie International Edition. 52 (14): 3967–3971. Дои:10.1002/anie.201210111. PMID 23440762.
- ^ Perkowski, Andrew J.; Nicewicz, David A. (17 July 2013). "Direct Catalytic Anti-Markovnikov Addition of Carboxylic Acids to Alkenes". Журнал Американского химического общества. 135 (28): 10334–10337. Дои:10.1021/ja4057294. ЧВК 3757928. PMID 23808532.

![left ({ frac {I_ {0}} {I}} right) = 1 + {k_ {q}} * { tau _ {0}} times [Q]](https://wikimedia.org/api/rest_v1/media/math/render/svg/338eb04d84052783d691791ccf5c329070594aa0)

