Спин-запрещенные реакции - Spin-forbidden reactions
Эта статья поднимает множество проблем. Пожалуйста помоги Улучши это или обсудите эти вопросы на страница обсуждения. (Узнайте, как и когда удалить эти сообщения-шаблоны) (Узнайте, как и когда удалить этот шаблон сообщения)
|
В химия, то правило выбора (также известное как правило перехода) формально ограничивают определенные реакции, известный как спин-запрещенные реакции, от возникновения из-за необходимого изменения между двумя разными квантовые состояния. Когда реагент существует в одном состояние вращения и товар существует в другом спиновом состоянии, соответствующая реакция будет иметь повышенный энергия активации по сравнению с аналогичной реакцией, в которой спиновые состояния реагента и продукта изоморфны. В результате этой повышенной энергии активации снижается скорость реакции наблюдается.
Случай некоторых карбонилов кобальта

Синглетные и триплетные состояния могут возникать внутри металлоорганический комплексы, такие как Tpя-Пр, яCo (CO)2 и Tpя-Пр, яCo (CO) соответственно.

Изменение состояний спина
Когда реакция превращает металл из синглетного в триплетное состояние (или наоборот):
- Энергия двух спиновых состояний должна быть почти равной, что диктуется температурой,
- Требуется механизм для изменения спиновых состояний.
Сильный спин-орбитальная связь может удовлетворять 2-му условию. Параметр 1, однако, может приводить к очень медленным реакциям из-за больших различий между характеристиками металлических комплексов. поверхности потенциальной энергии, которые пересекаются только при высоких энергиях, приводя к значительному активационный барьер.[2]
Запрещенные по спину реакции формально относятся к категории электронно неадиабатические реакции.[3] В общем случае поверхности потенциальной энергии попадают либо в адиабатический и диабатическая классификация. Поверхности потенциальной энергии, которые являются адиабатическими, зависят от использования полного электронный гамильтониан, который включает спин-орбита срок. Те, что являются диабатическими, также выводятся путем решения собственные значения из Уравнение Шредингера, но в этом случае один или несколько терминов опущены.[4]
Неадиабатический переход

После достижения точки пересечения минимальной энергии и выполнения указанного выше параметра 1 системе необходимо перепрыгнуть с одной диабатической поверхности на другую, как указано выше в параметре 2. При заданной энергии (E) коэффициент ставки [k (E)] запрещенной по спину реакции можно рассчитать, используя плотность колебательные состояния реагента [ρ (E)] и эффективная интегральная плотность состояний в стыке между двумя поверхностями [Nэ(E)].
куда
Вероятность прыжка (пш) рассчитывается из Ландау-Зенер теория дает
куда
в котором спин-орбитальная связь возникла из диагонального матричного элемента гамильтониана между двумя электронными состояниями (ЧАС12) относительный уклон двух поверхностей в пересечении шва [F (Δ)] приведенная масса системы за счет ее движения по прыжковой координате (μ), а кинетическая энергия системы, проходящей через точку пересечения (E) используются.
Полезно отметить, что когда Eчас < Ec (когда энергия ниже точки пересечения с минимальной энергией) вероятность перескока между состояниями спина равна нулю.[5]
Пример реакции, запрещенной по спину
Один пример, показывающий эффект замедления реакции, запрещенной по спину, имеет место, когда Fe (CO)Икс находится под CO давление. Переходы из х = 2,3,4 к х-3,4,5 демонстрируют замедление скорости, когда реагент находится в основном триплетном состоянии, а продукт находится в синглетном основном состоянии. В случае Fe (CO)Икс, когда х = 2,3,4 железо существует в виде триплета в основном состоянии; когда х = 5, железо существует как синглет в основном состоянии. Кинетика указанной системы может быть представлена:

куда:
- ,
- , и
- .
Приведенные выше константы скорости, в частности, не зависят от температуры, протестированы при 55 ° C, 21 ° C и 10 ° C, что указывает, по мнению авторов, что наблюдаемое 500-кратное снижение скорости происходит из-за запрещенной по спину природы последнего. уравнение, а не из-за кинетики добавления дополнительного лиганда.[7]
Приложение для катализа
Лиганд ассоциация и диссоциация от металлических центров влечет за собой фундаментальное изменение сфера координации из этого металла. Это изменение в некоторых реакциях также требует изменения спинового состояния, которое может замедлить скорость ассоциации лигандов. Окислительное добавление и восстановительное устранение можно рассматривать аналогично ассоциации и диссоциации лиганда соответственно.[8] Математически скорость диссоциации лиганда может увеличиваться, когда реакция переходит из одного спинового состояния в другое, хотя следует отметить, что этот эффект часто невелик по сравнению с другими факторами, такими как стерики вокруг металлического центра.[9][10]
C-H активация
Вставка в связи C-H, известные как C-H активация, является неотъемлемым первым шагом в функционализации CH.[11] Для некоторых комплексов металлов с идентичными лигандами активация CH происходит быстро, когда используется один металл, и медленно, когда используются другие металлы, часто переходные металлы первого ряда, из-за разрешенной по спину природы первого случая и запрещенной по спину природы второго. дело. Разница в скорости C-H активации метана для CoCp (CO), RhCp (CO), и IrCp (CO) легко продемонстрировать это свойство. CoCp (CO), то исходный материал в активации C-H, существует в триплетном спиновом состоянии, в то время как RhCp (CO) существует в синглетном состоянии, а триплетное состояние находится всего в 5,9 ккал / моль. IrCp (CO) является уникальным среди этих комплексов тем, что его начальное состояние существенно вырождено между триплетным и синглетным состояниями. Данный продукт вставки C-H, CpMH (CO) (CH3) куда M = Co, Rh, Ir, находится в синглетном состоянии, что означает, что активация C-H с CoCp (CO) должен достичь точки пересечения минимальной энергии для поверхностей потенциальной энергии реагента и продукта, что требует относительно высоких энергий для продолжения.[12]

Окислительное присоединение кремний-водородных связей
За счет использования фотолиз, скорость окислительного присоединения в кремний -водород Было показано, что связи увеличиваются, когда исходный материал возбужден до правильного спинового состояния. CpRe (CO)2 и CpMn (CO)2 подвергались фотолизу для изменения их спиновых состояний с триплетного на синглетное и наоборот, соответственно, так что окислительная добавка к Et3Si-H может образовываться с очень высокой скоростью.[13]
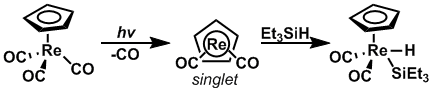
Химия окисления
Металлооксо-разновидности из-за их небольшой пространственной d орбитали, ведущие к слабой связи, часто имеют одинаковую энергию как для низких спинов () и высокоспиновая конфигурация ().[14] Это сходство в энергии между низкий- и высокое вращение конфигурации оксо-виды поддается изучению запрещенных по спину реакций, таких как Mn (сален)-Катализированное эпоксидирование. В Mn (сален)-оксо виды могут существовать как в триплетном, так и в квинтетном состоянии. В то время как продукт квинтета находится с более низкой энергией, можно наблюдать как триплетные, так и квинтетные продукты.[15]

Рекомендации
- ^ Теопольд, Клаус Х (1995). «Может ли спиновое состояние изменить медленные металлоорганические реакции». Журнал Американского химического общества. 117 (47): 11745–8. Дои:10.1021 / ja00152a015.
- ^ Кундари, Томас (2001). Вычислительная металлоорганическая химия. Marcel Dekker, Inc., стр.293.
- ^ Кундари, Томас (2001). Вычислительная металлоорганическая химия. Marcel Dekker, Inc., стр.294.
- ^ Харви, Джереми (2006). «Понимание кинетики спин-запрещенных химических реакций». Физическая химия Химическая физика. 9 (3): 331–2. Дои:10.1039 / b614390c. PMID 17199148.
- ^ Харви, Джереми (2006). «Понимание кинетики запрещенных спином химических реакций». Физическая химия Химическая физика. 9 (3): 332–3. Дои:10.1039 / b614390c. PMID 17199148.
- ^ Киршнер, Карл (2010). «Реакционная способность координационно-ненасыщенных комплексов железа по отношению к монооксиду углерода: связывать или не связывать?». Dalton Transactions. 40 (18): 4778–4792. Дои:10.1039 / c0dt01636e. PMID 21380474.
- ^ Вайц, Эрик (1986). «Зависимость от длины волны эксимерного лазерного фотолиза Fe (CO) 5 в газовой фазе. Переходная инфракрасная спектроскопия и кинетика фотофрагментов FeCOx (x = 4,3,2)». Журнал химической физики. 84 (4): 1977–1986. Bibcode:1986ЖЧФ..85.1977С. Дои:10.1063/1.451141.
- ^ Кундари, Томас (2001). Вычислительная металлоорганическая химия. Marcel Dekker, Inc., стр.299 –303.
- ^ Поли, Ринальдо (1995). «Диссоциативный обмен фосфина на системы циклопентадиенилмолибдена (III). Преодоление разрыва между вернеровской координационной химией и низковалентной металлоорганической химией». Неорганика Chimica Acta. 240 (1–2): 355–66. Дои:10.1016/0020-1693(95)04554-6.
- ^ Поли, Ринальдо (1996). "Металлоорганические соединения молибдена с открытой оболочкой. Изменения спинового состояния при парных энергетических эффектах". Журнал Американского химического общества. 30 (12): 494–501. Дои:10.1021 / ar960280g.
- ^ Активация металлоорганических связей C – H: введение Алан С. Голдман и Карен И. Голдберг Серия симпозиумов ACS 885, Активация и функционализация связей C – H, 2004, 1–43
- ^ Зигбан, Пер (1996). «Сравнение C-H активации метана M (C5H5) (CO) для M = кобальт, родий и иридий». Журнал Американского химического общества. 118 (6): 1487–96. Дои:10.1021 / ja952338c.
- ^ Харрис, Чарльз (1999). «Сверхбыстрые инфракрасные исследования активации связи в металлоорганических комплексах». Соотв. Chem. Res. 32 (7): 551–60. Дои:10.1021 / ar970133y.
- ^ Кудари, Томас (2001). Вычислительная металлоорганическая химия. Marcel Dekker Inc., стр. 301–2.
- ^ Linde, C .; Åkermark, B .; Norrby, P.-O .; Свенссон, М. (1999). «Время имеет решающее значение: влияние спиновых изменений на диастереоселективность в Mn (сален) -катализированном эпоксидировании». Журнал Американского химического общества. 121 (21): 5083–4. Дои:10.1021 / ja9809915.





![{ displaystyle { ce {Fe (CO) 2 -> [{k_ {23}}] [CO] Fe (CO) 3 -> [{k_ {34}}] [CO] Fe (CO) 4->) [{k_ {45}}] [CO] Fe (CO) 5}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5bba6aa1ab4092d76cdd505c9d0d7dcac1f3b13e)




