Органокатализ пролина - Proline organocatalysis
Органокатализ пролина это использование пролин как органокатализатор в органическая химия. Эта тема часто считается отправной точкой в области органокатализа, несмотря на то, что ранние открытия остались недооцененными.[1] Модификации, такие как Катализатор Макмиллана и катализаторы Йоргенсена работают с отличным стереоконтролем.[2]:5574[3]
О катализе пролина первоначально сообщили группы специалистов. Schering AG и Hoffmann-La Roche.[1][4][5][6] Пролина хиральный структура позволяет энантиоселективный синтез, отдавая предпочтение конкретному энантиомер или же диастереомер.[2]:5574[1][7][8][9]:47
Реакции
В Реакция Хайоса – Пэрриша – Эдера – Зауэра – Вихерта., о которой сообщили в 1971 году несколько исследовательских групп, является ранним примером энантиоселективной каталитической реакции в органической химии.[10] Его объем был изменен и расширен за счет развития связанных реакций, включая Майкл дополнение, асимметричная альдольная реакция и Реакция Манниха. Эта реакция также использовалась для выполнения асимметричных Аннуляции Робинсона. Общая схема этой реакции следующая:

Этот пример иллюстрирует 6-енолендоальдолизацию. В пролин катализирует асимметричный альдольная реакция. В цвиттерионный характер и H-соединение пролина в переходное состояние определить исход реакции.[11][12][13][14] An енамин образуется во время реакции, и только одна молекула пролина участвует в образовании переходного состояния.[15]
Асимметричный синтез из Кетон Виланда-Мишера также основан на пролине.[16] Дополнительные реакции включают: альдольные реакции,[17][18][19][20] Реакция Манниха,[21][22][23] Реакция Майкла,[24][25] аминирование[22] α-оксиаминирование,[26][27] и α-галогенирование.[28][29]
Модификации основной структуры пролина улучшили энантиоселективность и региоселективность катализа.[28][29] Эти производные пролина вспомогательные вещества и катализаторы,[30] в том числе Завершает реакцию гидразона и Редукция Кори – Ицуно, были рассмотрены,[31][32] как и MacMillan’s иминий катализаторы,[33] Катализаторы Миллера,[33] и CBS-оксазаборолидины.[34]
Иллюстрируя внутримолекулярную альдолизацию енолексо, дикарбонил (диалки, дикетоны) может быть превращен в антиальдольные продукты с 10% загрузкой катализатора L-пролина.[35][36]
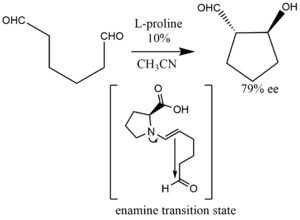
Ярким примером катализа пролина является добавление ацетон или же гидроксиацетон к разнообразному набору альдегидов, катализируемых 20-30% загрузкой пролинового катализатора с высокой (> 99%) энантиоселективностью, с образованием диольных продуктов.[37] Как уточнили Лист и Нотц, вышеупомянутая реакция дает следующие диольные продукты:[38]
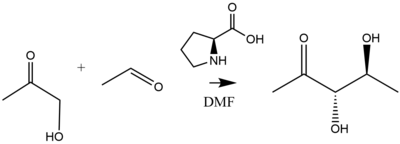
Механистические соображения
Катализируемое пролином присоединение альдола происходит через шестичленное переходное состояние енамина в соответствии с моделью Циммермана-Тракслера. Добавление 20-30 мол.% Пролина к ацетону или гидроксиацетону катализирует их добавление к разнообразному набору альдегидов с высокой (> 99%) энантиоселективностью с образованием диольных продуктов.[39][40][41] Производные пролина и пролина используются в качестве органокатализаторов для ускорения реакций асимметричной конденсации. Пример такой реакции, протекающей через шестичленное переходное состояние, моделируется следующим образом.

Реакции внутримолекулярной альдолизации, которые катализируются пролином, также проходят через шестичленные переходные состояния. Эти переходные состояния могут способствовать образованию либо енолексо, либо енолендо продукта.[42]

Рекомендации
- ^ а б c Gaunt, M. J .; Johansson, C. C. C .; McNally, A .; Во, Н. Т. (2007). «Энантиоселективный органокатализ». Открытие наркотиков сегодня. 12 (1–2): 8–27. Дои:10.1016 / j.drudis.2006.11.004. PMID 17198969.
- ^ а б Лист Б. (2002). «Асимметричные реакции, катализируемые пролином». Тетраэдр. 58 (28): 5573–5590. Дои:10.1016 / S0040-4020 (02) 00516-1.
- ^ Ван, З. (2009). В "Комплексные реакции на органические названия и реагенты", стр. 1306, Джон Уайли и сыновья. ISBN 0471704504, ISBN 9780471704508
- ^ Hajos, Z. G. и Parrish, D. R. (1971), немецкий патент DE 2102623
- ^ Eder, U .; Sauer, G .; Вихерт, Р. (1971). "Новый тип асимметричной циклизации оптически активных стероидных частичных структур CD". Angewandte Chemie International Edition на английском языке. 10 (7): 496–497. Дои:10.1002 / anie.197104961.
- ^ Hajos, Z. G .; Пэрриш, Д. Р. (1974). «Синтез и превращение 2-метил-2- (3-оксобутил) -1,3-циклопентандиона в изомерные рацемические кетолы 3.2.1] бициклооктана и пергидроинданового ряда». Журнал органической химии. 39 (12): 1612. Дои:10.1021 / jo00925a002.
- ^ Dalko, P .; Мойсан, Л. (2001). «Энантиоселективный органокатализ». Angewandte Chemie International Edition. 40 (20): 3726–3748. Дои:10.1002 / 1521-3773 (20011015) 40:20 <3726 :: AID-ANIE3726> 3.0.CO; 2-D.
- ^ Беркессель А., Грегер Х. (2005). «Асимметричный органокатализ». Вайли-ВЧ ISBN 3527305173
- ^ Далко, П. (редактор) (2007). «Энантиоселективный органокатализ: реакции и экспериментальные процедуры». Джон Уайли и сыновья. ISBN 9783527315222
- ^ Ван, Зеронг (2009). Исчерпывающие органические названия реакций и реагентов. Хобокен, штат Нью-Джерси: Джон Вили. ISBN 9780470638859.
- ^ Hajos, Z. G .; Пэрриш, Д. Р. (1974). «Асимметричный синтез бициклических интермедиатов химии природных продуктов». Журнал органической химии. 39 (12): 1615–1621. Дои:10.1021 / jo00925a003.
- ^ Clemente, F. R .; Хоук, К. Н. (2004). «Вычислительные доказательства енаминового механизма внутримолекулярных альдольных реакций, катализируемых пролином». Angewandte Chemie. 116 (43): 5890. Дои:10.1002 / ange.200460916.
- ^ Список, Б .; Hoang, L .; Мартин, Х. Дж. (2004). "Специальная статья по асимметричному катализу, часть II: Новые исследования механизмов альдольной реакции, катализируемой пролином". Труды Национальной академии наук. 101 (16): 5839–5842. Bibcode:2004ПНАС..101.5839Л. Дои:10.1073 / pnas.0307979101. ЧВК 395996. PMID 15073330.
- ^ Ранкин, К. Н .; Gauld, J. W .; Бойд, Р. Дж. (2002). "Функциональное исследование плотности прямой альдольной реакции, катализируемой пролином". Журнал физической химии A. 106 (20): 5155. Bibcode:2002JPCA..106.5155R. Дои:10.1021 / jp020079p.
- ^ Hoang, L .; Bahmanyar, S .; Houk, K. N .; Лист Б. (2003). «Кинетические и стереохимические доказательства участия только одной молекулы пролина в переходных состояниях катализируемых пролином внутри- и межмолекулярных альдольных реакций». Журнал Американского химического общества. 125 (1): 16–17. Дои:10.1021 / ja028634o. PMID 12515489.
- ^ Woodward, R. B .; Logusch, E .; Nambiar, K. P .; Sakan, K .; Ward, D. E .; Au-Yeung, B.W .; Balaram, P .; Браун, Л. Дж .; Card, P.J .; Чен, К. Х. (1981). «Асимметричный общий синтез эритромцина. 1. Синтез эритронолида и производного секокислоты посредством асимметричной индукции». Журнал Американского химического общества. 103 (11): 3210. Дои:10.1021 / ja00401a049.
- ^ Northrup, A. B .; Макмиллан, Д. В. К. (2002). «Первая прямая и энантиоселективная кросс-альдольная реакция альдегидов» (PDF). Журнал Американского химического общества. 124 (24): 6798–6799. Дои:10.1021 / ja0262378. PMID 12059180.
- ^ Notz, W .; Лист Б. (2000). «Каталитический асимметричный синтез анти-1,2-диолов». Журнал Американского химического общества. 122 (30): 7386. Дои:10.1021 / ja001460v.
- ^ Список, Б .; Пожарлиев, П .; Кастелло, К. (2001). «Катализируемые пролином асимметричные альдольные реакции между кетонами и α-незамещенными альдегидами». Органические буквы. 3 (4): 573–575. Дои:10.1021 / ol006976y. PMID 11178828.
- ^ Список, Б .; Lerner, R.A .; Барбас, К. Ф. (2000). "Прямые асимметричные альдольные реакции, катализируемые пролином". Журнал Американского химического общества. 122 (10): 2395. Дои:10.1021 / ja994280y.
- ^ Córdova, A .; Watanabe, S .; Tanaka, F .; Notz, W .; Barbas Cf, 3. (2002). «Высокоэнантиоселективный путь к любому энантиомеру производных альфа- и бета-аминокислот». Журнал Американского химического общества. 124 (9): 1866–1867. Дои:10.1021 / ja017833p. PMID 11866595.CS1 maint: числовые имена: список авторов (связь)
- ^ а б Список, Б .; Пожарлиев, П .; Biller, W. T .; Мартин, Х. Дж. (2002). "Катализируемая пролином прямая асимметричная трехкомпонентная реакция Манниха: объем, оптимизация и применение в высокоэнантиоселективном синтезе 1,2-аминоспиртов". Журнал Американского химического общества. 124 (5): 827–833. Дои:10.1021 / ja0174231. PMID 11817958.
- ^ Маркес, М. М. Б. (2006). «Каталитическая энантиоселективная реакция кросс-Манниха альдегидов». Angewandte Chemie International Edition. 45 (3): 348–352. Дои:10.1002 / anie.200502630. PMID 16342308.
- ^ Список, Б .; Пожарлиев, П .; Мартин, Х. Дж. (2001). «Эффективные катализируемые пролином добавки Михаэля немодифицированных кетонов к нитроолефинам». Органические буквы. 3 (16): 2423–2425. Дои:10.1021 / ol015799d. PMID 11483025.
- ^ Список, Б .; Кастелло, К. (2001). "Новая трехкомпонентная реакция кетонов, альдегидов и кислоты Мелдрама, катализируемая пролином". Synlett. 2001 (11): 1687. Дои:10.1055 / с-2001-18095.
- ^ Чжун, Г. (2003). «Легкий и быстрый путь к высокоэнантиочистым 1,2-диолам с помощью нового каталитического асимметричного α-аминоксилирования альдегидов». Angewandte Chemie International Edition. 42 (35): 4247–4250. Дои:10.1002 / anie.200352097. PMID 14502748.
- ^ Brown, S.P .; Brochu, M. P .; Sinz, C.J .; Макмиллан, Д. В. С. (2003). «Прямое и энантиоселективное органокаталитическое α-окисление альдегидов» (PDF). Журнал Американского химического общества. 125 (36): 10808–10809. Дои:10.1021 / ja037096s. PMID 12952459.
- ^ а б Brochu, M. P .; Brown, S.P .; Макмиллан, Д. В. С. (2004). «Прямое и энантиоселективное органокаталитическое α-хлорирование альдегидов» (PDF). Журнал Американского химического общества. 126 (13): 4108–4109. Дои:10.1021 / ja049562z. PMID 15053591.
- ^ а б Franzén, J .; Мариго, М .; Fielenbach, D .; Wabnitz, T. C .; Kjaersgaard, K. A .; Йоргенсен, К. А. (2005). «Общий органокатализатор для прямой α-функционализации альдегидов: стереоселективные реакции образования связи C-C, C-N, C-F, C-Br и C-S. Объем и механистические выводы». Журнал Американского химического общества. 127 (51): 18296–18304. Дои:10.1021 / ja056120u. PMID 16366584.
- ^ Cobb, A. J. A .; Shaw, D. M .; Longbottom, D.A .; Gold, J. B .; Лей, С. В. (2005). «Органокатализ с производными пролина: улучшенные катализаторы для асимметричных реакций Манниха, нитро-Михаэля и альдольных реакций». Органическая и биомолекулярная химия. 3 (1): 84–96. Дои:10.1039 / b414742a. PMID 15602602.
- ^ Иов, А .; Janeck, C.F .; Bettray, W .; Peters, R .; Эндерс, Д. (2002). «Методология SAMP- / RAMP-гидразона в асимметричном синтезе». Тетраэдр. 58 (12): 2253. Дои:10.1016 / S0040-4020 (02) 00080-7.
- ^ Кори, Э. Дж .; Хелал, К. Дж. (1998). «Восстановление карбонильных соединений с помощью хиральных оксазаборолидиновых катализаторов: новая парадигма энантиоселективного катализа и новый мощный метод синтеза». Angewandte Chemie International Edition. 37 (15): 1986. Дои:10.1002 / (SICI) 1521-3773 (19980817) 37:15 <1986 :: AID-ANIE1986> 3.0.CO; 2-Z.
- ^ а б Ярво, Э. Р .; Миллер, С. Дж. (2002). «Аминокислоты и пептиды как асимметричные органокатализаторы». Тетраэдр. 58 (13): 2481. Дои:10.1016 / S0040-4020 (02) 00122-9.
- ^ Стеммлер, Р. (2007). «Оксазаборолидины CBS - универсальные катализаторы асимметричного синтеза». Synlett. 2007 (6): 0997–0998. Дои:10.1055 / с-2007-973876.
- ^ Пидатхала, Чандаракала; Хоанг, Линь; Виньола, Никола; Список, Бенджамин (2003). «Прямая каталитическая асимметричная альдолизация Enolexo». Angewandte Chemie International Edition. 42 (24): 2785–2788. Дои:10.1002 / anie.200351266. PMID 12820268.
- ^ Мукерджи, Сантану; Ян, Юнг; Хоффманн, Себастьян; Список, Бенджамин (2007). «Асимметричный енаминный катализ». Chem. Rev. 107 (12): 5471–5569. Дои:10.1021 / cr0684016. PMID 18072803.
- ^ Гарсия, Иисус; Oiarbide, Mikel; Паломо, Клаудио (15 июля 2005 г.). «Текущий прогресс в реакции асимметричного альдольного присоединения». Chem. Soc. Rev. 33 (2): 65–75. Дои:10.1039 / b202901d. PMID 14767502.
- ^ Notz, Вт; Лист Б. (2000). "Прямые асимметричные альдольные реакции, катализируемые пролином". Журнал Американского химического общества. 122 (10): 2395. Дои:10.1021 / ja994280y.
- ^ Гарсия, Иисус; Oiarbide, Mikel; Паломо, Клаудио (15 июля 2005 г.). «Текущий прогресс в реакции асимметричного альдольного присоединения». Chem. Soc. Rev. 33 (2): 65–75. Дои:10.1039 / b202901d. PMID 14767502.
- ^ Notz, Вт; Лист Б. (2000). "Прямые асимметричные альдольные реакции, катализируемые пролином". Журнал Американского химического общества. 122 (10): 2395. Дои:10.1021 / ja994280y.
- ^ Sakthivel, K .; Notz, Вт; Буй, Т; Барбас, С. (2000). "Прямые асимметричные альдольные реакции, катализируемые аминокислотами: биоорганический подход к каталитическим асимметричным реакциям образования углерод-углеродных связей". Журнал Американского химического общества. 122 (22): 5260–5267. Дои:10.1021 / ja010037z. PMID 11457388.
- ^ Гарсия, Иисус; Oiarbide, Mikel; Паломо, Клаудио (15 июля 2005 г.). «Текущий прогресс в реакции асимметричного альдольного присоединения». Chem. Soc. Rev. 33 (2): 65–75. Дои:10.1039 / b202901d. PMID 14767502.
