Стауроспорин - Staurosporine
 | |
 | |
| Клинические данные | |
|---|---|
| Код УВД |
|
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Лиганд PDB | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.109.946 |
| Химические и физические данные | |
| Формула | C28ЧАС26N4О3 |
| Молярная масса | 466.541 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| | |
Стауроспорин (антибиотик AM-2282 или STS) - это натуральный продукт первоначально выделен в 1977 г. из бактерии Streptomyces staurosporeus.[1]Это был первый из более чем 50 алкалоиды быть изолированным с этим типом химической структуры бис-индола. Химическая структура стауроспорина была выяснена с помощью рентгеноструктурного анализа монокристалла и абсолютная стереохимическая конфигурация тем же методом в 1994 году.[2]
Было обнаружено, что стауроспорин обладает биологической активностью от противогрибковой до гипотензивной.[3]Интерес к этой деятельности привел к большим исследовательским усилиям в области химии и биологии и открытию потенциала противоракового лечения.
Биологическая деятельность
Основная биологическая активность стауроспорина - это торможение из протеинкиназы за счет предотвращения связывания АТФ с киназой. Это достигается за счет более сильного сродства стауроспорина к АТФ-связывающему сайту киназы. Стауроспорин является прототипом ингибитора АТФ-конкурентной киназы, поскольку он связывается со многими киназами с высокой аффинностью, хотя и с небольшой селективностью.[4] Структурный анализ киназных карманов показал, что атомы основной цепи, которые сохраняются в своих относительных положениях по отношению к стауроспорину, вносят вклад в распущенность стауроспорина.[5] Отсутствие специфичности помешало его клиническому использованию, но сделало его ценным инструментом исследования. В исследованиях стауроспорин используется для индукции апоптоз. Механизм того, как это опосредует это, не совсем понятен. Было обнаружено, что один из способов, которым стауроспорин вызывает апоптоз, - это активация каспаза-3.[6] В более низкой концентрации, в зависимости от типа клеток, стауроспорин индуцирует специфические эффекты клеточного цикла, задерживая клетки либо в G1 или в G2 фаза клеточного цикла.[7]
Семья химии
Стауроспорин - это индолокарбазол. Он принадлежит к наиболее часто выделяемой группе индолокарбазолов: индоло (2,3-a) карбазолы. Из них стауроспорин относится к наиболее распространенной подгруппе, называемой индоло (2,3-а) пиррол (3,4-с) карбазолами. Они делятся на два класса - галогенированные (хлорированные) и негалогенированные. Галогенированные индоло (2,3-a) пиррол (3,4-c) карбазолы имеют полностью окисленный углерод C-7 только с одним индольным азотом, содержащим β-гликозидную связь, в то время как негалогенированные индоло (2,3-a) пиррол (3,4-c) карбазолы имеют гликозилированные атомы азота индола и полностью восстановленный углерод C-7. Стауроспорин относится к негалогенированному классу.[8]
Стауроспорин - предшественник романа ингибитор протеинкиназы мидостаурин (PKC412).[9][10] Помимо мидостаурина, стауроспорин также используется в качестве исходного материала в промышленном синтезе K252c (также называемый агликоном стауроспорина). В естественном пути биосинтеза K252c является предшественником стауроспорина.


Биосинтез
Биосинтез стауроспорина начинается с аминокислоты L-триптофан в его цвиттерионный форма. Триптофан превращается в я добываю ферментом StaO, который является оксидазой L-аминокислоты (который может зависеть от FAD). StaD воздействует на имин с образованием не охарактеризованного промежуточного соединения, которое, как предполагается, является продуктом димеризации между 2 молекулами имина. Хромопирроловая кислота - это молекула, образованная из этого промежуточного продукта после потери VioE (используется в биосинтезе виолацеина - природного продукта, образующегося в точке разветвления этого пути, который также расходится с образованием Ребеккамицин. Считается, что ариларильное сочетание катализируется цитохром P450 фермент с образованием ароматической кольцевой системы.[8]
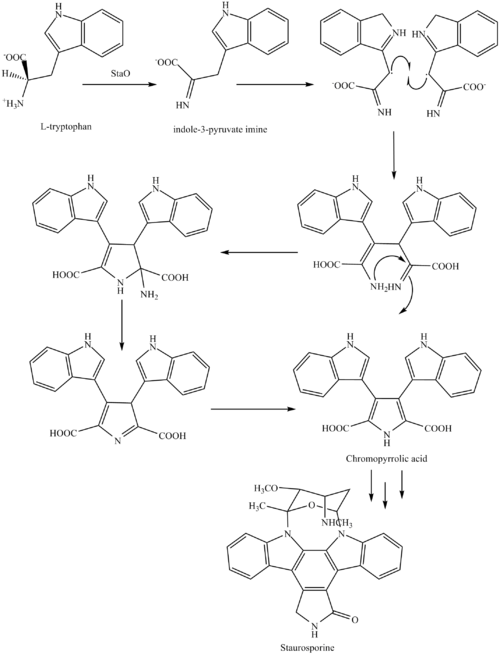
Далее следует нуклеофильная атака между атомами азота индола, приводящими к циклизации, а затем декарбоксилирование с помощью StaC, образующего исключительно агликон стауроспорин или K252c. Глюкоза превращается в NTP-L-ристоамин с помощью StaA / B / E / J / I / K, который затем добавляется к агликону стауроспорина при 1 индоле N с помощью StaG. Фермент StaN переориентирует сахар, присоединяя его ко второму индольному азоту в неблагоприятную конформацию с образованием промежуточного O-деметил-N-деметилстауроспорина. Наконец, O-метилирование 4'амина с помощью StaMA и N-метилирование 3'-гидрокси с помощью StaMB приводит к образованию стауроспорина.[8]
Исследования в клинической практике
При инкапсулировании в липосома наночастица, стауроспорин подавляет опухоли in vivo на мышиной модели без токсических побочных эффектов, которые запрещают его использование в качестве противоракового препарата с высокой апоптотической активностью. Исследователи в Онкологический центр Калифорнийского университета в Сан-Диего Мур разработать платформенную технологию высокой эффективности загрузки лекарственного средства за счет изменения pH среды клеток. При введении в мышь глиобластома модели, стауроспорин накапливается в основном в опухоли через флуоресценция подтверждение, и мыши не потеряли веса по сравнению с контрольными мышами, которым вводили свободное соединение, что является показателем пониженной токсичности.[11][12]
Рекомендации
- ^ Омура С., Иваи Й, Хирано А., Накагава А., Авайя Дж., Цутия Х., Такахаши Ю., Масума Р. (1977). «Новый алкалоид AM-2282 из систематики происхождения Streptomyces, ферментация, выделение и предварительная характеристика». J. Antibiot. 30 (4): 275–282. Дои:10.7164 / антибиотики.30.275. PMID 863788.
- ^ Фунато Н., Такаянаги Х, Конда Й, Тода Й, Харигая Й, Омура С. (1994). «Абсолютная конфигурация стауроспорина по данным рентгеноструктурного анализа». Tetrahedron Lett. 35 (8): 1251–1254. Дои:10.1016/0040-4039(94)88036-0.
- ^ [1] Rüegg UT, Burgess GM. (1989) Staurosporine, K-252 и UCN-01: сильные, но неспецифические ингибиторы протеинкиназ. Тенденции фармакологической науки 10 (6): 218-220.
- ^ Караман М.В., Херргард С., Трейбер Д.К., Галлант П., Аттеридж К.Э., Кэмпбелл Б.Т., Чан К.В., Цицери П., Дэвис М.И., Эдин П.Т., Фараони Р., Флойд М., Хант Дж. , Пател Х.К., Причард С., Водичка Л.М., Зарринкар П.П. (2008). «Количественный анализ селективности ингибитора киназ». Nat. Биотехнология. 26 (1): 127–132. Дои:10.1038 / nbt1358. PMID 18183025. S2CID 205273598.
- ^ Танрамлюк Д., Шрейер А., Питт В. Р., Бланделл Т. Л. (2009). «О происхождении селективности и неразборчивости ферментных ингибиторов: тематическое исследование связывания протеинкиназы со стауроспорином». Chem. Биол. Drug Des. 74 (1): 16–24. Дои:10.1111 / j.1747-0285.2009.00832.x. ЧВК 2737611. PMID 19519740.
- ^ Чэ Х. Дж., Кан Дж. С., Бён Джо, Хан К. С., Ким ДУ, О С. М., Ким Х. М., Ча С. В., Ким Х. Р. (2000). «Молекулярный механизм стауроспорин-индуцированного апоптоза в остеобластах». Фармакологические исследования. 42 (4): 373–381. Дои:10.1006 / фразы 2000.0700. PMID 10987998.
- ^ Бруно С., Ардельт Б., Скирски Дж. С., Траганос Ф., Дарзинкевич З. (1992). «Различные эффекты стауроспорина, ингибитора протеинкиназ, на клеточный цикл и структуру хроматина нормальных и лейкозных лимфоцитов». Рак Res. 52 (2): 470–473. PMID 1728418.
- ^ а б c Райан К.С. (2008). «Структурные исследования ферментов биосинтеза ребеккамицина, стауроспорина и виолацеина» (PDF). Кандидат наук. Тезис. Массачусетский Институт Технологий. Архивировано из оригинал (PDF) 14 марта 2012 г.
- ^ Мидостаурин страница продукта, Ферментек
- ^ Ван, Y; Инь, OQ; Граф, П; Кисицкий, JC; Шран, H (2008). «Дозозависимая и временная фармакокинетика мидостаурина у больных сахарным диабетом». J Clin Pharmacol. 48 (6): 763–775. Дои:10.1177/0091270008318006. PMID 18508951.
- ^ Пресс-релиз (21 октября 2013 г.). «Исследование определяет безопасную систему доставки сложных, но очень эффективных противораковых соединений». Система здравоохранения Калифорнийского университета в Сан-Диего. Получено 27 октября 2013.
- ^ Муктхаварам, Раджеш; Цзян, Пэнгей; Саклеча, Рохит; Симберий, Дмитрий; Бхарати, Ила; Номура, Нацуко; Чао, Инь; Пасторино, Сандра (2013). «Высокоэффективная липосомная инкапсуляция ингибитора тирозинкиназы приводит к улучшению in vivo токсичности и профиля опухолевого ответа». Международный журнал наномедицины. 8 (1): 3991–4006. Дои:10.2147 / IJN.S51949. ЧВК 3808212. PMID 24174874.
