Тетрабромид титана - Titanium tetrabromide
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Бромид титана (IV) | |
| Другие имена Тетрабромид титана | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ECHA InfoCard | 100.029.259 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| TiBr4 | |
| Молярная масса | 367,483 г / моль |
| Внешность | коричневые кристаллы гигроскопичный |
| Плотность | 3,25 г / см3 |
| Температура плавления | 39 ° С (102 ° F, 312 К) |
| Точка кипения | 230 ° С (446 ° F, 503 К) |
| гидролизует | |
| Растворимость в других растворителях | хлороуглероды, бензол |
| Структура | |
| кубическая, Па3, Z = 8 | |
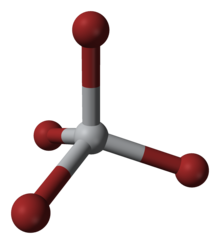
| Тетраэдр | |
| 0 D | |
| Опасности | |
| Главный опасности | разъедающий |
| R-фразы (устарело) | 14-34 |
| S-фразы (устарело) | 26-36/37/39-45 |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Родственные соединения | |
Другой анионы | Хлорид титана (IV) Фторид титана (IV) Иодид титана (IV) |
Родственные соединения | Бромид титана (III) |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Тетрабромид титана это химическое соединение с формула TiBr4. Это наиболее летучий бромид переходного металла. Свойства TiBr4 являются средним значением TiCl4 и TiI4. Некоторыми ключевыми свойствами этих четырехкоординированных разновидностей Ti (IV) являются их высокая кислотность Льюиса и их высокая растворимость в неполярных органических растворителях. TiBr4 диамагнитен, отражает d0 конфигурация металлического центра.[1]
Подготовка и состав
Этот четырехкоординированный комплекс имеет тетраэдрическую геометрию. Его можно получить несколькими способами: (i) из элементов, (ii) по реакции TiO2 с углеродом и бромом (см. Кролл процесс ), и (iii) обработкой TiCl4 с HBr.
Реакции
Тетрабромид титана образует аддукты, такие как TiBr4(THF )2 и [TiBr5]−.[2] С объемными донорскими лигандами, такими как 2-метилпиридин (2-Mepy), образуются пятикоординированные аддукты. TiBr4(2-MePy) является тригонально-бипирамидальным с пиридином в экваториальной плоскости.[3]
TiBr4 был использован в качестве кислоты Льюиса катализатор в органический синтез.[4]
Тетрабромид и тетрахлориды титана реагируют с образованием статистической смеси смешанных тетрагалогенидов TiBr4-хClИкс (х = 0-4). Механизм этого реакция перераспределения неопределенно. Один из предложенных путей предполагает промежуточность димеры.[5]
Безопасность
TiBr4 быстро гидролизуется, потенциально опасно, с выделением бромистый водород, иначе известная как бромистоводородная кислота.
Рекомендации
- ^ Холлеман, А. Ф .; Виберг, Э. "Неорганическая химия" Academic Press: Сан-Диего, 2001. ISBN 0-12-352651-5.
- ^ Колин С. Кризер и Дж. Алан Крейтон (1975). «Пентахлор- и пентабром-титанат (IV) ионы». J. Chem. Soc., Dalton Trans. (14): 1402–1405. Дои:10.1039 / DT9750001402.
- ^ Hensen, K .; Lemke, A .; Болте, М. (2000). «Тетрабром (2-метилпиридин-N) -титанат (IV)». Acta Crystallographica. C56 (12): e565 – e566. Дои:10.1107 / S0108270100015407.
- ^ Б. Паттерсон, С. Марумото и С. Д. Рихновский (2003). "Циклизация альдол-принца Мукаяма, стимулированная титаном (IV)". Орг. Lett. 5 (17): 3163–3166. Дои:10.1021 / ol035303n. PMID 12917007.
- ^ С. П. Уэбб и М. С. Гордон (1999). «Межмолекулярные самовзаимодействия тетрагалогенидов титана TiX4 (X = F, Cl, Br)». Варенье. Chem. Soc. 121 (11): 2552–2560. Дои:10.1021 / ja983339i.

