Нитрат титана - Titanium nitrate - Wikipedia
 | |
| Имена | |
|---|---|
| Другие имена тетранитрат титана, тетранитратотитан | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.222.601 |
PubChem CID | |
| |
| |
| Характеристики | |
| Ti (НЕТ3)4 | |
| Молярная масса | 295,8866 г / моль |
| Внешность | белое летучее твердое вещество |
| Плотность | 2.192[1] |
| Температура плавления | 58,5 ° С (137,3 ° F, 331,6 К) |
| Точка кипения | разлагать |
| Растворимый | |
| Структура[2] | |
| моноклинический | |
| P21/ C | |
а = 7.80, б = 13.57, c = 10,34 Å α = 90 °, β = 125 · 0 °, γ = 90 ° | |
Объем решетки (V) | 896,52 Å3 |
Формула единиц (Z) | 4 |
| 8 | |
| уплощенный четырехгранник | |
| Родственные соединения | |
Родственные соединения | нитрат гафния, нитрат циркония, фосфат титана, перхлорат титана |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Нитрат титана это неорганическое соединение с формулой Ti (NO3)4. Это бесцветное диамагнитное твердое вещество, которое легко возгоняется. Это необычный пример летучего бинарного нитрата переходного металла. Точно определенные частицы, называемые нитратом титана, образуются при растворении титана или его оксидов в азотной кислоте.
Подготовка
Как и в оригинальном методе,[3][4] Ti (НЕТ3)4 готовится нитрованием тетрахлорид титана с помощью пятиокись азота:[5]
- TiCl4 + 4 N2О5 → Ti (НЕТ3)4 + 4 ClNO2
Гидратированный нитрат титана образуется при растворении соединений титана в азотной кислоте.[6]
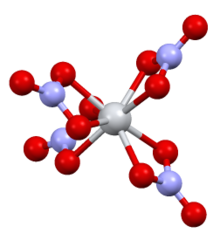
Структура
В комплексе есть D2d симметрия, с четырьмя бидентатными нитратными лигандами. Расстояния N-O составляют 1 · 29 Å и 1 · 185 Å (без координации).[2]
Физические свойства
В инфракрасном спектре он сильно поглощает на 1635 см.−1, отнесенный к колебательной моде N-O.[7]
Растворим в неполярных растворителях. тетрахлорид кремния и четыреххлористый углерод.[8][4]
Реакции
Нитрат титана гигроскопичен, превращаясь в нечеткие гидраты.[9] Безводный материал обладает высокой реакционной способностью даже по отношению к углеводородам.[9] Нитрат титана также реагирует с n-додекан,[10] п-дихлорбензол, анизол, бифенил,[10][11]
Он термически разлагается до диоксида титана.[12]
Рекомендации
- ^ «Нитрат титана (iv) (Ti (NO3) 4)». Получено 27 сентября 2014.
- ^ а б Гарнер, К. Дэвид; Ян Х. Хиллер; Мартин Ф. Гость (1975). «Ab initio самосогласованный полевой молекулярно-орбитальный расчет основного состояния тетранитратотитана (IV); комментарии к реакционной способности безводных нитратов металлов». Журнал химического общества, Dalton Transactions (19): 1934. Дои:10.1039 / DT9750001934. ISSN 0300-9246.
- ^ Рейлен, Ханс; Андреас Хейк (1927). "Uber die Konstitution des N2O4 und N2O3 und die Additionsverbindungen von Nitro- und Nitrosokörpern an Zinn- und Titantetrachlorid". Annalen der Chemie Юстуса Либиха (на немецком). 452 (1): 47–67. Дои:10.1002 / jlac.19274520104. ISSN 0075-4617.
- ^ а б Шмайссер, Мартин (1955). "Die Chemie der anorganischen Acylnitrate (ein Problem des Nitrylchlorids) und Acylperchlorate (ein Problem des Dichlorhexoxyds)". Angewandte Chemie (на немецком). 67 (17–18): 493–501. Дои:10.1002 / ange.19550671708. ISSN 0044-8249.
- ^ П. Эрлих «Тетранитрат титана» в Справочнике по препаративной неорганической химии, 2-е изд. Под редакцией Г. Брауэра, Academic Press, 1963, NY. Vol. 1. п. 1237.
- ^ Виберг, Эгон; Виберг, Нильс (2001). Неорганическая химия. Академическая пресса. п. 1331. ISBN 9780123526519. Получено 28 сентября 2014.
- ^ C. C. Addison, N. Logan, S. C. Wallwork и C. D. Garner, "Структурные аспекты координированных нитратных групп" Quart. Rev., Chem. Soc., 1971, том 25, 289-322. Дои:10,1039 / qr9712500289.
- ^ Amos, D.W .; G.W. Флюетт (1974). «Рамановские спектры нитратов титана (IV) и олова (IV)». Spectrochimica Acta, часть A: Молекулярная спектроскопия. 30 (2): 453–461. Bibcode:1974AcSpA..30..453A. Дои:10.1016/0584-8539(74)80085-1. ISSN 0584-8539.
- ^ а б Amos, D.W .; Д.А. Бейнс, Г. Флюетт (1973). «Нитрование нитратом титана (IV)». Буквы Тетраэдра. 14 (34): 3191–3194. Дои:10.1016 / S0040-4039 (00) 79808-X. ISSN 0040-4039.
- ^ а б Coombes, Роберт Дж .; Лесли В. Рассел (1974). «Нитрование ароматических соединений тетранитратотитаном (IV) в растворе четыреххлористого углерода». Журнал химического общества, Perkin Transactions 2 (7): 830. Дои:10.1039 / P29740000830. ISSN 0300-9580.
- ^ Шофилд, Кеннет (1980). Ароматическое нитрование. КУБОК Архив. С. 97–98. ISBN 9780521233620. Получено 27 сентября 2014.
- ^ Аллендорф, Марк Дональд (1999-01-01). "CVD оксида титана из нитрата титана (IV) ...". Материалы симпозиума по фундаментальной газовой фазе и химии поверхности при синтезе парофазных материалов. Электрохимическое общество. С. 395–397. ISBN 9781566772174. Получено 27 сентября 2014.
Другое чтение
- Partington, J. R .; А. Л. Уайнс (1949). «660. Реакции нитрозилхлорида. Часть II». Журнал химического общества (возобновлено): 3135. Дои:10.1039 / JR9490003135. ISSN 0368-1769.
- Dauerman, L .; G.E. Зальсер (1973). «Масс-спектры ковалентных неорганических нитратов: нитрата меди (II) и нитрата титана (IV)». Журнал неорганической и ядерной химии. 35 (1): 304–306. Дои:10.1016/0022-1902(73)80643-8. ISSN 0022-1902.
