Алкильные комплексы переходных металлов - Transition metal alkyl complexes

Алкильные комплексы переходных металлов находятся координационные комплексы которые содержат связь между переходный металл и алкил лиганд. Такие комплексы не только широко распространены, но и представляют практический и теоретический интерес.[1][2]
Объем
Большинство алкильных комплексов металлов содержат другие, не алкильные лиганды. Большой интерес, в основном теоретический, был сосредоточен на гомолептических комплексах. Действительно, первый зарегистрированный пример комплекса, содержащего металл-sp3 углеродная связь была гомолептическим комплексом диэтилцинк. Другие примеры включают гексаметилвольфрам, тетраметилтитан и тетранорборнилкобальт.[3]
 Состав диэтилцинка. Связи Zn-C имеют размер 194,8 (5) пм, в то время как угол C-Zn-C слегка изогнут на 176,2 (4) °.[4]
Состав диэтилцинка. Связи Zn-C имеют размер 194,8 (5) пм, в то время как угол C-Zn-C слегка изогнут на 176,2 (4) °.[4]
Смешанные лигандные или гетеролептические комплексы, содержащие алкилы, многочисленны. В природе, витамин B12 и его многие производные содержат реакционноспособные Со-алкильные связи.
 Гексаметилвольфрам представляет собой пример "гомолептического" (все лиганды одинаковы) металлоалкильного комплекса.[3]
Гексаметилвольфрам представляет собой пример "гомолептического" (все лиганды одинаковы) металлоалкильного комплекса.[3]
Подготовка
Металлалкильные комплексы обычно получают двумя способами: с использованием алкилнунклеофилов и с использованием алкилэлектрофилов. Нуклеофильные источники алкильных лигандов включают: Реактивы Гриньяра и литийорганические соединения. Поскольку многие сильные нуклеофилы также являются мощными восстановителями, иногда используются слабонуклеофильные алкилирующие агенты, чтобы избежать окислительно-восстановительных реакций. Цинкорганические соединения и алюминийорганические соединения такие мягкие реагенты.
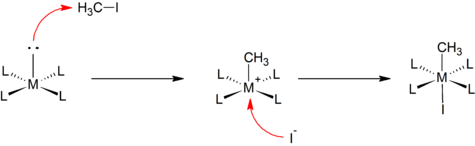
Электрофильное алкилирование обычно начинается с комплексов металлов с низкой валентностью. Типичные электрофильные реагенты: алкилгалогениды. Показательным является получение метильного производного циклопентадиенилдикарбонил-анион железа:[5]
- CpFe (CO)2Na + CH3I → CpFe (CO)2CH3 + NaI
Многие алкилы металлов получают окислительная добавка:[2]
Примером может служить реакция Васьковский комплекс с метилиодид.

Агостические взаимодействия и устранение бета-гидрида
Некоторые алкилы металлов имеют агостические взаимодействия между связью C-H в алкильной группе и металлом. Такие взаимодействия особенно характерны для комплексов ранних переходных металлов в их высших степенях окисления.[7]
Одним из факторов, определяющих кинетическую стабильность комплексов металл-алкил, является присутствие водорода в бета-положении по отношению к металлу. Если такие водороды присутствуют и металлический центр координационно ненасыщенный, то комплекс может пройти устранение бета-гидрида с образованием комплекса металл-алкен:

Предполагается, что эти преобразования происходят через посредство агостических взаимодействий.
Катализ
Много гомогенные катализаторы действуют через посредство алкилов металлов. Эти реакции включают гидрирование, гидроформилирование, изомеризация алкена и полимеризация олефинов. Предполагается, что соответствующие неоднородный в реакциях также участвуют металл-алкильные связи.[8]
Рекомендации
- ^ Оливейра, Хосе; Эльшенбройх, Кристоф (2006). Металлоорганические соединения (3., полностью перераб. И доп. Ред.). Weinheim: Wiley-VCH-Verl. ISBN 978-3-527-29390-2.
- ^ а б Хартвиг, Дж. Ф. (2010). Химия органических переходных металлов, от связывания до катализа. Нью-Йорк: Университетские научные книги. ISBN 978-1-891389-53-5.
- ^ а б Kleinhenz, S .; Pfennig, V .; Сеппельт, К. (1998). "Подготовка и структуры [W (CH3)6], [Re (CH3)6], [Nb (CH3)6]−, и [Ta (CH3)6]−". Химия - Европейский журнал. 4 (9): 1687–1691. Дои:10.1002 / (SICI) 1521-3765 (19980904) 4: 9 <1687 :: AID-CHEM1687> 3.0.CO; 2-R.CS1 maint: использует параметр авторов (связь)
- ^ Джон Бакса; Феликс Ханке; Сара Хиндли; Раджеш Одедра; Джордж Р. Дарлинг; Энтони С. Джонс; Александр Штайнер (2011). «Твердотельные структуры диметилцинка и диэтилцинка». Angewandte Chemie International Edition. 50 (49): 11685–11687. Дои:10.1002 / anie.201105099. ЧВК 3326375. PMID 21919175.
- ^ Кинг, Б. (1970). «Применение карбонильных анионов металлов в синтезе необычных металлоорганических соединений». Соотв. Chem. Res. 3 (12): 417–427. Дои:10.1021 / ar50036a004.
- ^ З. Давуди, М. Л. Х. Грин, В. С. Б. Мтетва, К. Прут, А. Дж. Шульц, Дж. М. Уильямс, Т. Ф. Кетцле (1986). "Доказательства взаимодействий углерод-водород-титан: синтез и кристаллические структуры агостических алкилов [TiCl3(Мне2PCH2CH2PMe2) R] (R = Et или Me) " (PDF). J. Chem. Soc., Dalton Trans. (8): 1629. Дои:10.1039 / dt9860001629.CS1 maint: использует параметр авторов (связь)
- ^ Scherer, W .; Макгрэйди, Г.С. (2004). "Агостические взаимодействия в d0 Металлоалкильные комплексы ». Энгью. Chem. Int. Эд. 43 (14): 1782–1806. Дои:10.1002 / anie.200200548. PMID 15054779.CS1 maint: использует параметр авторов (связь)
- ^ Форбс, Джеффри Дж .; Геллман, Эндрю Дж. (1993-07-01). «Механизм отщепления β-гидрида в адсорбированных алкильных группах». Журнал Американского химического общества. 115 (14): 6277–6283. Дои:10.1021 / ja00067a048. ISSN 0002-7863.