Ванадат - Vanadate - Wikipedia

В химии ванадат анионный координационный комплекс из ванадий. Часто ванадат относится к оксоанионам ванадий, большинство из которых существует в высших степень окисления из +5. Комплексы [V (CN)6]3- и [V2Cl9]3- называются гексацианованадатом и нонахлордиванадатом.
Простой ион ванадата - это тетраэдрический ортованадат, VO3−
4 анион, который присутствует, например, в ортованадат натрия и в решениях V2О5 в сильной базе (pH > 13[1]). Обычно этот ион представлен одинарной двойной связью, однако это резонансная форма поскольку ион представляет собой правильный тетраэдр с четырьмя эквивалентными атомами кислорода.
Кроме того, существует ряд полиоксованадат-ионов, который включает дискретные ионы и «бесконечные» полимерные ионы.[2] Также существуют ванадаты, такие как ванадат родия, RhVO.4, имеющий статистический рутил структура, где Rh3+ и V5+ ионы случайным образом занимают Ti4+ позиции в решетке рутила,[3] которые не содержат решетку из катионов и уравновешивающих ванадат-анионов, но являются смешанные оксиды.
В химической номенклатуре, когда ванадат является частью названия, это означает, что соединение содержит анион с центральным атомом ванадия, например гексафторованадат аммония - это общее название соединения (NH4)3VF6 с Название ИЮПАК гексафторидованадата аммония (III).
Примеры оксованадат-ионов
Некоторые примеры дискретных ионов:
- VO3−
4 «ортованадат», четырехгранный.[2] - V
2О4−
7 "пированадат", угловой общий ВО4 тетраэдры, подобные дихромат ион[2] - V
3О3−
9, циклический с общим угловым ВО4 тетраэдры[4] - V
4О4−
12, циклический с общим угловым ВО4 тетраэдры[5] - V
5О3−
14, угловой общий ВО4 тетраэдры[6] - V
6О6−
18, звенеть.[7] - V
10О6−
28 "декаванадат", VO с разделением по краям и по углам6 октаэдры[2] - V
12О4−
32 - V
13О3−
34, плавленый ВО6 октаэдры [8] - V
18О12−
42[9]
Некоторые примеры полимерных «бесконечных» ионов:
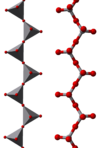 |  | 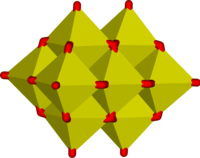 |
В этих ионах ванадий проявляет тетраэдрическую, квадратно-пирамидальную и октаэдрическую координацию. В этом отношении ванадий имеет сходство с вольфрамат и молибдат, тогда как хром, однако, имеет более ограниченный набор ионов.
Водные растворы
Растворение пятиокиси ванадия в сильнощелочном водном растворе дает бесцветный VO3−
4 ион. При подкислении цвет этого раствора постепенно темнеет от оранжевого до красного примерно при pH 7. Коричневый гидратированный V2О5 осаждается около pH 2, повторно растворяется с образованием светло-желтого раствора, содержащего [VO2(ЧАС2O)4]+ ион. Количество и идентичность оксианионов, которые существуют между pH 13 и 2, зависят от pH, а также от концентрации. Например, протонирование ванадата инициирует серию конденсаты для получения ионов полиоксованадата:[2]
- pH 9–12; HVO2−
4, V
2О4−
7 - pH 4–9; ЧАС
2VO−
4, V
4О4−
12, HV
10О5−
28 - pH 2–4; ЧАС3VO4, ЧАС
2V
10О4−
28
Фармакологические свойства
Ванадат - мощный ингибитор определенных плазматических мембран. АТФазы, Такие как Na+/ К+-ATPase и Ca2+-ATPase (PMCA ). Действуя как аналог фосфата в переходном состоянии, ванадат подвергается нуклеофильной атаке со стороны воды во время переноса фосфорила, по существу «улавливая» АТФазы P-типа в их фосфорилированном состоянии E2.[11][12] Однако он не ингибирует другие АТФазы, такие как SERCA (сарко / эндоплазматический ретикулум Ca2+-АТФаза), актомиозин-АТФаза и митохондриальная АТФаза.[13][14][15]
Рекомендации
- ^ Коттон, Ф. Альберт; Уилкинсон, Джеффри; Мурильо, Карлос А .; Бохманн, Манфред (1999), Продвинутая неорганическая химия (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 0-471-19957-5
- ^ а б c d е ж Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ Уэллс А.Ф. (1984) Структурная неорганическая химия 5-е издание Oxford Science Publications ISBN 0-19-855370-6
- ^ Гамильтон Э. Э .; Fanwick P.E .; Вилкер Дж. Дж. (2002). "Неуловимый ванадат (V3О9)3−: Изоляция, кристаллическая структура и поведение неводного раствора ». Варенье. Chem. Soc. 124 (1): 78–82. Дои:10.1021 / ja010820r. PMID 11772064.
- ^ Г.-Ю. Ян, Д.-В. Гао, Ю. Чен, Ж.-К. Сюй, Q.-X. Цзэн, Х.-Р. Вс, З.-В. Пей, К. Су, Ю. Син, Ю.-Х. Линг и Х.-К. Цзя (1998). "[Ni (C10ЧАС8N2)3] 2 [V4О12] · 11H2О ". Acta Crystallographica C. 54 (5): 616–618. Дои:10.1107 / S0108270197018751.CS1 maint: несколько имен: список авторов (связь)
- ^ В. В. Дэй; Вальтер Г. Клемперер; О. М. Яги (1989). «Новый структурный тип в химии полиоксоанионов: синтез и строение V
5О3−
14 анион". Варенье. Chem. Soc. 111 (12): 4518. Дои:10.1021 / ja00194a068. - ^ Гуан-Чуан Оу .; Лонг Цзян; Сяо-Лун Фэн; Тонг-Бу Лу (2009). «Макроциклические металлокомплексы ванадия с полиоксоанионным мостиком: от одномерных до трехмерных структур». Dalton Transactions. 1 (1): 71–76. Дои:10.1039 / B810802A. PMID 19081973.
- ^ Hou D .; Hagen K.D .; Hill C.L. (1992). "Тридекаванадат, [V13О34]3−, новый изополиванадат с высоким потенциалом ». Варенье. Chem. Soc. 114 (14): 5864. Дои:10.1021 / ja00040a061.
- ^ Мюллер А .; Sessoli R .; Krickemeyer E .; Bögge H .; Мейер Дж .; Gatteschi D .; Pardi L .; Westphal J .; Hovemeier K .; Rohlfing R .; Деринг Дж; Hellweg F .; Beugholt C .; Шмидтманн М. (1997). «Полиоксованадаты: высокоядерные спиновые кластеры с интересными системами хозяин – гость и различными электронными популяциями. Синтез, организация спинов, магнитохимия и спектроскопические исследования». Неорг. Chem. 36 (23): 5239. Дои:10.1021 / ic9703641.
- ^ Jouanneau, S .; Verbaere, A .; Гайомар, Д. (2003). «О новом ванадате кальция: синтез, структура и поведение введения Li». Журнал химии твердого тела. 172 (1): 116–122. Bibcode:2003JSSCh.172..116J. Дои:10.1016 / S0022-4596 (02) 00164-0.
- ^ Кюльбрандт, Вернер (апрель 2004 г.). «Биология, структура и механизм АТФаз P-типа». Обзоры природы. Молекулярная клеточная биология. 5 (4): 282–295. Дои:10.1038 / nrm1354. ISSN 1471-0072. PMID 15071553.
- ^ Дэвис, Дуглас Р .; Хол, Вим Г.Дж. (2004-11-19). «Сила ванадата в кристаллографических исследованиях ферментов переноса фосфорила». Письма FEBS. 577 (3): 315–321. Дои:10.1016 / j.febslet.2004.10.022. ISSN 0014-5793. PMID 15556602.
- ^ Luo D .; Nakazawa M .; Yoshida Y .; Cai J .; Имаи С. (2000). "Эффекты трех разных Ca2+ ингибиторы АТФазы накачки при вызванных сокращениях аорты кролика и активности Са2+ качать АТФазы в аорте свиньи ». Общая фармакология: сосудистая система. 34 (3): 211–220. Дои:10.1016 / S0306-3623 (00) 00064-1. PMID 11120383.
- ^ Bowman B.J .; Слейман К.В. (1979). «Влияние ванадата на АТФазу плазматической мембраны Neurospora crassa». Журнал биологической химии. 254 (8): 2928–2934. PMID 155060.
- ^ Аурелиано, Мануэль; Кранс, Дебби С. (2009). «Декаванадат (V
10О6−
28) и оксованадаты: оксометаллаты со многими биологическими активностями ». Журнал неорганической биохимии. 103 (4): 536–546. Дои:10.1016 / j.jinorgbio.2008.11.010. ISSN 0162-0134.
