Ксилилен - Xylylene
 орто-Ксилилен |
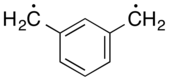 мета-Ксилилен |
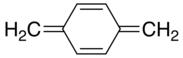 параграф-Ксилилен |
Ксилилен состоит из двух изомерных органические соединения с формулой C6ЧАС4(CH2)2. Эти соединения относятся к соответствующим хиноны заменой атомов кислорода на CH2 группы. орто- и параграф -ксилилен наиболее известен, хотя ни один из них не является стабильным в твердой или жидкой форме. В мета форма - это бирадикал. Однако некоторые замещенные производные ксилиленов очень стабильны, например: тетрацианохинодиметан.
п-ксилилен
п-Ксилилен образуется при пиролизе п-ксилол или, что проще, α-замещенные производные. п-Ксилилен димеризуется с умеренной эффективностью давать п-циклофан:[1]

Дальнейший нагрев п-циклофан дает поли(параграф-ксилилен).
о-ксилилен
Реакция тетрабром-о-ксилол (C6ЧАС4(CHBr2)2) с иодидом натрия дает α, α'-дибром-о-ксилилен, который может быть захвачен диенофилы дать производные нафтилена. В отсутствие улавливающих агентов ксилилен релаксирует до α, α'-дибромбензоциклобутана:[2]
- C6ЧАС4(CHBr2)2 + 2 NaI → C6ЧАС4(= CHBr)2 + 2 NaBr + I2
- C6ЧАС4(= CHBr)2 → С6ЧАС4(CHBr)2
Циклоприсоединения этих о-ксилиленов обеспечивает путь к acenes.[3]
В диен единица, образованная двумя экзоциклический алкеновые звенья орто изомер может служить лиганд в координационные комплексы. Например, реакция α, α'-дибром-о-ксилол с карбонилы железа дает низкие выходы ксилиленового комплекса Fe (CO)3[η4-C6ЧАС4(CH2)2]. Этот продукт структурно аналогичен Fe (CO).3[η4-1,3-бутадиен ].[4]
При высоких температурах бензоциклобутены может пройти электроциклическое раскрытие кольца формировать о-ксилилены. Этот и другие синтезы о-ксилиленов и их последующая димеризация по [4 + 4] циклоприсоединение с образованием циклоктильных структур, неоднократно использовались при синтезе суперфан.[5]
Электронная структура
Несмотря на наблюдаемый химический состав пара-ксилилена (то есть его быстрая полимеризация до поли-пара-ксилилена), который предполагает, что соединение существует в виде бирадикала, физические доказательства единодушно заключают, что самое низкое электронное состояние пара-ксилилена является синглетом с закрытой оболочкой. Кроме того, это назначение подтверждается несколькими вычислительными методами.[6] Наоборот, мета-ксилилен является молекула не-Кекуле что есть триплет основное состояние.[7]
Рекомендации
- ^ Х. Э. Винберг, Ф. С. Фосетт "[2.2] Парациклофан" Органический синтез, Сб. Vol. 5, стр.883 (1973); Vol. 42, стр.83 (1962) Связь.
- ^ Cava, M. P .; Deana, A. A .; Мут, К. (1959). «Конденсированные циклобутановые ароматические соединения. VIII. Механизм образования 1,2-дибромбензоциклобутена; новый синтез Дильса-Альдера». Журнал Американского химического общества. 81 (24): 6458–6460. Дои:10.1021 / ja01533a032.
- ^ Пэддон-Роу, Майкл Н .; Патни, Хариш К. (1986). «Эффективная синтетическая стратегия для нафталина аннелляции норборненилогичных систем». Синтез. 1986 (4): 328–330. Дои:10.1055 / с-1986-31603.
- ^ Р. К. Кербер, Е. С. Рибаков "Образование карбонильных комплексов железа реакционноспособных полиенов из дигалогенидов с участием свободного полиена" Organometallics, 1991, том 10, стр 2848–2853.Дои:10.1021 / om00054a059
- ^ Sekine, Y .; Brown, M .; Бокельхайде В. (1979). «[2.2.2.2.2.2] (1,2,3,4,5,6) Циклофан: суперфан». Журнал Американского химического общества. 101 (11): 3126–3127. Дои:10.1021 / ja00505a053.
- ^ Монтгомери, Л. К., Хаффман, Дж. К., Юрчак, Э. А. и Грендзе, М. П. Молекулярные структуры углеводородов Тиле и Чичибабина. Варенье. Chem. Soc. 108, 6004–6011 (1986) DOI:10.1021 / ja00279a056
- ^ Стеглич, Матиас; Кустодис, Виктория Б. Ф .; Trevitt, Adam J .; даСильва, Габриэль; Боди, Андраш; Хембергер, Патрик (2017). «Фотоэлектронный спектр и энергетика мета-Ксилилен бирадикал ". Варенье. Chem. Soc. 139 (41): 14348–14351. Дои:10.1021 / jacs.7b06714.
