Тетраиодид углерода - Carbon tetraiodide
 | |||
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Тетраиодметан[1] | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 1733108 | |||
| ChemSpider | |||
| ECHA InfoCard | 100.007.335 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| |||
| |||
| Характеристики | |||
| Cя4 | |||
| Молярная масса | 519.629 г · моль−1 | ||
| Внешность | Темно-фиолетовые кристаллы | ||
| Плотность | 4,32 г мл−1 | ||
| -136·10−6 см3/ моль | |||
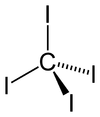
| Структура | |||
| Тетрагональный | |||
| Тетраэдр | |||
| 0 Д | |||
| Термохимия | |||
Теплоемкость (C) | 0,500 Дж · К−1 грамм−1 | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | 384,0–400,4 кДж моль−1 | ||
Станд. Энтальпия горение (ΔcЧАС⦵298) | −794,4–−778,4 кДж моль−1 | ||
| Опасности | |||
| Пиктограммы GHS |  | ||
| Сигнальное слово GHS | Предупреждение | ||
| H315, H319, H335 | |||
| P261, P305 + 351 + 338 | |||
| Родственные соединения | |||
Родственные алканы | |||
Родственные соединения | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Тетраиодид углерода это тетрагалогенметан с молекулярной формулой CI4. Будучи ярко-красным, это относительно редкий пример ярко окрашенного метан производная. Это всего лишь 2 мас.% Углерода, хотя известны другие производные метана с еще меньшим содержанием углерода.
Структура
Тетраэдрическая молекула имеет расстояния C-I 2,12 ± 0,02 Å.[2] Молекула слегка переполнена короткими контактами между атомами йода размером 3,459 ± 0,03 Å, и, возможно, по этой причине она термически и фотохимически нестабильна.
Тетраиодид углерода кристаллизуется в четырехугольный Кристальная структура (а 6.409, c 9.558 (.10−1 нм)).[3]
У него ноль дипольный момент за счет симметрично замещенного четырехгранный молекула.
Свойства, синтез, использование
Тетраиодид углерода слабо реагирует с водой, давая йодоформ и я2. Растворим в неполярных органических растворителях. Он термически и фотохимически разлагается до тетрайодэтилен, С2я4. Его синтез влечет за собой AlCl3 -катализируемый галогенидный обмен, который проводится при комнатной температуре:[4]
Продукт кристаллизуется из реакционного раствора.
Тетраиодид углерода используется как йодирование реагент, часто при реакции с основаниями.[5] Кетоны превращаются в 1,1-дииодалкены при обработке трифенилфосфин (PPh3) и тетраиодид углерода. Спирты превращаются в иодид по механизму, аналогичному механизму Реакция Аппеля. В реакции Аппеля четыреххлористый углерод используется для получения алкилхлоридов из спиртов.
Соображения безопасности
Производители рекомендуют хранить тетраиодид углерода при температуре около 0 ° C (32 ° F). Как готовый источник йода, это раздражитель. Его LD50 составляет 178 мг / кг−1. В целом, пергалогенированные органические соединения следует считать токсичными, за исключением небольших перфторалканов (по существу инертных из-за прочности связи C-F).
Рекомендации
- ^ «Тетраиодметан - Резюме соединения». PubChem Compound. США: Национальный центр биотехнологической информации. 27 марта 2005 г. Идентификационные и связанные записи. Получено 29 февраля 2012.
- ^ Finbak, Chr .; Хассель, О. (1937). "Kristallstruktur und Molekülbau von CI"4 унд CBr4". Zeitschrift für Physikalische Chemie. B36: 301–308. Дои:10.1515 / зпч-1937-3621.
- ^ Поль С. (1982). "Die Kristallstruktur von CI"4". Zeitschrift für Kristallographie. 159: 211–216. Дои:10.1524 / zkri.1982.159.14.211.
- ^ McArthur, R.E .; Саймонс, Дж. Х. (1950). «Тетраиодид углерода». Неорганические синтезы. III: 37–39. Дои:10.1002 / 9780470132340.ch8.
- ^ П. Р. Шрейнер, А. А. Фокин (2005). «Тетраиодид углерода». В Л. Пакетте (ред.). Энциклопедия реагентов для органического синтеза. John Wiley & Sons, Ltd.
дальнейшее чтение
- Соррос Х., Хинкам Дж. Б. (1945). «Реакция перераспределения. XI. Применение к получению тетраиодида углерода и родственных галогенидов». Журнал Американского химического общества. 67: 1643. Дои:10.1021 / ja01226a004.



