Йодоформ - Iodoform
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Трийодметан | |||
| Другие имена Йодоформ;[1] Трииодид углерода | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 1697010 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.795 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
| MeSH | йодоформ | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| |||
| |||
| Характеристики | |||
| CЧАСя3 | |||
| Молярная масса | 393.732 г · моль−1 | ||
| Внешность | Бледные, светло-желтые, непрозрачные кристаллы | ||
| Запах | Подобный шафрану[2] | ||
| Плотность | 4,008 г см−3[2] | ||
| Температура плавления | 119 ° С (246 ° F, 392 К) [2] | ||
| Точка кипения | 218 ° С (424 ° F, 491 К) [2] | ||
| 100 мг л−1[2] | |||
| Растворимость в диэтиловый эфир | 136 г л−1 | ||
| Растворимость в ацетон | 120 г л−1 | ||
| Растворимость в этиловый спирт | 78 г л−1 | ||
| бревно п | 3.118 | ||
Закон Генри постоянный (kЧАС) | 3,4 мкмоль Па−1 кг−1 | ||
| −117.1·10−6 см3/ моль | |||
| Структура | |||
| Шестиугольный | |||
| Тетрагональный | |||
| Тетраэдр | |||
| Термохимия | |||
Теплоемкость (C) | 157,5 Дж · К−1 моль−1 | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | 180,1–182,1 кДж моль−1 | ||
Станд. Энтальпия горение (ΔcЧАС⦵298) | −716,9 - −718,1 кДж моль−1 | ||
| Фармакология | |||
| D09AA13 (ВОЗ) | |||
| Опасности | |||
| Пиктограммы GHS |  | ||
| Сигнальное слово GHS | Предупреждение | ||
| H315, H319, H335 | |||
| P261, P280, P305 + 351 + 338 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 204 ° С (399 ° F, 477 К) | ||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза ) | |||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | никто[3] | ||
REL (Рекомендуемые) | 0,6 частей на миллион (10 мг / м3)[3] | ||
IDLH (Непосредственная опасность) | N.D.[3] | ||
| Родственные соединения | |||
Связанные галогеналканы | |||
Родственные соединения | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||

Йодоформ (также известен как трийодметан и неточно, поскольку трииодид углерода) это йодорганическое соединение с формула CЧАСя3. Бледно-желтое, кристаллическое, летучее вещество, оно имеет проникающий и характерный запах (в старых текстах по химии этот запах иногда упоминается как запах больниц, где это соединение до сих пор широко используется) и аналогично запаху. хлороформ, сладковатый вкус. Иногда его используют как дезинфицирующее средство.
Структура
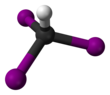
Молекула принимает тетраэдрическая молекулярная геометрия с C3в симметрия.
Синтез и реакции
Впервые синтез йодоформа описал Жорж-Симон Серуллас в 1822 г. - реакциями паров йода с паром над раскаленными углями, а также реакцией калия с этанольным йодом в присутствии воды;[5] и в то же время независимо Джон Томас Купер.[6] Он синтезируется в галоформная реакция реакцией йода и гидроксида натрия с любым из этих четырех видов органических соединений: метилом кетон (CH3COR), ацетальдегид (CH3СНО), этиловый спирт (CH3CH2OH), и некоторые вторичные спирты (CH3CHROH, где R представляет собой алкильную или арильную группу).
Реакция йода и основания с метил кетоны настолько надежен, что йодоформный тест (появление желтого осадка) используется для определения наличия метилкетона. То же самое и при тестировании конкретных вторичные спирты содержащий по крайней мере один метил группа в альфа-позиция.
Некоторые реагенты (например, йодистый водород ) преобразовать йодоформ в дииодметан. Также преобразование в углекислый газ возможно: Йодоформ реагирует с водным нитрат серебра производить монооксид углерода. При обработке порошком элементарного серебра йодоформ восстанавливается, образуя ацетилен. При нагревании йодоформ разлагается с образованием двухатомного йода, газообразного йодистого водорода и углерода.
Естественное явление
В чепчик ангела гриб содержит йодоформ и имеет характерный запах.
Приложения
Соединение находит небольшое применение в качестве дезинфицирующего средства.[4][7] Примерно в начале 20 века он использовался в медицине как заживляющая и антисептическая повязка на раны и язвы, хотя в настоящее время это применение вытесняется более совершенными. антисептики. Это активный ингредиент многих порошков для ушей от собаки и кошки, вместе с оксид цинка и пропионовая кислота, которые используются для предотвращения инфекции и облегчения удаления волос в ушах.[нужна цитата ]
Смотрите также
Рекомендации
- ^ «Переднее дело». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 661. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
Сохраненные названия «бромоформ» для ГХБр3, «Хлороформ» для HCCl3и «йодоформ» для HCI3 приемлемы в общей номенклатуре. Предпочтительные названия IUPAC являются замещающими названиями.
- ^ а б c d е ж грамм Записывать в базе данных веществ GESTIS Институт охраны труда и здоровья
- ^ а б c Карманный справочник NIOSH по химической опасности. "#0343". Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б Индекс Merck, 12 издание, 5054
- ^ Суреллас, Жорж-Симон (1822 г.), Примечания о гидриодате калия и гидриодистом кислоте. - Hydriodure de carbone; moyen d'obtenir, à l'instant, ce composé triple [Заметки о гидроиодиде калия и иодистоводородной кислоте - гидроиодиде углерода; средства мгновенного получения этого соединения трех элементов] (на французском языке), Мец, Франция: Antoine, стр. 17–20, 28–29.
- ^ Джеймс, Фрэнк А. Дж. Л. (2004). "Купер, Джон Томас". Оксфордский национальный биографический словарь (онлайн-изд.). Издательство Оксфордского университета. Дои:10.1093 / ссылка: odnb / 39361. Получено 26 января 2012. (Подписка или Членство в публичной библиотеке Великобритании требуется.)
- ^ Лайдей, Филлис А. (2005), «Йод и соединения йода», Энциклопедия промышленной химии Ульмана, Wiley-VCH, Weinheim, стр. 1–13, Дои:10.1002 / 14356007.a14_381.pub2, ISBN 9783527306732
внешняя ссылка
- Карманный справочник NIOSH по химической опасности. "#0343". Национальный институт охраны труда и здоровья (NIOSH).
- Паспорт безопасности материалов в JT Baker
- Метод удельного превращения йодоформа в диоксид углерода
- Подготовка
- . Британская энциклопедия. 14 (11-е изд.). 1911. с. 726.