Стресс репликации ДНК - DNA replication stress - Wikipedia

Стресс репликации ДНК относится к состоянию ячейки, чья геном подвергается различным нагрузкам. События, которые способствуют стрессу репликации, происходят во время Репликация ДНК, и может привести к остановке вилка репликации.[1]
Есть много событий, которые способствуют стрессу репликации, в том числе:[2]
- Неправильное включение рибонуклеотидов
- Необычный Структуры ДНК
- Конфликты между репликацией и транскрипцией
- Недостаточность основных факторов репликации
- Общие хрупкие сайты
- Сверхэкспрессия или конститутивная активация онкогены
- Хроматин недоступность
Банкомат и ATR белки, которые помогают облегчить стресс репликации.[3] В частности, они киназы которые задействуются и активируются повреждением ДНК.[1][4] Остановившаяся репликационная вилка может разрушиться, если эти регуляторные белки не смогут ее стабилизировать.[5] Когда это происходит, начинается повторная сборка вилки, чтобы восстановить поврежденный конец ДНК.[5]
Вилка репликации

Вилка репликации состоит из группы белков, которые влияют на активность репликации ДНК. Чтобы вилка репликации остановилась, клетка должна иметь определенное количество остановленных вилок и длину остановки. Репликационная вилка специально приостанавливается из-за остановки геликаза и полимераза деятельности, которые связаны между собой. В этой ситуации задействован комплекс защиты вилки (FPC), чтобы поддерживать эту связь.[6]
В дополнение к остановке и поддержанию структуры вилки фосфорилирование белка также может создавать сигнальный каскад для перезапуска репликации. Протеин Mrc1, который является частью FPC, передает сигнал контрольной точки, взаимодействуя с киназами по всему каскаду. Когда происходит потеря этих киназ (из-за стресса репликации), образуется избыток оцДНК, который необходим для перезапуска репликации.[7]
Удаление блока репликации
Межцепочечная ДНК перекрестные ссылки (ICL) вызывают стресс репликации, блокируя развитие репликационной вилки. Эта блокировка приводит к нарушению разделения цепей ДНК и остановке репликационной вилки. Восстановление ICL может быть выполнено последовательными разрезами и гомологичная рекомбинация. В клетках позвоночных репликация ICL-содержащих хроматин шаблон запускает набор более 90 Ремонт ДНК и факторы поддержания генома.[8] Анализ белков, задействованных в остановившихся репликационных вилках, выявил специфический набор факторов репарации ДНК, участвующих в реакции репликации на стресс.[8] Было обнаружено, что среди этих белков SLF1 и SLF2 физически связывают SMC5 /6 Белковый комплекс репарации ДНК для RAD18. Комплекс SMC5 / 6 используется в гомологичной рекомбинации, и его связывание с RAD18, вероятно, позволяет рекрутировать SMC5 / 6 в продукты убиквитинирования в сайтах повреждения ДНК.
Ремонт, связанный с репликацией
Механизмы, обрабатывающие поврежденная ДНК в координации с ответственный для поддержания прогрессии репликационной вилки считаются примерами репликационно-связанной репарации. Помимо ремонта Межцепочечные сшивки ДНК Как указано выше, множественные процессы репарации ДНК, действующие в перекрывающихся слоях, могут быть задействованы в дефектных участках в зависимости от природы и места повреждения. Эти процессы ремонта включают (1) удаление неверно включенные базы; (2) удаление неправильно введенных рибонуклеотидов; (3) удаление поврежденных оснований (например, окисленных или метилированных оснований), которые блокируют репликационную полимеразу; (4) удаление перекрестных связей ДНК-белок; и (5) удаление двухцепочечных разрывов.[9] Такие пути репарации могут функционировать для защиты застопорившихся вилок репликации от деградации и позволяют перезапускать сломанные вилки, но при их отсутствии может возникнуть стресс репликации.
Причинно-следственная связь
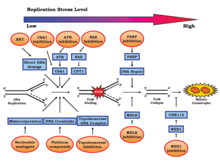
Стресс репликации вызывается различными эндогенными и экзогенными стрессами, которые регулярно вносятся в геном.[10] Эти стрессы включают, но не ограничиваются, Повреждение ДНК, чрезмерное уплотнение хроматин (предотвращение ответственный доступ), чрезмерное выражение онкогены,[11] или трудно воспроизвести геном конструкции.[1][4] Стресс репликации может привести к нестабильность генома, рак, и старение.[12][13] Несогласованные конфликты репликации и транскрипции и незапланированные R-петля накопления вносят значительный вклад.[14]
Конкретные события
События, которые приводят к нестабильности генома, происходят в клеточном цикле до митоз, особенно в Фаза S. Нарушение этой фазы может вызвать негативные эффекты, такие как неточная хромосомная сегрегация, для предстоящей митотической фазы.[10] За повреждение S-фазы отвечают два процесса: онкогенная активация и инактивация опухолевого супрессора. Было показано, что они оба ускоряют переход из фазы G1 в фазу S, что приводит к недостаточному количеству компонентов репликации ДНК. Эти потери могут способствовать Ответ на повреждение ДНК (DDR). Стресс репликации может быть показательной характеристикой канцерогенеза, при котором обычно отсутствуют системы репарации ДНК.[15][16] Физиологически короткая продолжительность фазы G1 также типична для быстро реплицирующихся предшественников во время раннего эмбрионального развития.[17]
Применение при раке
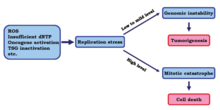
žНормальный стресс репликации возникает на низком или умеренном уровне и вызывает нестабильность генома, что может привести к онкогенезу и прогрессированию рака.[18] «Однако было доказано, что высокий уровень репликационного стресса убивает раковые клетки.
В одном исследовании исследователи стремились определить эффекты индуцирования высоких уровней репликационного стресса на раковые клетки. «Результаты показали, что при дальнейшей потере контрольных точек стресс репликации увеличивается до более высокого уровня. žС этим изменением репликация ДНК раковых клеток может быть неполной или неправильной при входе в митотическую фазу, что в конечном итоге может привести к гибели клеток из-за митотическая катастрофа.[15]
В другом исследовании изучалось, как стресс репликации влияет на активность APOBEC3B. žAPOBEC3 (фермент редактирования мРНК аполипопротеина B, каталитический полипептид-подобный 3), как было замечено, мутирует геном рака при различных типах рака. žРезультаты этого исследования показывают, что ослабление онкогенной передачи сигналов или усиление стресса репликации ДНК может изменить канцерогенный потенциал, и на него можно воздействовать терапевтически.[19]
Рекомендации
- ^ а б c Mazouzi A, Velimezi G, Loizou JI (ноябрь 2014 г.). «Стресс репликации ДНК: причины, разрешение и болезнь». Экспериментальные исследования клеток. 329 (1): 85–93. Дои:10.1016 / j.yexcr.2014.09.030. PMID 25281304.
- ^ Земан М.К., Цимприч К.А. (январь 2014 г.). «Причины и последствия репликационного стресса». Природа клеточной биологии. 16 (1): 2–9. Дои:10.1038 / ncb2897. ЧВК 4354890. PMID 24366029.
- ^ «Реактом | Активация ATR в ответ на репликационный стресс». www.reactome.org. Получено 2017-04-09.
- ^ а б Земан М.К., Цимприч К.А. (январь 2014 г.). «Причины и последствия репликационного стресса». Природа клеточной биологии. 16 (1): 2–9. Дои:10.1038 / ncb2897. ЧВК 4354890. PMID 24366029.
- ^ а б Аллен С., Эшли А.К., Хромас Р., Николофф Дж. А. (февраль 2011 г.). «Больше вилок на пути к восстановлению репликационного стресса». Журнал молекулярной клеточной биологии. 3 (1): 4–12. Дои:10.1093 / jmcb / mjq049. ЧВК 3030971. PMID 21278446.
- ^ «Вилка репликации, комплекс защиты вилки | Изучите науку в Scitable». www.nature.com. Получено 2017-04-09.
- ^ "Вилка репликации ДНК остановилась | Изучите науку в Scitable". www.nature.com. Получено 2017-04-09.
- ^ а б Räschle M, Smeenk G, Hansen RK, Temu T, Oka Y, Hein MY, et al. (Май 2015 г.). «Ремонт ДНК. Протеомика выявляет динамическую сборку репарационных комплексов во время обхода перекрестных связей ДНК». Наука. 348 (6234): 1253671. Дои:10.1126 / science.1253671. ЧВК 5331883. PMID 25931565.
- ^ Cortez D (июнь 2019). «Ремонт ДНК, связанный с репликацией». Молекулярная клетка. 74 (5): 866–876. Дои:10.1016 / j.molcel.2019.04.027. ЧВК 6557297. PMID 31173722.
- ^ а б «Репликационный стресс в клетках млекопитающих и его последствия для митоза (доступна загрузка PDF-файла)». ResearchGate. Получено 2017-02-11.
- ^ Царь, Давид; Ли, Сяо Дунь; Almeida, Gilberto S .; Квок, Колин; Грейвеллс, Полли; Харрисон, Дэниел; Берк, Сирша; Холлсворт, Альберт; Джамин, Янн; Джордж, Салли; Робинсон, Саймон П .; Лорд, Кристофер Дж .; Пун, Эвон; Йомансон, Дэниел; Чеслер, Луи; Брайант, Хелен Э. (24 сентября 2019 г.). «Экспрессия MYCN вызывает стресс репликации и чувствительность к ингибированию PARP в нейробластоме». Oncotarget. 11 (23): 2141–2159. Дои:10.18632 / oncotarget.27329.
- ^ Бурханс В. К., Вайнбергер М. (2007). «Стресс репликации ДНК, нестабильность генома и старение». Исследования нуклеиновых кислот. 35 (22): 7545–56. Дои:10.1093 / NAR / GKM1059. ЧВК 2190710. PMID 18055498.
- ^ Фрагкос М., Наим В. (апрель 2017 г.). «Спасение от репликационного стресса во время митоза». Клеточный цикл. 16 (7): 613–633. Дои:10.1080/15384101.2017.1288322. ЧВК 5397263. PMID 28166452.
- ^ Брамбати А., Колозио А., Зардони Л., Галанти Л., Либери Г. (2015-04-28). «Репликация и транскрипция на пути столкновения: механизмы эукариотической регуляции и последствия для стабильности ДНК». Границы генетики. 6: 166. Дои:10.3389 / fgene.2015.00166. ЧВК 4412130. PMID 25972894.
- ^ а б Чжан Дж., Дай Кью, Пак Д., Дэн Х (август 2016 г.). «Устранение стресса репликации ДНК для лечения рака». Гены. 7 (8): 51. Дои:10.3390 / гены7080051. ЧВК 4999839. PMID 27548226.
- ^ Cescon DW, Haibe-Kains B (сентябрь 2016 г.). «Стресс репликации ДНК: источник экспрессии APOBEC3B при раке груди». Геномная биология. 17 (1): 202. Дои:10.1186 / s13059-016-1069-у. ЧВК 5045630. PMID 27716362.
- ^ Wei JY, Bulkley BH, Schaeffer AH, Greene HL, Reid PR (июль 1978 г.). «Синдром пролапса митрального клапана и рецидивирующие желудочковые тахиаритмии: злокачественный вариант, резистентный к традиционной лекарственной терапии». Анналы внутренней медицины. 89 (1): 6–9. Дои:10.1523 / JNEUROSCI.15-09-06046.1995. PMID 666188.
- ^ Тейлор Э.М., Линдси HD (январь 2016 г.). «Стресс репликации ДНК и рак: причина или лечение?» (PDF). Будущая онкология. 12 (2): 221–37. Дои:10.2217 / fon.15.292. PMID 26616915. S2CID 20261656.
- ^ Кану Н., Сероне М.А., Гох Г., Залмас Л.П., Барткова Дж., Дитцен М. и др. (Сентябрь 2016 г.). «Стресс репликации ДНК опосредует мутагенез семейства APOBEC3 при раке груди». Геномная биология. 17 (1): 185. Дои:10.1186 / s13059-016-1042-9. ЧВК 5025597. PMID 27634334.
