Электронный микроскоп - Electron microscope


An электронный микроскоп это микроскоп который использует луч ускоренного электроны как источник освещения. Поскольку длина волны электрона может быть до 100000 раз короче, чем длина волны видимого света. фотоны, электронные микроскопы имеют более высокую разрешающая способность чем световые микроскопы и может выявить структуру более мелких объектов. А растровый просвечивающий электронный микроскоп достиг более 50вечера разрешение в кольцевое изображение в темном поле Режим[1] и увеличения примерно до 10 000 000 ×, тогда как большинство световые микроскопы ограничены дифракция примерно до 200нм разрешение и полезные увеличения ниже 2000 ×.
Электронные микроскопы используют сформированные магнитные поля для формирования электронно-оптическая линза системы, аналогичные стеклянным линзам оптического светового микроскопа.
Электронные микроскопы используются для исследования ультраструктура широкого спектра биологических и неорганических образцов, включая микроорганизмы, клетки, большой молекулы, биопсия образцы, металлы, и кристаллы. В промышленности электронные микроскопы часто используются для контроля качества и анализ отказов. Современные электронные микроскопы производят электроны. микрофотографии с помощью специализированных цифровых камер и фрейм-грабберы для захвата изображений.
История

В 1926 г. Ганс Буш разработал электромагнитную линзу.
В соответствии с Деннис Габор, физик Лео Сцилард В 1928 году пытался убедить его построить электронный микроскоп, на который он подал патент.[2] Первый прототип электронного микроскопа с четырехсоткратным увеличением был разработан в 1931 году физиком. Эрнст Руска и инженер-электрик Макс Нолл.[3] Аппарат был первой практической демонстрацией принципов электронной микроскопии.[4] В мае того же года Райнхольд Руденберг, научный руководитель Siemens-Schuckertwerke, получил патент на электронный микроскоп. В 1932 году Эрнст Любке из Сименс и Гальске построил и получил изображения с прототипа электронного микроскопа, применяя концепции, описанные в патенте Руденберга.[5]
В следующем, 1933 году, Руска построил первый электронный микроскоп с разрешением, превышающим доступное для оптического (светового) микроскопа.[4] Четыре года спустя, в 1937 году, Сименс профинансировал работу Эрнста Руска и Бодо фон Боррис, и работал Гельмут Руска, Брата Эрнста, для разработки приложений для микроскопа, особенно для биологических образцов.[4][6] Также в 1937 г. Манфред фон Арденн был пионером растровый электронный микроскоп.[7] Сименс выпустил первый коммерческий электронный микроскоп в 1938 году.[8] Первый североамериканский электронный микроскоп был построен в 1938 г. Университет Торонто, к Эли Франклин Бертон и студенты Сесил Холл, Джеймс Хиллер, и Альберт Пребус. Сименс произвел просвечивающий электронный микроскоп (ТЕМ) в 1939 году.[требуется разъяснение ][9] Хотя современные просвечивающие электронные микроскопы способны увеличивать два миллиона в качестве научных инструментов, они по-прежнему основаны на методике Руска. прототип.[нужна цитата ]
Типы
Просвечивающий электронный микроскоп (ПЭМ)
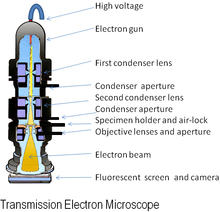
Оригинальный вид электронного микроскопа, просвечивающий электронный микроскоп (ТЕМ), использует высокое напряжение электронный луч для освещения образца и создания изображения. Электронный пучок создается электронная пушка, обычно оснащенный вольфрам нить катод как источник электронов. Электронный пучок ускоряется анод обычно при +100 кэВ (От 40 до 400 кэВ) относительно катода, сфокусированные электростатический и электромагнитный линзы и проходят через образец, который частично прозрачен для электронов, а частично разбрасывает их из луча. Когда он выходит из образца, электронный луч несет информацию о структуре образца, которая увеличивается за счет объектив система микроскопа. Пространственное изменение этой информации («изображение») можно увидеть, проецируя увеличенное электронное изображение на флуоресцентный экран просмотра, покрытый люминофор или же сцинтиллятор материал, такой как сульфид цинка. В качестве альтернативы изображение можно записать фотографическим способом, экспонируя фотопленка или же пластина непосредственно к электронному лучу, либо люминофор высокого разрешения может быть подключен с помощью линзовой оптической системы или оптоволоконный кабель световод к датчику цифровая камера. Изображение, обнаруженное цифровой камерой, может отображаться на мониторе или компьютере.
Разрешение ТЕА ограничено в первую очередь сферическая аберрация, но новое поколение аппаратных корректоров может уменьшить сферическую аберрацию для увеличения разрешения в просвечивающая электронная микроскопия высокого разрешения (HRTEM) ниже 0,5 ангстрем (50 пикометры ),[1] возможность увеличения более 50 миллионов раз.[10] Возможность HRTEM определять положения атомов в материалах полезна для исследований и разработок нанотехнологий.[11]
Просвечивающие электронные микроскопы часто используются в электронная дифракция режим. Преимущества электронной дифракции перед Рентгеновская кристаллография состоят в том, что образец не обязательно должен быть монокристаллом или даже поликристаллическим порошком, а также что реконструкция увеличенной структуры объекта с преобразованием Фурье происходит физически и, таким образом, устраняет необходимость в решении фазовая проблема перед рентгеновскими кристаллографами после получения их дифрактограмм.
Одним из основных недостатков просвечивающего электронного микроскопа является необходимость получения очень тонких срезов образцов, обычно около 100 нанометров. Создание этих шлифов для биологических образцов и образцов материалов технически очень сложно. Тонкие срезы полупроводников могут быть изготовлены с использованием сфокусированный ионный пучок. Образцы биологических тканей химически фиксируются, обезвоживаются и заделываются в полимерную смолу, чтобы стабилизировать их в достаточной степени, чтобы можно было делать ультратонкие срезы. Срезы биологических образцов, органических полимеров и подобных материалов могут потребовать окрашивания метками тяжелых атомов для достижения требуемого контраста изображения.
Последовательная электронная микроскопия (ssEM)
Одним из применений ПЭМ является электронная микроскопия последовательных срезов (ssEM), например, для анализа связности в объемных образцах ткани головного мозга путем последовательной визуализации множества тонких срезов.[12]
Сканирующий электронный микроскоп (СЭМ)
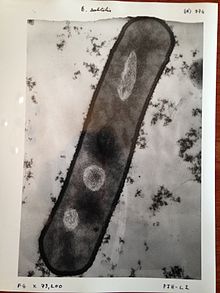
СЭМ создает изображения путем зондирования образца сфокусированным электронным пучком, который сканируется по прямоугольной области образца (растровое сканирование ). Когда электронный луч взаимодействует с образцом, он теряет энергию за счет множества механизмов. Потерянная энергия преобразуется в альтернативные формы, такие как тепло, выбросы низкоэнергетические вторичные электроны и высокоэнергетических обратно рассеянных электронов, светового излучения (катодолюминесценция ) или же рентгеновский снимок излучение, все из которых предоставляют сигналы, несущие информацию о свойствах поверхности образца, таких как его топография и состав. Изображение, отображаемое SEM, отображает изменяющуюся интенсивность любого из этих сигналов в изображение в положении, соответствующем положению луча на образце, когда сигнал был сформирован. На СЭМ-изображении муравья, показанном ниже и справа, изображение было построено из сигналов, произведенных детектором вторичных электронов, нормальным или традиционным режимом визуализации в большинстве СЭМ.
Как правило, разрешение изображения SEM ниже, чем у TEM. Однако, поскольку СЭМ отображает поверхность образца, а не его внутреннюю часть, электроны не должны проходить через образец. Это снижает потребность в обширной пробоподготовке для утончения образца до электронной прозрачности. SEM может отображать объемные образцы, которые могут поместиться на его предметном столике и при этом могут быть перемещены, включая высоту, меньшую, чем используемое рабочее расстояние, часто 4 миллиметра для изображений с высоким разрешением. SEM также имеет большую глубину резкости и поэтому может создавать изображения, которые хорошо отражают трехмерную форму поверхности образца. Еще одно преимущество SEM заключается в сканирующие электронные микроскопы для окружающей среды (ESEM), которые могут создавать изображения хорошего качества и разрешения с гидратированными образцами или в низком, а не высоком вакууме или в газах под камерой. Это облегчает визуализацию незакрепленных биологических образцов, которые нестабильны в высоком вакууме обычных электронных микроскопов.

Отражательный электронный микроскоп (РЭМ)
в отражательный электронный микроскоп (REM), как и в TEM, электронный луч падает на поверхность, но вместо использования передачи (TEM) или вторичных электронов (SEM) отраженный луч упруго рассеянные электроны обнаружен. Этот метод обычно сочетается с отражение высоких энергий дифракция электронов (RHEED) и спектроскопия потерь высоких энергий на отражение (RHELS).[нужна цитата ] Другой вариант - спин-поляризованная электронная микроскопия низких энергий (SPLEEM ), который используется для изучения микроструктуры магнитные домены.[13]
Сканирующий просвечивающий электронный микроскоп (STEM)
STEM растрирует сфокусированный падающий зонд через образец, который (как и в случае с TEM) был утончен, чтобы облегчить обнаружение рассеянных электронов. через образец. Таким образом, в STEM возможно высокое разрешение ПЭМ. Действие фокусировки (и аберрации) происходит до того, как электроны попадают в образец в STEM, но после этого в TEM. Использование SEM-подобного растрирования пучка в STEM упрощает кольцевое изображение в темном поле, и другие аналитические методы, но также означает, что данные изображения собираются последовательно, а не параллельно. Часто ПЭМ может быть оснащен опцией сканирования, и тогда он может работать как ПЭМ, так и STEM.
Сканирующая туннельная микроскопия (СТМ)
В СТМ проводящий наконечник, удерживаемый под напряжением, приближается к поверхности, и профиль может быть получен на основе вероятности туннелирования электрона от наконечника к образцу, поскольку это функция расстояния.
Цвет
В своих наиболее распространенных конфигурациях электронные микроскопы создают изображения с одним значением яркости на пиксель, при этом результаты обычно отображаются в оттенки серого.[14] Однако часто эти изображения затем окрашиваются с помощью программного обеспечения для обнаружения признаков или просто путем ручного редактирования с использованием графического редактора. Это может быть сделано для уточнения структуры или для эстетического эффекта и обычно не добавляет новой информации об образце.[15]
В некоторых конфигурациях информация о нескольких свойствах образца собирается на пиксель, обычно с помощью нескольких детекторов.[16] В SEM атрибуты топографии и контраста материала могут быть получены с помощью пары детекторов обратно рассеянных электронов, и такие атрибуты могут быть наложены на одноцветное изображение путем присвоения разного основного цвета каждому атрибуту.[17] Точно так же комбинацию сигналов обратно рассеянных и вторичных электронов можно присвоить разным цветам и наложить на одноцветную микрофотографию, отображающую одновременно свойства образца.[18]
Некоторые типы детекторов, используемые в SEM, обладают аналитическими возможностями и могут предоставлять несколько элементов данных для каждого пикселя. Примерами являются Энергодисперсионная рентгеновская спектроскопия (EDS) детекторы, используемые в элементном анализе и Катодолюминесцентный микроскоп (CL) системы, анализирующие интенсивность и спектр электронно-индуцированных свечение в (например) геологических образцах. В системах SEM, использующих эти детекторы, принято кодировать сигналы цветом и накладывать их на одноцветное изображение, чтобы можно было четко увидеть и сравнить различия в распределении различных компонентов образца. Необязательно, стандартное вторичное электронное изображение может быть объединено с одним или несколькими композиционными каналами, чтобы можно было сравнить структуру и состав образца. Такие изображения могут быть созданы с сохранением полной целостности исходного сигнала, который никак не изменяется.
Базовые приготовления

Материалы, которые будут рассматриваться под электронным микроскопом, могут потребовать обработки для получения подходящего образца. Требуемый метод варьируется в зависимости от образца и требуемого анализа:
- Химическая фиксация - для биологических образцов направлена на стабилизацию подвижной макромолекулярной структуры образца путем химического сшивания белки с альдегиды Такие как формальдегид и глутаральдегид, и липиды с четырехокись осмия.
- Отрицательное пятно - суспензии, содержащие наночастицы или тонкий биологический материал (например, вирусы и бактерии), кратковременно смешивают с разбавленным раствором электронно-непрозрачного раствора, такого как молибдат аммония, уранилацетат (или формиат) или фосфорновольфрамовая кислота. Эту смесь наносят на ЭМ сетку с соответствующим покрытием, промокают, затем дают высохнуть. Для достижения наилучших результатов просмотр этого препарата в ТЕА следует проводить незамедлительно. Этот метод важен в микробиологии для быстрой, но грубой морфологической идентификации, но также может использоваться в качестве основы для трехмерной реконструкции с высоким разрешением с использованием методологии ЭМ томографии, когда углеродные пленки используются для поддержки. Отрицательное окрашивание также используется для наблюдения за наночастицами.
- Криофиксация - быстрое замораживание образца в жидкости этан что вода образует стекловидный (некристаллический) лед. Это сохраняет образец в виде снимка состояния раствора. Целое поле под названием криоэлектронная микроскопия отошла от этой техники. С развитием криоэлектронная микроскопия стекловидного тела (CEMOVIS) теперь можно наблюдать образцы практически любого биологического образца, близкого к его естественному состоянию.[нужна цитата ]
- Обезвоживание - или замена воды с органическими растворителями, такими как этиловый спирт или же ацетон, с последующим критическая точка сушки или проникновение с заливкой смолы. Также сублимационной сушки.
- Встраивание биологических образцов - после обезвоживания ткань для наблюдения в просвечивающем электронном микроскопе заделывается так, чтобы ее можно было разделить и подготовить для просмотра. Для этого ткань пропускается через «переходный растворитель», такой как оксид пропилена (эпоксипропан) или ацетон а затем проникли эпоксидная смола смола Такие как Аралдит, Эпон или Дуркупан;[19] ткани также могут быть погружены непосредственно в смешивающиеся с водой акриловая смола. После полимеризации (затвердевания) смолы образец делится на тонкие (ультратонкие) срезы и окрашенный - тогда он готов к просмотру.
- Вшивка, материалы - после заливки в смолу образец обычно шлифуется и полируется до зеркального блеска с использованием ультратонких абразивов. Процесс полировки должен выполняться осторожно, чтобы минимизировать царапины и другие артефакты полировки, снижающие качество изображения.
- Затенение металла - Металл (например, платина ) испаряется с верхнего электрода и наносится на поверхность биологического образца под углом.[20] Топография поверхности приводит к вариациям толщины металла, которые видны как вариации яркости и контраста на изображении, полученном с помощью электронного микроскопа.
- Репликация - Поверхность, затененная металлом (например, платиной или смесью углерода и платины) под углом, покрывается чистым углеродом, испаренным с угольных электродов под прямым углом к поверхности. За этим следует удаление материала образца (например, в кислотной ванне, с использованием ферментов или механическим разделением.[21]) для создания копии поверхности, которая регистрирует ультраструктуру поверхности и может быть исследована с помощью просвечивающей электронной микроскопии.
- Разделение - производит тонкие срезы образца, полупрозрачные для электронов. Их можно разрезать на ультрамикротом со стаканом или алмаз нож для получения ультратонких срезов толщиной около 60–90 нм. Одноразовый стеклянные ножи также используются, потому что они могут быть изготовлены в лаборатории и намного дешевле.
- Окрашивание - использует тяжелые металлы, такие как вести, уран или же вольфрам для рассеивания отображаемых электронов и создания контраста между различными структурами, поскольку многие (особенно биологические) материалы почти «прозрачны» для электронов (объекты со слабой фазой). В биологии образцы можно окрашивать «единым блоком» перед заделкой, а также позже после разделения на срезы. Обычно тонкие срезы окрашивают в течение нескольких минут водным или спиртовым раствором уранилацетат затем следует водный раствор цитрата свинца.[22]
- Замораживание-перелом или замораживание-травление - способ приготовления[23][24][25] особенно полезен для исследования липидных мембран и включенных в них белков «лицом к лицу».[26][27][28]
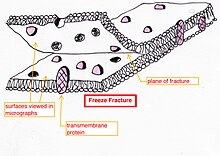 Замораживание-разрушение помогает отслаивать открытые мембраны, позволяя визуализировать то, что находится внутриСвежая ткань или клеточная суспензия быстро замораживается (криофиксация), затем разрушается путем разрушения.[29] (или с помощью микротома)[28] при температуре жидкого азота. Поверхность с холодными трещинами (иногда «травится» повышением температуры примерно до -100 ° C на несколько минут, чтобы дать льду возвыситься)[28] затем затеняется испаренной платиной или золотом под средним углом 45 ° в испарителе высокого вакуума. Второй слой углерода, напыляемый перпендикулярно средней плоскости поверхности, часто выполняется для повышения стабильности покрытия-реплики. Образец возвращается к комнатной температуре и давлению, затем чрезвычайно хрупкая «предварительно затененная» металлическая копия поверхности трещины отделяется от лежащего под ним биологического материала путем осторожного химического разложения с кислотами. гипохлорит решение или SDS моющее средство. Все еще плавающую копию тщательно промывают от остаточных химикатов, аккуратно вылавливают на мелкой сетке, сушат, а затем просматривают в ПЭМ.
Замораживание-разрушение помогает отслаивать открытые мембраны, позволяя визуализировать то, что находится внутриСвежая ткань или клеточная суспензия быстро замораживается (криофиксация), затем разрушается путем разрушения.[29] (или с помощью микротома)[28] при температуре жидкого азота. Поверхность с холодными трещинами (иногда «травится» повышением температуры примерно до -100 ° C на несколько минут, чтобы дать льду возвыситься)[28] затем затеняется испаренной платиной или золотом под средним углом 45 ° в испарителе высокого вакуума. Второй слой углерода, напыляемый перпендикулярно средней плоскости поверхности, часто выполняется для повышения стабильности покрытия-реплики. Образец возвращается к комнатной температуре и давлению, затем чрезвычайно хрупкая «предварительно затененная» металлическая копия поверхности трещины отделяется от лежащего под ним биологического материала путем осторожного химического разложения с кислотами. гипохлорит решение или SDS моющее средство. Все еще плавающую копию тщательно промывают от остаточных химикатов, аккуратно вылавливают на мелкой сетке, сушат, а затем просматривают в ПЭМ.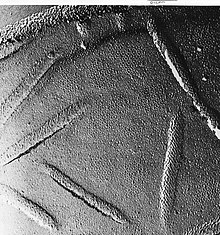 На внешней стороне мембраны пекарских дрожжей видны небольшие отверстия, в которых белки выламываются, иногда в виде небольших кольцевых структур.
На внешней стороне мембраны пекарских дрожжей видны небольшие отверстия, в которых белки выламываются, иногда в виде небольших кольцевых структур. - Иммунозолото-мечение реплик замораживания-перелома (FRIL) - метод замораживания-перелома был модифицирован, чтобы можно было идентифицировать компоненты поверхности перелома по маркировке иммунным золотом. Вместо удаления всей подлежащей ткани размороженной копии в качестве последнего шага перед просмотром в микроскоп, толщина ткани минимизируется во время или после процесса перелома. Тонкий слой ткани остается связанным с металлическим аналогом, поэтому он может быть помечен иммунным золотом с помощью антител к выбранным структурам. Тонкий слой исходного образца на реплике с прикрепленным золотом позволяет идентифицировать структуры в плоскости излома.[30] Существуют также связанные методы, которые маркируют поверхность протравленных клеток.[31] и другие варианты маркировки реплик.[32]
- Ионно-лучевое фрезерование - разбавляет образцы до прозрачности для электронов путем обжига ионы (обычно аргон ) на поверхности под углом и разбрызгивание материала с поверхности. Подклассом этого является сфокусированный ионный пучок фрезерование, где галлий ионы используются для создания электронно-прозрачной мембраны в определенной области образца, например, с помощью устройства внутри микропроцессора. Ионно-лучевое фрезерование также может использоваться для полировки поперечного сечения перед анализом материалов, которые трудно приготовить с помощью механической полировки, перед анализом на сканирующем электронном микроскопе.
- Проводящее покрытие - ультратонкое покрытие из электропроводящего материала, нанесенное методом напыления в высоком вакууме или напылением образца в низком вакууме. Это сделано для предотвращения накопления статических электрических полей на образце из-за облучения электронами, необходимого во время визуализации. Материалы покрытия включают золото, золото / палладий, платину, вольфрам, графит и т. Д.
- Заземление - чтобы избежать накопления электрического заряда на образце с токопроводящим покрытием, он обычно электрически соединен с металлическим держателем образца. Часто электропроводящий клей используется для этой цели.
Недостатки

Электронные микроскопы дороги в изготовлении и обслуживании, но капитальные и эксплуатационные расходы конфокальный световой микроскоп системы теперь частично совпадают с таковыми из основных электронных микроскопов. Микроскопы, предназначенные для достижения высоких разрешений, должны размещаться в устойчивых зданиях (иногда под землей) со специальными услугами, такими как системы подавления магнитного поля.
Образцы в основном необходимо просматривать в вакуум, поскольку молекулы воздуха будут рассеивать электроны. Исключением является жидкофазная электронная микроскопия [33] используя либо закрытую жидкостную ячейку, либо камеру окружающей среды, например, в сканирующий электронный микроскоп для окружающей среды, что позволяет просматривать гидратированные образцы при низком давлении (до 20Торр или 2,7 кПа) во влажной среде. Различные техники для электронная микроскопия in situ газовых образцов.[34]
Сканирующие электронные микроскопы, работающие в обычном режиме высокого вакуума, обычно позволяют получать изображения проводящих образцов; поэтому для непроводящих материалов требуется проводящее покрытие (сплав золото / палладий, углерод, осмий и т. д.). Низковольтный режим современных микроскопов позволяет наблюдать непроводящие образцы без покрытия. Непроводящие материалы можно также визуализировать с помощью растрового электронного микроскопа с переменным давлением (или окружающей среды).
Небольшие стабильные образцы, такие как углеродные нанотрубки, диатомовые водоросли панцири и мелкие минеральные кристаллы (например, волокна асбеста) не требуют специальной обработки перед исследованием в электронный микроскоп. Образцы гидратированных материалов, включая почти все биологические образцы, должны быть приготовлены различными способами, чтобы стабилизировать их, уменьшить их толщину (ультратонкие срезы) и повысить их электронно-оптический контраст (окрашивание). Эти процессы могут привести к артефакты, но их обычно можно идентифицировать, сравнивая результаты, полученные с использованием совершенно разных методов подготовки образцов. С 1980-х гг. Анализ криофиксированный, остеклованные образцы также все чаще используются учеными, что еще раз подтверждает обоснованность этого метода.[35][36][37]
Приложения
Биология и науки о жизни
|
|
Смотрите также
- Акронимы в микроскопии
- Электронная дифракция
- Спектроскопия потерь энергии электронов (УГРЕЙ)
- Электронно-микроскопические изображения
- Просвечивающая электронная микроскопия с энергетическим фильтром (EFTEM)
- Сканирующий электронный микроскоп для окружающей среды (ESEM)
- Автоэмиссионный микроскоп
- HiRISE
- Иммунная электронная микроскопия
- Электронная микроскопия in situ
- Обработка изображений с микроскопа
- Микроскопия
- Нанонаука
- Нанотехнологии
- Нейтронный микроскоп
- Квантовая микроскопия
- Сканирующая конфокальная электронная микроскопия
- Растровый электронный микроскоп (SEM)
- Сканирующий туннельный микроскоп
- Наука о поверхности
- Просвечивающий электронный микроскоп с коррекцией аберрации
- дифракция рентгеновских лучей
- Рентгеновский микроскоп
- Электронная микроскопия низких энергий
- Полусферический анализатор энергии электронов
Рекомендации
- ^ а б Эрни, Рольф; Росселл, доктор медицины; Киселёвский, C; Дахмен, У (2009). "Получение изображений с атомным разрешением с помощью электронного зонда с диаметром менее 50 мкм". Письма с физическими проверками. 102 (9): 096101. Bibcode:2009PhRvL.102i6101E. Дои:10.1103 / PhysRevLett.102.096101. PMID 19392535.
- ^ Даннен, Джин (1998) Лео Сцилард - Изобретатель: Слайд-шоу (1998, Будапешт, доклад на конференции). dannen.com
- ^ Матис, Даниэль, Zentrum für Mikroskopie, Базельский университет: Die Entwicklung der Elektronenmikroskopie vom Bild über die Analyze zum Nanolabor, п. 8
- ^ а б c Руска, Эрнст (1986). "Автобиография Эрнста Руска". Нобелевский фонд. Получено 2010-01-31.
- ^ Руденберг, Х. Гюнтер; Руденберг, Пол Г. (2010). «Происхождение и история изобретения электронного микроскопа». Достижения в области визуализации и электронной физики. 160. С. 207–286. Дои:10.1016 / S1076-5670 (10) 60006-7. ISBN 978-0-12-381017-5.
- ^ Крюгер, DH; Schneck, P; Гелдерблом, HR (май 2000 г.). «Гельмут Руска и визуализация вирусов». Ланцет. 355 (9216): 1713–1717. Дои:10.1016 / S0140-6736 (00) 02250-9. PMID 10905259. S2CID 12347337.
- ^ Арденн, М. Фон; Бейшер, Д. (1940). "Untersuchung von Metalloxyd-Rauchen mit dem Universal-Elektronenmikroskop" [Исследование курения оксидов металлов на универсальном электронном микроскопе]. Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie (на немецком). 46 (4): 270–277. Дои:10.1002 / bbpc.19400460406 (неактивно 10.11.2020).CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
- ^ История электронной микроскопии, 1931–2000 гг.. Authors.library.caltech.edu (2002-12-10). Проверено 29 апреля 2017.
- ^ "Джеймс Хиллер". Изобретатель недели: Архив. 2003-05-01. Архивировано из оригинал на 2003-08-23. Получено 2010-01-31.
- ^ «Масштаб вещей». Управление фундаментальных энергетических наук Министерства энергетики США. 2006-05-26. Архивировано из оригинал на 2010-02-01. Получено 2010-01-31.
- ^ О'Киф, Массачусетс; Аллард Л.Ф. (18 января 2004 г.). «Электронная микроскопия Суб-Ангстрема для нано-метрологии Суб-Ангстрема» (PDF). Информационный мост: Научно-техническая информация Министерства энергетики - при поддержке OSTI. Цитировать журнал требует
| журнал =(помощь) - ^ Ю, Инван, Дэвид Г.К. Хильдебранд, Уилли Ф. Тобин, Вей-Чунг, Аллен Ли и Вон-Ки Чон. "ssEMnet: Регистрация изображений электронной микроскопии последовательного раздела с использованием сети пространственного преобразователя с изученными функциями" В глубоком обучении в области анализа медицинских изображений и мультимодального обучения для поддержки принятия клинических решений, стр. 249-257. Спрингер, Чам, 2017.
- ^ "СПЛИМ". Национальный центр электронной микроскопии (NCEM). Архивировано из оригинал на 2010-05-29. Получено 2010-01-31.
- ^ Берджесс, Джереми (1987). Под микроскопом: раскрытие скрытого мира. CUP Архив. п. 11. ISBN 978-0-521-39940-1.
- ^ «Введение в электронную микроскопию» (PDF). Компания FEI. п. 15. Получено 12 декабря 2012.
- ^ Антоновский, А. (1984). «Применение цвета к полуобращению для увеличения четкости». Micron и Microscopica Acta. 15 (2): 77–84. Дои:10.1016/0739-6260(84)90005-4.
- ^ Данилатос, Г.Д. (1986). «Цветные микрофотографии для сигналов обратно рассеянных электронов в SEM». Сканирование. 9 (3): 8–18. Дои:10.1111 / j.1365-2818.1986.tb04287.x. S2CID 96315383.
- ^ Данилатос, Г.Д. (1986). «Экологическая растровая электронная микроскопия в цвете». Журнал микроскопии. 142: 317–325. Дои:10.1002 / sca.4950080104.
- ^ Люфт, Дж. (1961). «Улучшение методов заливки эпоксидной смолой». Журнал биофизической и биохимической цитологии. 9 (2). п. 409. ЧВК 2224998. PMID 13764136.
- ^ Williams, R.C .; Вайкофф, Р. У. (1945-06-08). «Электронно-теневая микрография белка вируса табачной мозаики». Наука. 101 (2632): 594–596. Bibcode:1945Sci ... 101..594W. Дои:10.1126 / science.101.2632.594. PMID 17739444. S2CID 44930705.
- ^ Juniper, B.E .; Брэдли, Д. (1958). «Техника углеродных реплик в исследовании ультраструктуры поверхности листьев». Журнал исследований ультраструктуры. 2 (1): 16–27. Дои:10.1016 / с0022-5320 (58) 90045-5.
- ^ Рейнольдс, Э. С. (1963). «Использование цитрата свинца при высоком pH в качестве электронно-непрозрачного красителя в электронной микроскопии». Журнал клеточной биологии. 17: 208–212. Дои:10.1083 / jcb.17.1.208. ЧВК 2106263. PMID 13986422.
- ^ Мериман Х. и Кафиг Э. (1955). Изучение замороженных образцов, кристаллов льда и роста кристаллов льда с помощью электронной микроскопии. Naval Med. Res. Ints. Отчет НМ 000 018.01.09 Об. 13 стр. 529–544
- ^ Стир, Рассел Л. (1957-01-25). «Электронная микроскопия структурных деталей в замороженных биологических образцах». Журнал биофизической и биохимической цитологии. 3 (1): 45–60. Дои:10.1083 / jcb.3.1.45. ЧВК 2224015. PMID 13416310.
- ^ Isailović, Tanja M .; Тодосиевич, Мария Н .; Orević, Sanela M .; Савич, Снежана Д. (01.01.2017), Чалия, Боян (ред.), «Глава 7 - Микро / наноэмульсионные системы на основе природных поверхностно-активных веществ для НПВС - практический подход к составлению, физико-химические и биофармацевтические характеристики / характеристики», Микроразмерные и наноразмерные носители для нестероидных противовоспалительных препаратов, Бостон: Academic Press, стр. 179–217, Дои:10.1016 / b978-0-12-804017-1.00007-8, ISBN 978-0-12-804017-1, получено 2020-10-22
- ^ Моор Х., Мюлетхалер К. (1963). «Тонкая структура замороженных травленых дрожжевых клеток». Журнал клеточной биологии. 17 (3): 609–628. Дои:10.1083 / jcb.17.3.609. ЧВК 2106217. PMID 19866628.
- ^ Блэк, Джоэл А. (1990-01-01), Конн, П. Майкл (редактор), «[20] - Использование Freeze-Fracture в нейробиологии», Методы в неврологии, Количественная и качественная микроскопия, Academic Press, 3, стр. 343–360, Дои:10.1016 / b978-0-12-185255-9.50025-0, получено 2020-10-22
- ^ а б c Стиллвелл, Уильям (2016-01-01), Стиллвелл, Уильям (редактор), «Глава 11 - Свойства мембраны на больших расстояниях», Введение в биологические мембраны (второе издание), Elsevier, стр. 221–245, Дои:10.1016 / b978-0-444-63772-7.00011-7, ISBN 978-0-444-63772-7, получено 2020-10-22
- ^ Булливант, Стэнли; Эймс, Адельберт (1966-06-01). «Простой метод репликации замораживания-разрушения для электронной микроскопии». Журнал клеточной биологии. 29 (3): 435–447. Дои:10.1083 / jcb.29.3.435. ЧВК 2106967. PMID 5962938.
- ^ Gruijters, W. T .; Кистлер, Дж; Булливант, S; Гуденаф, Д. А. (1987-03-01). «Иммунолокализация MP70 в межклеточных соединениях линзового волокна 16-17 нм». Журнал клеточной биологии. 104 (3): 565–572. Дои:10.1083 / jcb.104.3.565. ЧВК 2114558. PMID 3818793.
- ^ да Силва, Педро Пинту; Брэнтон, Дэниел (1970-06-01). «Расщепление мембраны при замораживании-травлении». Журнал клеточной биологии. 45 (3): 598–605. Дои:10.1083 / jcb.45.3.598. ЧВК 2107921. PMID 4918216.
- ^ Rash, J. E .; Johnson, T. J .; Hudson, C. S .; Giddings, F.D .; Graham, W. F .; Эльдефрави, М. Э. (1 ноября 1982 г.). «Методы реплик с метками: пост-теневое мечение внутримембранных частиц в репликах замораживания-разрушения». Журнал микроскопии. 128 (Пт 2): 121–138. Дои:10.1111 / j.1365-2818.1982.tb00444.x. PMID 6184475. S2CID 45238172.
- ^ de Jonge, N .; Росс, Ф. (2011). «Электронная микроскопия образцов в жидкости». Природа Нанотехнологии. 6 (8): 695–704. Bibcode:2003 НатМа ... 2..532 Вт. Дои:10.1038 / nmat944. PMID 12872162. S2CID 21379512.
- ^ Gai, P.L .; Бойс, Э. (2009). «Достижения в области атомной разрешающей способности просвечивающей электронной микроскопии окружающей среды in situ и электронной микроскопии in situ с коррекцией аберрации 1A». Microsc Res Tech. 72 (3): 153–164. arXiv:1705.05754. Дои:10.1002 / jemt.20668. PMID 19140163. S2CID 1746538.
- ^ Адриан, Марк; Дюбоше, Жак; Лепо, Жан; Макдауэл, Аласдер У. (1984). «Криоэлектронная микроскопия вирусов». Природа (Представлена рукопись). 308 (5954): 32–36. Bibcode:1984Натура 308 ... 32А. Дои:10.1038 / 308032a0. PMID 6322001. S2CID 4319199.
- ^ Sabanay, I .; Arad, T .; Weiner, S .; Гейгер, Б. (1991). «Исследование застеклованных, неокрашенных замороженных срезов тканей с помощью криоиммуноэлектронной микроскопии». Журнал клеточной науки. 100 (1): 227–236. PMID 1795028.
- ^ Kasas, S .; Dumas, G .; Dietler, G .; Catsicas, S .; Адриан, М. (2003). «Стеклование образцов криоэлектронной микроскопии, выявленных с помощью высокоскоростной фотографической визуализации». Журнал микроскопии. 211 (1): 48–53. Дои:10.1046 / j.1365-2818.2003.01193.x. PMID 12839550. S2CID 40058086.
- ^ Boehme, L .; Бресин, М .; Botman, A .; Ranney, J .; Гастингс, Дж. (2015). «Травление меди в растворах серной кислоты, индуцированное сфокусированным электронным пучком». Нанотехнологии. 26 (49): 495301. Bibcode:2015Nanot..26W5301B. Дои:10.1088/0957-4484/26/49/495301. PMID 26567988.
- ^ Kacher, J .; Cui, B .; Робертсон, И.М. (2015). «In situ и томографическая характеристика процессов повреждения и дислокации в облученных металлических сплавах с помощью просвечивающей электронной микроскопии». Журнал материаловедения. 30 (9): 1202–1213. Bibcode:2015JMatR..30.1202K. Дои:10.1557 / jmr.2015.14.
- ^ Rai, R.S .; Субраманиан, С. (2009). «Роль просвечивающей электронной микроскопии в полупроводниковой промышленности для разработки процессов и анализа отказов». Прогресс в выращивании кристаллов и изучении материалов. 55 (3–4): 63–97. Дои:10.1016 / j.pcrysgrow.2009.09.002.
- ^ Моррис, G.J .; Goodrich, M .; Acton, E .; Фонсека, Ф. (2006). «Высокая вязкость, возникающая при замораживании в растворах глицерина: влияние на криоконсервацию». Криобиология. 52 (3): 323–334. Дои:10.1016 / j.cryobiol.2006.01.003. PMID 16499898.
- ^ а б фон Аппен, Александр; Бек, Мартин (май 2016 г.). «Определение структуры ядерного порового комплекса с помощью трехмерной криоэлектронной микроскопии». Журнал молекулярной биологии. 428 (10): 2001–10. Дои:10.1016 / j.jmb.2016.01.004. ЧВК 4898182. PMID 26791760.
- ^ Флориан, П.Е .; Rouillé, Y .; Ruta, S .; Nichita, N .; Розеану, А. (2016). «Последние достижения в исследованиях визуализации вирусов человека». Журнал базовой микробиологии. 56 (6): 591–607. Дои:10.1002 / jobm.201500575. PMID 27059598. S2CID 12737742.
- ^ а б Cushnie, T.P .; O’Driscoll, N.H .; Лэмб, А.Дж. (2016). «Морфологические и ультраструктурные изменения бактериальных клеток как индикатор антибактериального механизма действия». Клеточные и молекулярные науки о жизни. 73 (23): 4471–4492. Дои:10.1007 / s00018-016-2302-2. HDL:10059/2129. PMID 27392605. S2CID 2065821.
- ^ Li, M.-H .; Yang, Y.-Q .; Хуанг, Б .; Луо, X .; Zhang, W .; Han, M .; Ру, Ж.-Г. (2014). «Развитие современной электронной томографии в материаловедении на основе ПЭМ и СТЭМ». Сделки Общества цветных металлов Китая. 24 (10): 3031–3050. Дои:10.1016 / S1003-6326 (14) 63441-5.
- ^ Li, W.J .; Shao, L.Y .; Zhang, D.Z .; Ro, C.U .; Hu, M .; Bi, X.H .; Geng, H .; Мацуки, А .; Niu, H.Y .; Чен, Дж. М. (2016). «Обзор исследований одиночных аэрозольных частиц в атмосфере Восточной Азии: морфология, состояние смешения, источник и гетерогенные реакции». Журнал чистого производства. 112 (2): 1330–1349. Дои:10.1016 / j.jclepro.2015.04.050.
- ^ Sousa, R.G .; Эстевес, Т .; Rocha, S .; Фигейредо, Ф .; Quelhas, P .; Сильва, Л.М. (2015). Автоматическое обнаружение частиц иммунного золота по изображениям, полученным с помощью электронной микроскопии.. Анализ и распознавание изображений. Конспект лекций по информатике. 9164. С. 377–384. Дои:10.1007/978-3-319-20801-5_41. ISBN 978-3-319-20800-8.
- ^ Перкинс, Г.А. (2014). «Использование miniSOG в локализации митохондриальных белков». Митохондриальная функция. Методы в энзимологии. 547. С. 165–179. Дои:10.1016 / B978-0-12-801415-8.00010-2. ISBN 9780128014158. PMID 25416358.
- ^ Чен, X.D .; Ren, L.Q .; Zheng, B .; Лю, Х. (2013). «Физические и технические аспекты систем визуализации клеток и тканей: микроскопические устройства и компьютерная диагностика». Биофотоника в патологии: патология на перепутье. 185 (Биофотоника в патологии): 1–22. Дои:10.3233/978-1-61499-234-9-1. PMID 23542929.
- ^ Fagerland, J.A .; Wall, H.G .; Pandher, K .; LeRoy, B.E .; Ганье, Г.Д. (2012). «Ультраструктурный анализ в доклинической оценке безопасности». Токсикологическая патология. 40 (2): 391–402. Дои:10.1177/0192623311430239. PMID 22215513. S2CID 206458999.
- ^ Heider, S .; Мецнер, К. (2014). «Количественный анализ отдельных частиц вирионов в реальном времени». Вирусология. 462–463: 199–206. Дои:10.1016 / j.virol.2014.06.005. ЧВК 4139191. PMID 24999044.
- ^ Tsekouras, G .; Mozer, A.J .; Уоллес, Г. (2008). «Повышенная эффективность сенсибилизированных красителями солнечных элементов с использованием платиновых противоэлектродов». Журнал Электрохимического общества. 155 (7): K124 – K128. Bibcode:2008JELS..155K.124T. Дои:10.1149/1.2919107.
- ^ Besenius, P .; Portale, G .; Bomans, P.H.H .; Janssen, H.M .; Palmans, A.R.A .; Мейер, Э.В. (2010). «Контроль роста и формы хиральных супрамолекулярных полимеров в воде». Труды Национальной академии наук Соединенных Штатов Америки. 107 (42): 17888–17893. Bibcode:2010PNAS..10717888B. Дои:10.1073 / pnas.1009592107. ЧВК 2964246. PMID 20921365.
- ^ Фуруя, К. (2008). «Нанофабрикация с помощью современной электронной микроскопии с использованием интенсивного сфокусированного луча». Наука и технология перспективных материалов. 9 (1): Статья 014110. Bibcode:2008STAdM ... 9a4110F. Дои:10.1088/1468-6996/9/1/014110. ЧВК 5099805. PMID 27877936.
- ^ Косасих, Феликс Утама; Ducati, Катерина (Май 2018). «Описание деградации перовскитных солнечных элементов с помощью электронной микроскопии in-situ и оперативной электронной микроскопии». Нано Энергия. 47: 243–256. Дои:10.1016 / j.nanoen.2018.02.055.
- ^ Малой, Стюарт А .; Соммер, Уолтер Ф .; Джеймс, Майкл Р .; Ромеро, Тобиас Дж .; Лопес, Мануэль Р .; Циммерманн, Евгений; Ледбеттер, Джеймс М. (13 мая 2017 г.). «Программа испытаний тритиевых материалов по производству ускорителей». Ядерные технологии. 132 (1): 103–114. Дои:10.13182 / nt00-a3132. S2CID 94639273.
- ^ Украинцев, Владимир (27 февраля 2012 г.). «Обзор эталонной метрологии для нанотехнологий: значение, проблемы и решения». Журнал микро / нанолитографии, MEMS и MOEMS. 11 (1): 011010. Дои:10.1117 / 1.JMM.11.1.011010.
- ^ Wilhelmi, O .; Roussel, L .; Faber, P .; Reyntjens, S .; Даниэль, Г. (июнь 2010 г.). «Изготовление сфокусированным ионным пучком больших и сложных наноструктур». Журнал экспериментальной нанонауки. 5 (3): 244–250. Bibcode:2010JENan ... 5..244W. Дои:10.1080/17458080903487448. S2CID 283449.
- ^ Vogt, E.T.C .; Whiting, G.T .; Чоудхури, AD; Weckhuysen, B.M. (2015). Цеолиты и зеотипы для переработки нефти и газа. Достижения в катализе. 58. С. 143–314. Дои:10.1016 / bs.acat.2015.10.001. ISBN 9780128021262.
- ^ Лай, Ши-Эн; Хун, Инь-Джан; Чен, Ю-Тин; Кан, Ю-Тин; Чанг, Пин; Тис, Три-Рунг (18 сентября 2015 г.). "Прямая запись наноструктур Cu электронным лучом". Микроскопия и микроанализ. 21 (6): 1639–43. Bibcode:2015MiMic..21.1639L. Дои:10.1017 / S1431927615015111. PMID 26381450.
- ^ Сичиньяно, Анджело; Ди Монако, Росселла; Маси, Паоло; Кавелла, Сильвана (октябрь 2015 г.). «От сырья к блюду: шаг за шагом качество макаронных изделий». Журнал продовольственной науки и сельского хозяйства. 95 (13): 2579–87. Дои:10.1002 / jsfa.7176. PMID 25783568.
- ^ Брокек-Муха, Зузанна (2014). "Сканирующая электронная микроскопия и рентгеновский микроанализ для химико-морфологических характеристик неорганического компонента огнестрельного остатка: избранные проблемы". BioMed Research International. 2014: 428038. Дои:10.1155/2014/428038. ЧВК 4082842. PMID 25025050.
- ^ Карбонель-Верду, А .; Garcia-Sanoguera, D .; Jorda-Vilaplana, A .; Sanchez-Nacher, L .; Баларт, Р. (2016). «Новый пластификатор для поли (винилхлорида) на основе эпоксидированного хлопкового масла» на биологической основе ». Журнал прикладной науки о полимерах. 33 (27): 43642. Дои:10.1002 / app.43642. HDL:10251/82834.
- ^ Дин, Джи; Чжан, Чжиминг (1 мая 2015 г.). «Микрохарактеристика сварного соединения разнородных металлов для соединения патрубка-патрубка с безопасным концом на АЭС III поколения». Acta Metall Sin. 51 (4): 425–39. Дои:10.11900/0412.1961.2014.00299 (неактивно 10.11.2020).CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
- ^ Цикоурас, Базилиос; Пе-Пайпер, Джорджия; Пайпер, Дэвид ДжВ .; Шаффер, Майкл (июнь 2011 г.). «Сортовой анализ тяжелых минералов происхождения отложений, нижний мел Скотинский бассейн, восточная Канада». Осадочная геология. 237 (3–4): 150–165. Bibcode:2011SedG..237..150T. Дои:10.1016 / j.sedgeo.2011.02.011.
- ^ Ли, Сян; Цзян, Чуань; Пан, Лили; Чжан, Хаоян; Ху, Ланг; Ли, Тяньсюэ; Ян, Синхао (15 июля 2014 г.). «Влияние методов приготовления и старения на поведение растворения твердых дисперсий NF / Soluplus / Kollidon SR: идентификация и классификация с помощью комбинированного анализа с помощью ИК-Фурье спектроскопии и вычислительных подходов». Разработка лекарств и промышленная аптека. 41 (1): 2–14. Дои:10.3109/03639045.2014.938080. PMID 25026247. S2CID 32460608.
внешняя ссылка
| Библиотечные ресурсы о Электронная микроскопия |
- Введение в электронную микроскопию: ресурсы для учителей и студентов
- Клеточно-центрированная база данных - данные электронной микроскопии
- Научное пособие: электронная микроскопия: ресурс средней школы (GCSE, A Level)
Общий
- Анимации и объяснения различных типов микроскопии, включая электронную микроскопию (Université Paris Sud)
- Сканирующая электронная микроскопия окружающей среды (ESEM)
- Сайт ETH Zurich: графики и изображения, иллюстрирующие различные процедуры
- Семинар Евы Ногалес: "Введение в электронную микроскопию"
- Конкурс имиджа FEI: FEI ежегодно с 2008 года проводит конкурс изображений для микроскопии.
- Введение в электронную микроскопию Дэвид Сонди
- Nanohedron.com галерея изображений: изображения, полученные с помощью электронной микроскопии
- Рентгеноэлементный анализ в электронной микроскопии: информационный портал с материалами рентгеновского микроанализа и EDX
История
- Воспоминания Джона Х.Л. Уотсона из Университета Торонто, когда он работал с Хиллиером и Пребусом
- Коллекция электронной микроскопии Рубина Бораски, 1930–1988 гг. (Архивный центр, Национальный музей американской истории, Смитсоновский институт)




