Перекос сборщика мусора - GC skew

Перекос сборщика мусора когда нуклеотиды гуанин и цитозин избыточно или недостаточно в определенном регионе ДНК или же РНК. В условиях равновесия (без мутационный или же селективное давление и с нуклеотидами, случайно распределенными внутри геном ) четыре основания ДНК имеют одинаковую частоту (аденин, гуанин, тимин, и цитозин ) на обоих отдельные пряди молекулы ДНК.[1] Однако в большинстве бактерии (например. Кишечная палочка ) и немного археи (например. Sulfolobus solfataricus ), нуклеотидный состав асимметричен между ведущая нить и отстающая прядь: ведущая цепь содержит больше гуанина (G) и тимина (T), тогда как отстающая цепь содержит больше аденина (A) и цитозина (C).[1] Это явление обозначается как GC и AT перекос. Математически это представляется следующим образом:[2]
Наклон GC = (G - C) / (G + C)
AT перекос = (A - T) / (A + T)
Асимметричный нуклеотидный состав
Эрвин Чаргафф Работа 1950 года показала, что в ДНК основания гуанин и цитозин были обнаружены в равном количестве, а основания аденин и тимин были обнаружены в равном количестве. Однако не было равенства между суммой одного пара по сравнению с другим.[3] Находка Чаргаффа упоминается как Правило Чаргаффа или же правило четности 1.[3] Три года спустя Уотсон и Крик использовали этот факт при выводе структуры ДНК. модель двойной спирали.
Естественным результатом правила четности 1 в состоянии равновесия, в котором нет ошибок мутации и / или отбора в любой из двух цепей ДНК, является то, что при равной скорости замен комплементарные нуклеотиды на каждой нити есть равные количества данной основы и ее дополнения.[4] Другими словами, в каждой цепи ДНК частота появления T равна A, а частота появления G равна C, потому что частота замен предположительно одинакова. Это явление обозначается как правило четности 2. Следовательно, второе правило четности существует только тогда, когда нет мутации или замены.
Любое отклонение от правила четности 2 приведет к асимметричному составу оснований, который отличает ведущую цепь, т. Е. Цепь ДНК, которая реплицируется в прямом направлении, от отстающей цепи. Эта асимметрия называется перекосом GC или AT.[1]
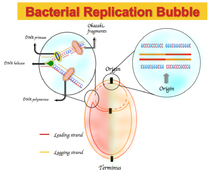
В некоторых бактериальных геномах наблюдается обогащение гуанином над цитозином и тимином над аденином в ведущей цепи и наоборот, в отстающей цепи. Спектры асимметрии нуклеотидного состава варьируются от -1, что соответствует G = 0 или A = 0, до +1, что соответствует T = 0 или C = 0.[1] Следовательно, положительный перекос GC представляет собой богатство G над C, а отрицательный перекос GC представляет собой богатство C над G. В результате ожидается положительный перекос GC и отрицательный перекос AT в ведущей цепи, а также отрицательный перекос GC и положительный перекос AT в отстающей нити.[5] GC или AT перекос меняет знак на границах двух реплики, которые соответствуют началу или концу репликации ДНК.[1][4][5] Первоначально этот асимметричный нуклеотидный состав объяснялся как другой механизм, используемый в Репликация ДНК между ведущей прядью и отстающей прядью. Репликация ДНК - полуконсервативный и асимметричный процесс.[6] Эта асимметрия обусловлена образованием вилки репликации и ее разделением на возникающие ведущие и отстающие нити. Ведущая цепь синтезируется непрерывно и рядом с ведущей цепью; отстающая цепь реплицируется через короткие фрагменты полинуклеотида (Фрагменты Окадзаки ) в направлении от 5 футов до 3 футов.[6]
Расчет и наклонные графики GC
Существует три основных подхода к вычислению и графической демонстрации перекоса сборщика мусора и его свойств.
Асимметрия GC
Первый подход - асимметрия GC и AT.[1] Жан Р. Лобри в 1996 году первым сообщил о том, что[7] наличие композиционной асимметрии в геномах трех бактерий: Кишечная палочка, Bacillus subtilis, и Haemophilus influenzae. Первоначальные формулы в то время назывались не перекосом, а скорее отклонением от [A] = [T] или [C] = [G]:
отклонение от [A] = [T] как (A - T) / (A + T);
отклонение от [C] = [G] как (C - G) / (C + G);
где A, T, G и C представляют частоту появления эквивалентного основания в конкретной последовательности определенной длины. Стратегия скольжения окна используется для вычисления отклонения от C по геному. На этих графиках положительное отклонение от C соответствует отстающей цепи, а отрицательное отклонение от C соответствует ведущей цепи.[8] Кроме того, место переключения знака отклонения соответствует исходной точке или конечной точке. Ось X представляет положения хромосом, нанесенные на график от 5 'до 3', а ось Y представляет значение отклонения. Основным недостатком этого метода является его свойство, зависящее от размера окна. Следовательно, выбор соответствующего размера окна сильно влияет на результат построения графика. Другие методы должны сочетаться с отклонением, чтобы идентифицировать и локализовать источник репликации ДНК с большей точностью.
CGC перекос
Второй подход называется кумулятивным перекосом сборки мусора (CGC skew).[2] В этом методе по-прежнему используется стратегия скользящего окна, но при этом используется сумма смежных окон с произвольного начала. В этой схеме весь геном обычно нанесен на 5 '- 3' с использованием произвольного начала и произвольной цепи. На кумулятивном графике перекоса GC пики соответствуют точкам переключения (конечная точка или начало координат).
В отличие от более ранней статьи Лобри, недавние реализации GC skew переворачивают исходное определение, переопределяя его следующим образом:
GC перекос = (G - C) / (G + C).
При перевернутом определении перекоса GC максимальное значение кумулятивного перекоса соответствует окончанию, а минимальное значение соответствует началу репликации.
Кривая Z
Последний подход - это Кривая Z.[9] В отличие от предыдущих методов, этот метод не использует стратегию скользящего окна и считается более эффективным в поиске источника репликации.[9] В этом методе каждая база накопленная частота относительно основания в начале последовательности. Кривая Z использует трехмерное представление со следующими параметрами:
Где , представляет собой избыток пурина над пиримидином, обозначает избыток кето над амино, и показывает отношения между слабым и сильным водородные связи. и компоненты могут самостоятельно обнаружить источник репликации и асимметричный состав цепей. Комбинация этих методов должна использоваться для предсказания начала и конца репликации, чтобы компенсировать их слабость.
Механизм
В научном сообществе отсутствует консенсус относительно механизма, лежащего в основе смещения нуклеотидного состава в каждой цепи ДНК. Существуют две основные школы мысли, которые объясняют механизм, лежащий в основе специфического нуклеотидного состава цепи у бактерий.[4]
Первый описывает смещение и асимметричный мутационное давление на каждой цепи ДНК во время репликации и транскрипция.[4][10] Из-за асимметричного характера процесса репликации неравномерная частота мутаций и Ремонт ДНК эффективность в процессе репликации может дать больше мутации в одной нити по сравнению с другой.[5] Более того, время, используемое для репликации между двумя цепями, варьируется и может приводить к асимметричному мутационному давлению между ведущей и отстающей цепью.[11] Помимо мутаций во время репликации ДНК, транскрипционные мутации могут создавать перекос нуклеотидного состава, специфичный для цепи.[5] Дезаминирование цитозина и, в конечном итоге, мутация цитозина в тимин в одной цепи ДНК может увеличить относительное количество гуанина и тимина по отношению к цитозину и аденину.[5] У большинства бактерий большинство генов закодировано в ведущей цепи.[4] Например, ведущая нить в Бациллы subtilis кодирует 75% генов.[5] Кроме того, сообщалось об избытке дезаминирования и превращения цитозина в тимин в кодирующей цепи по сравнению с некодирующей цепью.[4][5][12] Одно из возможных объяснений состоит в том, что нетранскрибируемая нить (кодирующая нить ) является одноцепочечным в процессе транскрипции; следовательно, он более уязвим для дезаминирования по сравнению с транскрибированной цепью (некодирующая нить ).[5][13] Другое объяснение состоит в том, что активность репарации дезаминирования во время транскрипции не проявляется в кодирующей цепи.[5] От этих событий восстановления дезаминированием выигрывает только транскрибированная нить.
Вторая школа мысли описывает механизм перекоса GC и AT как результат разницы в селективное давление между ведущими и отстающими прядями.[4][5][13] Исследование прокариотического генома показывает предпочтение позиции третьего кодона для G перед C и T перед A.[5] Это различение создает асимметричный нуклеотидный состав, если кодирующая цепь неравномерно распределена между ведущей и отстающей цепями, как в случае бактерий. Кроме того, гены с высокой степенью транскрибирования, такие как рибосомальные белки, как было показано, расположены в основном на ведущей цепи бактерий.[5] Следовательно, смещение в выборе кодона G в третьем положении по сравнению с C может привести к смещению GC. Кроме того, некоторые сигнальные последовательности богаты гуанином и тимином, например последовательности чи, и эти последовательности могут иметь более высокую частоту встречаемости в одной цепи по сравнению с другой.[4][5]
Как мутационное, так и селективное давление могут независимо вносить асимметрию в цепи ДНК. Однако комбинация и кумулятивный эффект обоих механизмов является наиболее вероятным объяснением перекоса GC и AT.[4][13]
Использует
Доказано, что асимметрия GC полезна в качестве индикатора ведущей цепи ДНК, отстающей цепи, начала репликации и конца репликации.[1][4][5] Большинство бактерий и архей содержат только одну точку начала репликации ДНК.[1] Асимметрия GC положительна и отрицательна в ведущей цепи и в отстающей цепи соответственно; поэтому ожидается, что изменение знака перекоса GC будет только в точке начала и конца репликации ДНК.[4] Смещение GC также можно использовать для изучения смещений цепей и механизмов, связанных с ними, путем вычисления превышения одного основания над его дополнительным основанием в различных средах.[4][5][13] Такие методы, как перекос GC, перекос CGC и кривая Z, являются инструментами, которые могут дать возможность лучше изучить механизм репликации ДНК в различных организмах.
Рекомендации
- ^ а б c d е ж грамм час Лобри, Дж. Р. Асимметричные схемы замещения в двух цепях ДНК бактерий. Молекулярная биология и эволюция 13, 660-665 (1996).
- ^ а б Григорьев А. Анализ геномов с помощью кумулятивных перекосов. Nucleic Acids Research 26, 2286-2290 (1998).
- ^ а б Чаргафф, Э. Химическая специфичность нуклеиновых кислот и механизм их ферментативной деградации. Experientia 6, 201-209 (1950).
- ^ а б c d е ж грамм час я j k л Necsulea, A. & Lobry, J. R. Новый метод оценки влияния репликации на асимметрию состава оснований ДНК. Молекулярная биология и эволюция 24, 2169-2179, DOI: 10.1093 / molbev / msm148 (2007).
- ^ а б c d е ж грамм час я j k л м п о Тиллиер, Э. Р. и Коллинз, Р. А. Вклад ориентации репликации, направления генов и сигнальных последовательностей в асимметрию состава оснований в бактериальных геномах. Журнал молекулярной эволюции 50, 249-257 (2000).
- ^ а б Роча, Э. П. Репликационная организация бактериальных геномов. Microbiology 150, 1609-1627, DOI: 10.1099 / mic.0.26974-0 (2004).
- ^ Лобри, Дж. Р. (май 1996 г.). «Асимметричные схемы замещения в двух цепях ДНК бактерий». Молекулярная биология и эволюция. 13 (5): 660–665. Дои:10.1093 / oxfordjournals.molbev.a025626. ISSN 0737-4038. PMID 8676740.
- ^ "Разъяснение к статье Лобры 1996 г."
- ^ а б Zhang, R. & Zhang, C.T. Множественные источники репликации архей Halobacterium разновидностей NRC-1. Сообщения о биохимических и биофизических исследованиях 302, 728-734 (2003).
- ^ Lobry, J. R. & Sueoka, N. Асимметричные направленные мутации давления в бактериях. Геномная биология 3, RESEARCH0058 (2002).
- ^ Эппингер М., Баар К., Раддац Г., Хусон Д. Х. и Шустер С. С. Сравнительный анализ четырех Campylobacterales. Обзоры природы. Microbiology 2, 872-885, DOI: 10.1038 / nrmicro1024 (2004).
- ^ Марин, А. и Ся, X. Асимметрия GC в генах, кодирующих белок, между ведущей и отстающей цепями в бактериальных геномах: новые модели замещения, включающие смещение цепи. Журнал теоретической биологии 253, 508-513, DOI: 10.1016 / j.jtbi.2008.04.004 (2008).
- ^ а б c d Чарнески К.А., Хонти Ф., Брайант Дж. М., Херст Л. Д., Фейл Э. Дж. Атипичный перекос AT в устойчивых геномах является результатом отбора, а не мутации. PLoS Genetics 7 (9): e1002283 (2011).
- Mewes, H. W. et al. MIPS: анализ и аннотация белков из полных геномов в 2005 г. Nucleic Acids Res 34, D169-172, DOI: 10.1093 / nar / gkj148 (2006).









