Ацетат марганца (II) - Manganese(II) acetate
 | |
| Имена | |
|---|---|
| Название ИЮПАК Ацетат марганца (II) | |
| Другие имена Диацетат марганца | |
| Идентификаторы | |
| |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.010.305 |
PubChem CID | |
| UNII |
|
| |
| |
| Характеристики | |
| Mn (CH3CO2)2 (безводный) Mn (CH3CO2)2· 4H2О (тетрагидрат) | |
| Молярная масса | 173,027 г / моль (безводный) 245,087 г / моль (тетрагидрат) |
| Внешность | белые кристаллы (безводные) светло-розовый моноклинический кристаллы (тетрагидрат) |
| Плотность | 1,74 г / см3 (безводный) 1,59 г / см3 (тетрагидрат) |
| Температура плавления | 210 ° С (410 ° F, 483 К) (безводный) 80 ° С (тетрагидрат) |
| Растворимость | растворим в воды (около 700 г / л при 20 ° C для тетрагидрата), метанол, уксусная кислота (безводный) растворим в воды, этиловый спирт (тетрагидрат) |
| +13,650·10−6 см3/ моль | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | > 130 ° С (266 ° F, 403 К) (тетрагидрат) |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 2940 мг / кг (крыса, перорально)[2] |
| Родственные соединения | |
Другой анионы | Фторид марганца (II) Хлорид марганца (II) Бромид марганца (II) |
Другой катионы | Ацетат цинка Ацетат ртути (II) Ацетат серебра |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Ацетат марганца (II) находятся химические соединения с формулой Mn (CH3CO2)2.(ЧАС2O)п где n = 0, 2, 4 ... Он используется как катализатор и, как удобрение.[3]
Реакции
Ацетат марганца (II) может быть получен путем обработки либо оксид марганца (II, III) или же карбонат марганца (II) с уксусной кислотой:[4]
- Mn3О4 + 2 канала3CO2H → Mn (CH3CO2)2 + Mn2О3 + H2О
- MnCO3 + 2 канала3CO2H → Mn (CH3CO2)2 + CO2 + H2О
Структура
Безводный материал и дигидрат Mn (CH3CO2)2.2H2О координационные полимеры. Дигидрат охарактеризован с помощью рентгеновской кристаллографии. Каждый центр Mn (II) окружен шестью кислородными центрами, образованными акво лиганды и ацетаты.
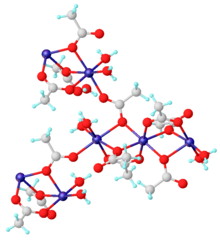
Субъединица структуры дигидрата ацетата марганца (II).[5]
Рекомендации
- ^ Лиде, Дэвид Р. (1998), Справочник по химии и физике (87 ред.), Бока-Ратон, Флорида: CRC Press, стр. 3–354, 4–68, ISBN 0-8493-0594-2
- ^ «Соединения марганца (в виде Mn)». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ Томас Скотт; Мэри Иглсон (1994), Краткая энциклопедия химии, Вальтер де Грюйтер, стр. 620, г. ISBN 3-11-011451-8, получено 2009-07-20
- ^ Арно Х. Рейдис (2002). «Марганцевые соединения». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a16_123.CS1 maint: использует параметр авторов (связь)
- ^ Чи-И Ченг, Сью-Лейн Ван (1991). «Структура дигидрата ацетата марганца». Acta Crystallographica Раздел C. 47: 1734. Дои:10.1107 / S0108270191002202.CS1 maint: использует параметр авторов (связь)
Ацетилгалогениды и соли ацетат ион | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | Он | ||||||||||||||||||
| LiOAc | Быть (OAc)2 BeAcOH | B (OAc)3 | AcOAc ROAc | NH4OAc | AcOOH | FAc | Ne | ||||||||||||
| NaOAc | Mg (OAc)2 | Al (OAc)3 АЛСОЛ Al (OAc)2ОЙ Al2ТАК4(OAc)4 | Si | п | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc)2 | Sc (OAc)3 | Ti (OAc)4 | VO (OAc)3 | Cr (OAc)2 Cr (OAc)3 | Mn (OAc)2 Mn (OAc)3 | Fe (OAc)2 Fe (OAc)3 | Co (OAc)2, Co (OAc)3 | Ni (OAc)2 | Cu (OAc)2 | Zn (OAc)2 | Ga (OAc)3 | Ge | Как (OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr (OAc)2 | Y (OAc)3 | Zr (OAc)4 | Nb | Пн (OAc)2 | Tc | Ru (OAc)2 Ru (OAc)3 Ru (OAc)4 | Rh2(OAc)4 | Pd (OAc)2 | AgOAc | CD (OAc)2 | В | Sn (OAc)2 Sn (OAc)4 | Sb (OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba (OAc)2 | Hf | Та | W | Re | Операционные системы | Ir | Pt (OAc)2 | Au | Hg2(OAc)2, Hg (OAc)2 | TlOAc Tl (OAc)3 | Pb (OAc)2 Pb (OAc)4 | Би (OAc)3 | По | В | Rn | |||
| Пт | Ра | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |||
| ↓ | |||||||||||||||||||
| Ла (OAc)3 | Ce (OAc)Икс | Pr | Nd | Вечера | Sm (OAc)3 | Eu (OAc)3 | Gd (OAc)3 | Tb | Dy (OAc)3 | Хо (OAc)3 | Э | Тм | Yb (OAc)3 | Лу (OAc)3 | |||||
| Ac | Чт | Па | UO2(OAc)2 | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | |||||

