Твердые органические вещества - Particulate organic matter
| Часть серии о |
| Цикл углерода |
|---|
 |
Твердые органические вещества (POM) представляет собой фракцию общего органического вещества, которая оперативно определяется как та, которая не проходит через поры фильтра, размер которых обычно составляет от 0,053 до 2 миллиметров.[3]
Твердый органический углерод (POC) - это тесно связанный термин, который часто используется как синоним ПОМ. POC конкретно относится к массе углерода в твердых частицах органического материала, в то время как POM относится к общей массе твердых частиц органического вещества. Помимо углерода, ПОМ включает массу других элементов в органическом веществе, таких как азот, кислород и водород. В этом смысле POC является компонентом POM, и обычно POM примерно в два раза больше, чем POC.[4] Многие утверждения, которые можно сделать о POM, в равной степени применимы и к POC, и многое из того, что говорится в этой статье о POM, можно было бы сказать и о POC.
Органическое вещество в виде частиц иногда называют макроорганическим веществом или крупным органическим веществом. Изолированный просеивание или фильтрации, эта фракция частично включает разложенный детрит и растительный материал, пыльца, и другие материалы.[5][6] При просеивании для определения содержания ПОМ решающее значение имеет согласованность, потому что отдельные фракции по размеру будут зависеть от силы перемешивания.[7]
ПОМ легко разлагается, обслуживая многие функции почвы и обеспечение водоемов земным материалом. Это источник пищи для обоих почвенные организмы и водных организмов и обеспечивает питательные вещества для растений. В водоемах ПОМ может вносить существенный вклад в мутность, ограничивая фотическую глубину, что может снизить первичную продуктивность. ПОМ также улучшает структура почвы приводит к увеличению инфильтрация воды, аэрация и устойчивость к эрозия [5][8] Практика управления почвой, например обработка почвы и компост /навоз внесения, измените содержание ПОМ в почве и воде.[5][6]
Обзор
Наземные экосистемы
Органическое вещество почвы
Органическое вещество почвы есть что-нибудь в почве биологического происхождения. Углерод - его ключевой компонент, составляющий около 58% по весу. Простая оценка общего органического вещества достигается путем измерения органический углерод в почве. Живые организмы (включая корни) составляют около 15% от общего количества органических веществ в почве. Это критически важно для работы почвы. цикл углерода. То, что далее следует, относится к оставшимся 85% органического вещества почвы - неживому компоненту.[9]
Как показано ниже, неживое органическое вещество в почвах можно разделить на четыре отдельные категории на основе размера, поведения и стойкости.[10] Эти категории расположены в порядке убывания способности к разложению. Каждый из них по-своему способствует здоровью почвы.[10][9]
| Органическое вещество почвы |
| ||||||||||||||||||
| (не живой) |
Растворенное органическое вещество (DOM): органическое вещество, растворяющееся в почвенной воде. Он состоит из относительно простых органических соединений (например, органических кислот, сахаров и аминокислот), которые легко разлагаются. Срок обращения составляет менее 12 месяцев. Сюда входят экссудаты из корней растений (слизь и десны).[9]
Твердое органическое вещество (POM): это органическое вещество, которое сохраняет доказательства своей первоначальной клеточной структуры, [9] и обсуждается далее в следующем разделе.
Гумус: обычно составляет самую большую долю органического вещества в почве, составляя от 45 до 75%. Обычно он прилипает к минералам почвы и играет важную роль в структурировании почвы. Гумус является конечным продуктом жизнедеятельности почвенных организмов, имеет сложный химический состав и не имеет узнаваемых характеристик происхождения. Гумус имеет очень маленькие размеры и большую площадь поверхности по сравнению с его весом. Он удерживает питательные вещества, обладает высокой водоудерживающей способностью и значительным катионообменная емкость, буферизует изменение pH и может удерживать катионы. Гумус довольно медленно разлагается и существует в почве десятилетиями.[9]
Устойчивое органическое вещество: имеет высокое содержание углерода и включает древесный уголь, обугленные растительные материалы, графит и уголь. Время оборота велико и исчисляется сотнями лет. Он не является биологически активным, но положительно влияет на структурные свойства почвы, включая водоудерживающую способность, катионообменную способность и термические свойства.[9]
Роль ПОМ в почвах
Твердые органические вещества (ПОМ) включают постоянно разлагающийся растительный мусор и фекалии животных, а также детрит, образовавшийся в результате деятельности микроорганизмов. Большая его часть постоянно подвергается разложению микроорганизмами (при достаточно влажных условиях) и обычно имеет время оборота менее 10 лет. Оборот менее активных частей может занять от 15 до 100 лет. Там, где они все еще находятся на поверхности почвы и относительно свежие, твердые органические вещества перехватывают энергию капель дождя и защищают физические поверхности почвы от повреждений. При разложении твердые органические вещества обеспечивают большую часть энергии, необходимой почвенным организмам, а также обеспечивают постоянный выброс питательных веществ в почвенную среду.[9]
В разложение POM обеспечивает энергию и питательные вещества. Питательные вещества, не усваиваемые почвенными организмами, могут поступать в организм растений.[6] Количество выделяемых питательных веществ (минерализованный ) во время разложения зависит от биологических и химических характеристик ПОМ, таких как Соотношение C: N.[6] Помимо высвобождения питательных веществ, разлагатели, заселяющие ПОМ, играют роль в улучшении структуры почвы.[11] Грибковые мицелий запутывают частицы почвы и выделяют в нее липкие цементоподобные полисахариды; в конечном итоге образует почвенные агрегаты [11]
На содержание ПОМ в почве влияют органические вещества и активность разложителей почвы. Добавление органических материалов, таких как навоз или пожнивные остатки, обычно приводит к увеличению POM.[6] Альтернативно, повторная обработка почвы или нарушение почвы увеличивает скорость разложения, подвергая почвенные организмы воздействию кислорода и органических веществ. субстраты; в конечном итоге, истощение POM. Снижение содержания РОМ наблюдается, когда естественные пастбища превращаются в сельскохозяйственные угодья.[5] Температура и влажность почвы также влияют на скорость разложения ПОМ.[6] Поскольку ПОМ является легкодоступным (лабильным) источником питательных веществ в почве, вносит вклад в структуру почвы и очень чувствителен к управлению почвой, он часто используется в качестве индикатора для измерения качество почвы.[8]
Пресноводные экосистемы
На плохо обрабатываемых почвах, особенно на склонах, эрозия и перенос почвы осадок богатые POM могут загрязнять водоемы.[8] Поскольку ПОМ является источником энергии и питательных веществ, быстрое накопление органических веществ в воде может привести к эвтрофикация.[11] Взвешенные органические материалы также могут служить потенциальным вектором загрязнения воды фекальные бактерии, токсичные металлы или органические соединения.
Морские экосистемы
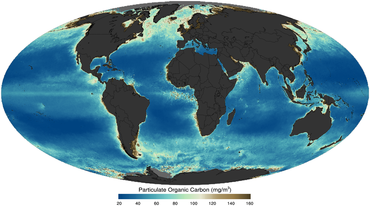
в качестве снято со спутника в 2011


Жизнь и твердые частицы органического вещества в океане в корне сформировали нашу планету. На самом базовом уровне твердое органическое вещество можно определить как живое, так и неживое вещество биологического происхождения с размером ≥0,2 мкм в диаметре, включая все, от небольших бактерий (размером 0,2 мкм) до синих китов (размером 20 м).[14] Органическое вещество играет решающую роль в регулировании глобального морские биогеохимические циклы и события из Великое окислительное событие в ранней истории Земли [15] к связыванию атмосферного углекислого газа в глубинах океана.[16] Таким образом, понимание распределения, характеристик и динамики твердых частиц в океане имеет фундаментальное значение для понимания и прогнозирования морской экосистемы, от динамики трофической сети до глобальных биогеохимических циклов.[17]
Измерение ПОМ
Оптические измерения частиц становятся важным методом для понимания океанического углеродного цикла, включая вклад в оценки их нисходящего потока, который улавливает углекислый газ в глубоком море. Оптические инструменты можно использовать с кораблей или устанавливать на автономных платформах, обеспечивая гораздо больший пространственный и временной охват частиц в пространстве. мезопелагическая зона океана, чем традиционные методы, такие как отстойники. За последние два десятилетия технологии изображения частиц значительно продвинулись вперед, но количественный перевод этих огромных наборов данных в биогеохимические свойства остается проблемой. В частности, необходимы достижения для обеспечения оптимального преобразования отображаемых объектов в содержание углерода и скорости погружения. Кроме того, разные устройства часто измеряют разные оптические свойства, что затрудняет сравнение результатов.[17]
Первичная продукция океана
Морское первичное производство можно разделить на новое производство из аллохтонный поступление питательных веществ в эвфотическая зона, и регенерированная продукция из переработка питательных веществ в поверхностных водах. Общая новая продукция в океане примерно равна тонущему потоку твердых частиц органического вещества в глубину океана, примерно 4 × 109 тонн углерода ежегодно.[18]
Модель тонущих океанических частиц
Тонущие океанические частицы имеют широкий диапазон формы, пористости, балласта и других характеристик. Модель, показанная на диаграмме справа, пытается уловить некоторые преобладающие особенности, которые влияют на форму профиля падающего потока (красная линия).[13] Опускание органических частиц, образующихся в верхних залитых солнцем слоях океана, формирует важную часть океанического биологического насоса, который влияет на связывание углерода и пополнение запасов питательных веществ в мезопелагическом океане. Частицы, идущие из верхних слоев океана, подвергаются реминерализации бактериями, колонизированными на их поверхности и внутри, что приводит к ослаблению опускающегося потока органического вещества с глубиной. Диаграмма иллюстрирует механистическую модель зависящего от глубины потока тонущей массы твердых частиц, состоящего из ряда тонущих, реминерализующихся частиц.[13]
Морской снег различается по форме, размеру и характеру - от отдельных клеток до гранул и агрегатов, большая часть которых быстро колонизируется и поглощается гетеротрофными бактериями, что способствует ослаблению тонущего потока с глубиной.[13]
Скорость опускания
Диапазон регистрируемых скоростей опускания частиц в океанах варьируется от отрицательных (частицы плавают к поверхности)[19][20] до нескольких км в сутки (как с фекальными гранулами сальпы)[21] При рассмотрении скорости опускания отдельной частицы первое приближение может быть получено из закона Стокса (первоначально полученного для сферических, непористых частиц и ламинарного потока) в сочетании с приближением Уайта,[22] которые предполагают, что скорость опускания увеличивается линейно с избыточной плотностью (отличной от плотности воды) и квадратом диаметра частицы (то есть линейно с площадью частицы). Основываясь на этих ожиданиях, многие исследования пытались связать скорость опускания в первую очередь с размером, который, как было показано, является полезным предиктором для частиц, образующихся в контролируемой среде (например, в роликовых резервуарах).[23][24][25] Однако сильные взаимосвязи наблюдались только тогда, когда все частицы были созданы с использованием одного и того же сообщества воды / планктона.[26] Когда частицы были созданы различными сообществами планктона, сам по себе размер был плохим предиктором (например, Diercks and Asper, 1997), строго подтверждающим представления о том, что плотность и форма частиц широко варьируются в зависимости от исходного материала.[27][17]
Упаковка и пористость в значительной степени влияют на определение скорости погружения. С одной стороны, добавление балластных материалов, таких как панцири диатомовых водорослей, к агрегатам может привести к увеличению скорости погружения из-за увеличения избыточной плотности. С другой стороны, добавление балластирующих минеральных частиц к популяции морских частиц часто приводит к более мелким и более плотно упакованным агрегатам, которые опускаются медленнее из-за их меньшего размера.[28][29] Было показано, что богатые слизью частицы плавают, несмотря на относительно большие размеры.[30][31] в то время как агрегаты, содержащие нефть или пластик, быстро тонут, несмотря на присутствие веществ с избыточной плотностью, меньшей, чем у морской воды.[32][33] В естественной среде частицы образуются с помощью разных механизмов, разными организмами и в различных условиях окружающей среды, которые влияют на агрегацию (например, соленость, pH, минералы), балластировку (например, осаждение пыли, отложения наносов;[34][35] van der Jagt et al., 2018) и опускание (например, вязкость;[36]). Следовательно, универсальное преобразование размера в скорость погружения невозможно.[37][17]
Роль в нижней водной пищевой сети
Вместе с растворенное органическое вещество, ПОМ управляет нижней водной пищевой цепью, обеспечивая энергию в виде углеводов, сахаров и других полимеров, которые могут разлагаться. ПОМ в водоемах происходит из наземных источников (например, органического вещества почвы, опада листвы), подводной или плавучей водной растительности или автохтонного производства водорослей (живых или обломочных). Каждый источник ПОМ имеет свой собственный химический состав, который влияет на его лабильность или доступность для пищевой сети. Считается, что ПОМ, полученное из водорослей, является наиболее лабильным, но появляется все больше свидетельств того, что ПОМ наземного происхождения может дополнять рацион микроорганизмов, таких как зоопланктон, когда первичная продуктивность ограничена.[38][39]
Биологический угольный насос
Динамика пула твердых частиц органического углерода (ВОУ) в океане имеет центральное значение для морской углеродный цикл. ВОУ - это связующее звено между первичной продукцией на поверхности, глубинами океана и отложениями. Скорость разложения ВОУ в темном океане может влиять на СО в атмосфере.2 концентрация. Таким образом, центральным направлением исследований морской органической геохимии является улучшение понимания распределения, состава и цикличности ВОУ. За последние несколько десятилетий произошли улучшения в аналитических методах, которые значительно расширили возможности измерения, как с точки зрения структурного разнообразия органических соединений и изотопного состава, так и дополнительных молекулярные омики исследования.[12]

Как показано на диаграмме, фитопланктон исправить углекислый газ в эвфотическая зона используя солнечную энергию и производят POC. ВОУ, образующиеся в эвфотической зоне, обрабатываются морские микроорганизмы (микробы), зоопланктон и их потребителей в органические агрегаты (морской снег ), который затем экспортируется в мезопелагический (Глубина 200–1000 м) и батипелагические зоны утонув и вертикальная миграция зоопланктоном и рыбой.[40][41][42]
В биологический угольный насос описывает совокупность биогеохимических процессов, связанных с производством, опусканием и реминерализация органического углерода в океане.[43][44] Короче говоря, фотосинтез микроорганизмов в верхних десятках метров водной толщи фиксирует неорганический углерод (любой из химических видов растворенного диоксида углерода) в биомассе. Когда эта биомасса опускается в океан, часть ее питает метаболизм живущих там организмов, в том числе глубоководных рыб и бентосных организмов.[42] Зоопланктон играет решающую роль в формировании потока частиц за счет поглощения и фрагментации частиц,[45][46][47][48][49][50] производство быстро тонущего фекального материала[42][21] и активная вертикальная миграция.[51][52][53][17]
Помимо важности «экспортируемого» органического углерода в качестве источника пищи для глубоководных организмов, биологический углеродный насос обеспечивает ценную экосистемную функцию: экспортируемый органический углерод ежегодно переносит примерно 5–20 Гт C в глубоководные районы океана,[54] где его часть (~ 0,2–0,5 Гт C)[55] изолирован на несколько тысячелетий. Таким образом, биологический углеродный насос имеет такую же величину, что и текущие выбросы углерода от ископаемого топлива (~ 10 Гт C год − 1). Любые изменения в его величине, вызванные потеплением в мире, могут иметь прямые последствия как для глубоководных организмов, так и для концентрации углекислого газа в атмосфере.[56][57][17]
Величина и эффективность (количество поглощенного углерода относительно первичной продукции) биологического углеродного насоса, следовательно, хранилище углерода в океане, частично определяются количеством экспортируемого органического вещества и скоростью его реминерализации (т. Е. Скоростью, с которой тонущее органическое вещество перерабатывается и вдыхается в районе мезопелагической зоны.[56][58][59] В частности, размер и состав частиц являются важными параметрами, определяющими скорость оседания частиц.[60][58] сколько в нем материала,[61] и какие организмы могут его находить и использовать.[62][63][64][17]
Тонущие частицы могут быть фитопланктоном, зоопланктоном, детритом, фекальными гранулами или их смесью (Simon et al., 2002; Turner, 2002, 2015). Их размер варьируется от нескольких микрометров до нескольких сантиметров, причем частицы диаметром> 0,5 мм называются «морским снегом» (Alldredge and Silver, 1988). В общем, считается, что частицы в жидкости тонут, когда их плотность выше, чем у окружающей жидкости, то есть когда избыточная плотность больше нуля. Таким образом, более крупные отдельные клетки фитопланктона могут вносить вклад в потоки осадков. Например, было показано, что крупные клетки диатомовых водорослей и цепи диатомовых водорослей диаметром> 5 мкм опускаются со скоростью до нескольких 10 с-метров в день, хотя это возможно только из-за тяжелого балласта кремнеземной панциря (Waite et al. ., 1997a; Miklasz, Denny, 2010). И размер, и плотность влияют на скорость опускания частиц; например, для скоростей опускания, соответствующих закону Стокса, удвоение размера частицы увеличивает скорость опускания в 4 раза (Мур и Виллареал, 1996; Уэйт и др., 1997а). Однако высокопористая природа многих морских частиц означает, что они не подчиняются закону Стокса, потому что небольшие изменения плотности частиц (то есть компактности) могут иметь большое влияние на скорость их опускания.[58] Крупные тонущие частицы обычно бывают двух типов: (1) агрегаты, образованные из ряда первичных частиц, включая фитопланктон, бактерии, фекальные гранулы, живых простейших, зоопланктон и мусор, и (2) фекальные гранулы зоопланктона, которые могут доминировать в явлениях потока частиц. и тонет со скоростями, превышающими 1000 мД−1.[42][17]
Знание размера, количества, структуры и состава (например, содержания углерода) оседающих частиц важно, поскольку эти характеристики налагают фундаментальные ограничения на биогеохимический цикл углерода. Например, ожидается, что изменения климата будут способствовать изменению видового состава таким образом, чтобы изменить элементный состав твердых частиц, размер клеток и траекторию движения углерода через пищевую сеть, влияя на долю биомассы, экспортируемой на глубину (Finkel et al. др., 2010). Таким образом, любое вызванное климатом изменение структуры или функции сообществ фитопланктона, вероятно, повлияет на эффективность биологического углеродного насоса с обратной связью по скорости изменения климата (Matear and Hirst, 1999; Le Quéré et al., 2007 ).[17]
Гипотеза биолюминесцентного шунта
Потребление рыбами биолюминесцентного POC может привести к выделению биолюминесцентных фекальных гранул (переупаковка), которые также могут быть произведены с небиолюминесцентным POC, если кишечник рыбы уже заражен биолюминесцентными бактериями.[66]
На диаграмме справа тонущий ВОУ движется вниз, за ним следует химический шлейф.[67] Простые белые стрелки обозначают поток углерода. Панель (а) представляет собой классический вид небиолюминесцентной частицы. Длина шлейфа определяется по шкале сбоку.[68] Панель (b) представляет собой случай светящейся частицы в гипотезе биолюминесцентного шунта. Биолюминесцентные бактерии представлены агрегированными на частице. Их световое излучение показано в виде голубоватого облака вокруг него. Синие пунктирные стрелки обозначают визуальное обнаружение и движение к частице организмов-потребителей. Повышение визуального обнаружения позволяет лучше обнаруживать верхние трофические уровни, что может привести к фрагментации погружающихся ВОУ во взвешенные ВОУ из-за небрежного кормления.[66]
Смотрите также
Рекомендации
- ^ Монрой, П., Эрнандес-Гарсия, Э., Росси, В. и Лопес, К. (2017) "Моделирование динамического опускания биогенных частиц в океанический поток". Нелинейные процессы в геофизике, 24(2): 293–305. Дои:10.5194 / npg-24-293-2017.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 3.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 3.0. - ^ Саймон, М., Гроссарт, Х., Швейцер, Б. и Плуг, Х. (2002) "Микробная экология органических агрегатов в водных экосистемах". Водная микробная экология, 28: 175–211. Дои:10.3354 / ame028175.
- ^ Cambardella, C.A .; Эллиотт, Э. Т. (1991). Изменения органического вещества почвы в виде твердых частиц в процессе выращивания пастбищ. Журнал Американского общества почвоведов. 56. С. 777–783. Дои:10.2136 / sssaj1992.03615995005600030017x.
- ^ Муди К.С. и Уорролл Ф. (2017) «Моделирование темпов разложения РОУ с использованием состава РОВ и гидроклиматических переменных». Журнал геофизических исследований: биогеонауки, 122(5): 1175–1191. Дои:10.1002 / 2016JG003493.
- ^ а б c d Brady, N.C .; Вейль, Р. Р. (2007). Природа и свойства почв (11-е изд.). Река Аппер Сэдл, Нью-Джерси: Prentice-Hall Inc.
- ^ а б c d е ж Gregorich, E.G .; Beare, M. H .; McKim, U.F .; Скьемстад, Дж. О. (2006). «Химические и биологические характеристики физически несложного органического вещества». Журнал Американского общества почвоведов. 70 (3): 975–985. Bibcode:2006SSASJ..70..975G. Дои:10.2136 / sssaj2005.0116.
- ^ Картер, М. Р. (1993). Отбор проб почвы и методы анализа. CRC Press.
- ^ а б c «Твердые органические вещества». Качество почвы для здоровья окружающей среды. NRCS.
- ^ а б c d е ж грамм Почва: формы и функции Викторианские ресурсы в Интернете. Обновлено 23 марта 2020 г.
 Текст был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Текст был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ а б Болдок Дж. А. и Скьемстад Дж. О. (1999) "Органический углерод почвы / органическое вещество почвы в почве". В KI Peverill, LA Sparrow и DJ Reuter (ред.) Анализ почвы: руководство по интерпретации, страницы 159–170, Организация научных и промышленных исследований Содружества, Мельбурн. ISBN 9780643063761
- ^ а б c Шесть, Дж .; Bossuyt, H .; Дегризе, С; Денеф, К. (2004). «История исследований связи между (микро) агрегатами, почвенной биотой и динамикой почвенного органического вещества». Исследования почвы и обработки почвы. 79 (1): 7–31. Дои:10.1016 / j.still.2004.03.008.
- ^ а б Харбуш, Дж. Дж., Клоуз, Х. Г., Ван Мой, Б. А., Арности, К., Смиттенберг, Р. Х., Ле Муань, Ф. А., Молленхауэр, Г., Шольц-Беттчер, Б., Обрехт, И., Кох, Б. П. и Беккер К. (2020) «Деконструированный твердый органический углерод: молекулярный и химический состав твердого органического углерода в океане». Границы морских наук, 7: 518. Дои:10.3389 / fmars.2020.00518.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ а б c d Оманд, М.М., Говиндараджан, Р., Хе, Дж. И Махадеван, А. (2020) «Тонущий поток твердых частиц органического вещества в океанах: чувствительность к характеристикам частиц». Природа: Научные отчеты, 10(1): 1–16. Дои:10.1038 / s41598-020-60424-5.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Бланшар, Дж. Л., Хенеган, Р. Ф., Эверетт, Дж. Д., Требилко, Р. и Ричардсон, А. Дж. (2017) «От бактерий до китов: использование спектров функциональных размеров для моделирования морских экосистем. Тенденции в экологии и эволюции», 32 (3), стр. 174-186. Дои:10.1016 / j.tree.2016.12.003.
- ^ Голландия, H.D. (2006) «Оксигенация атмосферы и океанов». Философские труды Королевского общества B: биологические науки, 361(1470): 903–915. Дои:10.1098 / rstb.2006.1838.
- ^ Хайнце, К., Мейер, С., Горис, Н., Андерсон, Л., Стейнфельд, Р., Чанг, Н., Кере, К. и Баккер, округ Колумбия (2015) «Поглотитель углерода в океане - воздействия, уязвимость и проблемы». Динамика системы Земли, 6(1): 327–358. Дои:10.5194 / esd-6-327-2015.
- ^ а б c d е ж грамм час я Гиринг, С.Л., Каван, Э.Л., Базедов, С.Л., Бриггс, Н., Бурд, А.Б., Дэрроч, Л.Дж., Гуиди, Л., Иррисон, Дж.О., Иверсен, М.Х., Кико, Р., Линдси, Д.Дж. (2020) «Тонущие органические частицы в океане - оценка потоков с помощью оптических устройств на месте». Дои:10.3389 / fmars.2019.00834.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Эппли, Р.В. и Петерсон, Б.Дж. (1979) "Поток твердых частиц органического вещества и планктонное новое образование в глубинах океана". Природа, 282(5740): 677–680. Дои:10.1038 / 282677a0.
- ^ Азецу-Скотт, Кумико; Пассов, Ута (2004). «Восходящие морские частицы: значение прозрачных экзополимерных частиц (ТЭП) в верхних слоях океана». Лимнология и океанография. 49 (3): 741–748. Bibcode:2004LimOc..49..741A. Дои:10.4319 / lo.2004.49.3.0741.
- ^ Acuña, JL; Лопес-Альварес, М .; Nogueira, E .; Гонсалес-Табоада, Ф. (2010). «Флотация диатомовых водорослей в начале весеннего цветения фитопланктона: эксперимент на месте». Серия "Прогресс морской экологии". 400: 115–125. Bibcode:2010MEPS..400..115A. Дои:10.3354 / meps08405.
- ^ а б Иверсен, М.Х., Пахомов, Е.А., Хант, Б.П., Ван дер Ягт, Х., Вольф-Гладроу, Д. и Клаас, К. (2017) «Грузило или поплавки? Вклад гранул сальпы в экспортный поток во время большого цветения. событие в Южном океане ». Deep Sea Research Part II: Актуальные исследования в океанографии, 138: 116–125. Дои:10.1016 / j.dsr2.2016.12.004.
- ^ Уайт, Фрэнк М. (2006). Течение вязкой жидкости. ISBN 9780071244930.
- ^ Гардес, Астрид; Iversen, Morten H .; Гроссарт, Ханс-Петер; Пассов, Ута; Ульрих, Маттиас С. (2011). «Диатомовые бактерии необходимы для агрегации Thalassiosira weissflogii». Журнал ISME. 5 (3): 436–445. Дои:10.1038 / ismej.2010.145. ЧВК 3105730. PMID 20827289.
- ^ Iversen, M. H .; Плуг, Х. (2013). «Влияние температуры на частоту углеродного дыхания и скорость опускания диатомовых агрегатов - потенциальные последствия для процессов глубоководного экспорта океана». Биогеонауки. 10 (6): 4073–4085. Bibcode:2013BGeo ... 10.4073I. Дои:10.5194 / bg-10-4073-2013.
- ^ Iversen, Morten H .; Роберт, Майя Л. (2015). «Эффекты балластировки смектита на формирование агрегатов и вынос из естественного планктонного сообщества». Морская химия. 175: 18–27. Дои:10.1016 / j.marchem.2015.04.009.
- ^ Иверсен, Мортен Хвитфельдт; Новальд, Николас; Ploug, Helle; Джексон, Джордж А .; Фишер, Герхард (2010). «Профили вертикального вывоза твердых частиц органического вещества с высоким разрешением у мыса Блан, Мавритания: процессы разложения и эффекты балластировки». Deep Sea Research Part I: Oceanographic Research Papers. 57 (6): 771–784. Bibcode:2010DSRI ... 57..771I. Дои:10.1016 / j.dsr.2010.03.007.
- ^ Иверсен, Мортен Хвитфельдт; Новальд, Николас; Ploug, Helle; Джексон, Джордж А .; Фишер, Герхард (2010). «Профили вертикального вывоза твердых частиц органического вещества с высоким разрешением у мыса Блан, Мавритания: процессы разложения и эффекты балластировки». Deep Sea Research Part I: Oceanographic Research Papers. 57 (6): 771–784. Bibcode:2010DSRI ... 57..771I. Дои:10.1016 / j.dsr.2010.03.007.
- ^ Хамм, Кристиан Э. (2002). «Интерактивная агрегация и седиментация диатомовых водорослей и глинистого литогенного материала». Лимнология и океанография. 47 (6): 1790–1795. Bibcode:2002LimOc..47.1790H. Дои:10.4319 / lo.2002.47.6.1790.
- ^ Пассов, Ута; де ла Роша, Кристина Л .; Фэрфилд, Кейтлин; Шмидт, Катрин (2014). «Агрегация как функция минеральных частиц и частиц». Лимнология и океанография. 59 (2): 532–547. Bibcode:2014LimOc..59..532P. Дои:10.4319 / lo.2014.59.2.0532.
- ^ Азецу-Скотт, Кумико; Пассов, Ута (2004). «Восходящие морские частицы: значение прозрачных экзополимерных частиц (ТЭП) в верхних слоях океана». Лимнология и океанография. 49 (3): 741–748. Bibcode:2004LimOc..49..741A. Дои:10.4319 / lo.2004.49.3.0741.
- ^ Бочданский, Александр Б .; Клаус, Мелисса А .; Херндль, Герхард Дж. (2016). «Драконы-короли морских глубин: морские частицы заметно отклоняются от обычного числового спектра». Научные отчеты. 6: 22633. Bibcode:2016НатСР ... 622633Б. Дои:10.1038 / srep22633. ЧВК 4778057. PMID 26940454.
- ^ Лонг, Марк; Морисо, Бриваэла; Галлинари, Морган; Ламберт, Кристоф; Хювет, Арно; Раффре, Жан; Судан, Филипп (2015). «Взаимодействие между микропластиками и агрегатами фитопланктона: влияние на их судьбы». Морская химия. 175: 39–46. Дои:10.1016 / j.marchem.2015.04.003.
- ^ Passow, U .; Sweet, J .; Francis, S .; Xu, C .; Диссанаяке, Алабама; Линь, ГГ; Санчи, PH; Куигг, А. (2019). «Включение масла в агрегаты диатомовых водорослей». Серия "Прогресс морской экологии". 612: 65–86. Bibcode:2019MEPS..612 ... 65P. Дои:10.3354 / meps12881.
- ^ Иверсен, Мортен Хвитфельдт; Новальд, Николас; Ploug, Helle; Джексон, Джордж А .; Фишер, Герхард (2010). «Профили вертикального вывоза твердых частиц органического вещества с высоким разрешением у мыса Блан, Мавритания: процессы разложения и эффекты балластировки». Deep Sea Research Part I: Oceanographic Research Papers. 57 (6): 771–784. Bibcode:2010DSRI ... 57..771I. Дои:10.1016 / j.dsr.2010.03.007.
- ^ Iversen, Morten H .; Роберт, Майя Л. (2015). «Эффекты балластировки смектита на формирование агрегатов и вынос из естественного планктонного сообщества». Морская химия. 175: 18–27. Дои:10.1016 / j.marchem.2015.04.009.
- ^ Taucher, J .; Бах, Л. Т .; Riebesell, U .; Oschlies, A. (2014). «Влияние вязкости на поток морских частиц: механизм обратной связи, влияющий на климат» (PDF). Глобальные биогеохимические циклы. 28 (4): 415–422. Bibcode:2014GBioC..28..415T. Дои:10.1002 / 2013GB004728.
- ^ Жуанде, Мари-Поль; Трулль, Томас У .; Гуиди, Лайонел; Пишераль, Марк; Эберсбах, Фридерике; Стемманн, Ларс; Блейн, Стефан (2011). «Оптическое изображение мезопелагических частиц указывает на глубокий поток углерода под естественным цветением, обогащенным железом, в Южном океане». Лимнология и океанография. 56 (3): 1130–1140. Bibcode:2011LimOc..56.1130J. Дои:10.4319 / lo.2011.56.3.1130.
- ^ Вайдель, Брайан; Соломон, Кристофер Т .; Пейс, Майкл Л .; Китчелл, Джим; Карпентер, Стивен Р .; Коул, Джонатан Дж. (01.02.2011). «Веские доказательства наземной поддержки зоопланктона в малых озерах на основе стабильных изотопов углерода, азота и водорода». Труды Национальной академии наук. 108 (5): 1975–1980. Bibcode:2011PNAS..108.1975C. Дои:10.1073 / pnas.1012807108. ISSN 0027-8424. ЧВК 3033307. PMID 21245299.
- ^ Канкаала, Паула; Страндберг, Урсула; Киммо К. Кахилайнен; Aalto, Sanni L .; Galloway, Aaron W. E .; Тайпале, Сами Дж. (11 августа 2016 г.). «Наземные углеводы поддерживают пресноводный зоопланктон во время дефицита фитопланктона». Научные отчеты. 6: 30897. Bibcode:2016НатСР ... 630897Т. Дои:10.1038 / srep30897. ISSN 2045-2322. ЧВК 4980614. PMID 27510848.
- ^ Басу, С. и Макки, К. (2018) «Фитопланктон как ключевые медиаторы биологического углеродного насоса: их реакция на изменение климата». Устойчивость, 10(3): 869. Дои:10.3390 / su10030869.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Пассов У. и Карлсон К.А. (2012) «Биологический насос в мире с высоким содержанием CO2». Серия "Прогресс морской экологии", 470: 249–271. Дои:10.3354 / meps09985.
- ^ а б c d Тернер, Дж. (2015) «Фекальные гранулы зоопланктона, морской снег, фитодетрит и биологический насос океана». Прогресс в океанографии, 130: 205–248. Дои:10.1016 / j.pocean.2014.08.005
- ^ Volk, T. и Hoffert, M.I. (1985) «Углеродные насосы в океане: анализ относительной силы и эффективности изменений СО2 в атмосфере, вызванных океаном. В: Углеродный цикл и атмосферный CO2: естественные вариации от архея до настоящего времени, страницы 99–110, Калифорнийский университет. ISBN 9780875900605.
- ^ Giering, S.L. и Хамфрис, М. (2018) «Биологический насос». В: Энциклопедия геохимии, W. White (Ed.) Cham: Springer, страницы 1–6. Дои:10.1007/978-3-319-39193-9_154-1.
- ^ Уэйт А.М., Сафи К.А., Холл Дж. и Ноддер, С. (2000) «Массовое осаждение пикопланктона в органических агрегатах». Лимнология и океанография, 45(1): 87–97. Дои:10.4319 / lo.2000.45.1.0087.
- ^ Иверсен, М. и Поульсен, Л. (2007) «Копрорекси, копрофагия и копрохалия у веслоногих ракообразных. Calanus helgolandicus, Pseudocalanus elongatus, и Oithona similis". Серия "Прогресс морской экологии", 350: 79–89. Дои:10.3354 / meps07095.
- ^ Поульсен, Л. и Иверсен, М. (2008) «Деградация фекальных гранул веслоногих ракообразных: ключевая роль протозоопланктона». Серия "Прогресс морской экологии", 367: 1–13. Дои:10.3354 / meps07611.
- ^ Иверсен, М.Х., Новальд, Н., Плуг, Х., Джексон, Г.А. и Фишер, Г. (2010) «Профили вертикального вывоза твердых частиц органического вещества с высоким разрешением у мыса Блан, Мавритания: процессы разложения и эффекты балластировки». Deep Sea Research Part I: Oceanographic Research Papers, 57(6): 771–784. Дои:10.1016 / j.dsr.2010.03.007.
- ^ Гиринг, С.Л., Сандерс, Р., Лэмпит, Р.С., Андерсон, Т.Р., Тамбурини, К., Бутриф, М., Зубков, М.В., Марсей, С.М., Хенсон, С.А., Пила, К., Кук, К. (2014 г. ) «Согласование баланса углерода в сумеречной зоне океана». Природа, 507(7493): 480–483. Дои:10.1038 / природа13123.
- ^ Свенсен, К., Мората, Н. и Рейгстад, М. (2014) «Повышенное разложение фекальных гранул веслоногих рачков за счет взаимодействия динофлагеллятов и Centropages hamatus". Серия "Прогресс морской экологии", 516: 61–70. Дои:10,3354 / meps10976.
- ^ Стейнберг, Д.К., Карлсон, С.А., Бейтс, Н.Р., Голдтуэйт, С.А., Мадин, Л.П. и Майклс, А.Ф. (2000) "Вертикальная миграция зоопланктона и активный транспорт растворенного органического и неорганического углерода в Саргассовом море". Deep Sea Research Part I: Oceanographic Research Papers, 47(1): 137–158. Дои:10.1016 / S0967-0637 (99) 00052-7.
- ^ Йонасдоттир, С.Х., Виссер, А.В., Ричардсон, К. и Хит, М.Р. (2015) «Сезонный липидный насос веслоногих ракообразных способствует секвестрации углерода в глубинах Северной Атлантики». Труды Национальной академии наук, 112(39): 12122–12126. Дои:10.1073 / pnas.1512110112.
- ^ Кико, Р., Биасточ, А., Брандт, П., Краватт, С., Хаус, Х., Хаммельс, Р., Крест, И., Марин, Ф., Макдоннелл, А.М., Ошлис, А. и Пишерал , М. (2017) «Биологические и физические воздействия на морской снегопад на экваторе». Природа Геонауки, 10(11): 852–858. Дои:10.1038 / ngeo3042.
- ^ Хенсон, С.А., Сандерс, Р., Мэдсен, Э., Моррис, П.Дж., Ле Муань, Ф. и Куартли, Г.Д. (2011) «Уменьшенная оценка силы биологического углеродного насоса океана». Письма о геофизических исследованиях, 38(4). Дои:10.1029 / 2011GL046735.
- ^ Гуиди, Л., Лежандр, Л., Рейгондо, Г., Уитц, Дж., Стемманн, Л. и Хенсон, С.А. (2015) "Новый взгляд на реминерализацию углерода океана для оценки глубоководного связывания". Глобальные биогеохимические циклы, 29(7): 1044–1059. Дои:10.1002 / 2014GB005063.
- ^ а б Квон, Е.Ю., Примо, Ф. и Сармиенто, Дж. Л. (2009) "Влияние глубины реминерализации на баланс углерода в воздухе и море". Природа Геонауки, 2(9): 630–635. Дои:10.1038 / ngeo612.
- ^ Пассов У. и Карлсон К.А. (2012) «Биологический насос в мире с высоким содержанием CO2». Серия "Прогресс морской экологии", 470: 249–271. Дои:10.3354 / meps09985.
- ^ а б c Иверсен, М. и Плуг, Х. (2010) «Балластные минералы и опускающийся поток углерода в океане: удельная скорость дыхания углерода и скорость опускания скоплений морского снега». Биогеонауки, 7: 2613–2624. Дои:10.5194 / bg-7-2613-2010.
- ^ Reygondeau, G., Guidi, L., Beaugrand, G., Henson, S.A., Koubbi, P., MacKenzie, B.R., Sutton, T.T., Fioroni, M. and Maury, O. (2018) "Global biogeochemical provinces of the mesopelagic zone". Журнал биогеографии, 45(2): 500–514. Дои:10.1111/jbi.13149.
- ^ Ploug, H., Iversen, M.H., Koski, M. and Buitenhuis, E.T. (2008) "Production, oxygen respiration rates, and sinking velocity of copepod fecal pellets: direct measurements of ballasting by opal and calcite". Лимнология и океанография, 53(2): 469–476. Дои:10.4319/lo.2008.53.2.0469.
- ^ Ploug, H., Iversen, M.H. and Fischer, G. (2008) "Ballast, sinking velocity, and apparent diffusivity within marine snow and zooplankton fecal pellets: Implications for substrate turnover by attached bacteria". Лимнология и океанография, 53(5): 1878–1886. Дои:10.4319/lo.2008.53.5.1878.
- ^ Kiørboe, T., Saiz, E. and Visser, A. (1999) "Hydrodynamic signal perception in the copepod Acartia tonsa". Серия "Прогресс морской экологии", 179: 97–111. Дои:10.3354/meps179097.
- ^ Visser, A.W. (2001) "Hydromechanical signals in the plankton". Серия "Прогресс морской экологии", 222: 1–24. Дои:10.3354/meps222001.
- ^ Visser, A.W. and Jackson, G.A. (2004) "Characteristics of the chemical plume behind a sinking particle in a turbulent water column". Серия "Прогресс морской экологии", 283: 55–71. Дои:10.3354/meps283055.
- ^ Azam, Farooq; Long, Richard A. (2001). "Sea snow microcosms". Природа. 414 (6863): 495–498. Дои:10.1038/35107174. PMID 11734832. S2CID 5091015.
- ^ а б c Tanet, Lisa; Martini, Séverine; Casalot, Laurie; Tamburini, Christian (2020). "Reviews and syntheses: Bacterial bioluminescence – ecology and impact in the biological carbon pump". Биогеонауки. 17 (14): 3757–3778. Bibcode:2020BGeo...17.3757T. Дои:10.5194/bg-17-3757-2020.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Kiørboe, Thomas (2011). "How zooplankton feed: Mechanisms, traits and trade-offs". Биологические обзоры. 86 (2): 311–339. Дои:10.1111/j.1469-185X.2010.00148.x. PMID 20682007. S2CID 25218654.
- ^ Kiørboe, Thomas; Jackson, George A. (2001). "Marine snow, organic solute plumes, and optimal chemosensory behavior of bacteria". Лимнология и океанография. 46 (6): 1309–1318. Дои:10.4319/lo.2001.46.6.1309.


