Растворенный органический углерод - Dissolved organic carbon

| Часть серии о |
| Цикл углерода |
|---|
 |
Растворенный органический углерод (DOC) - доля органический углерод оперативно определенный как то, что может проходить через фильтр с размером пор обычно от 0,22 до 0,7 микрометры.[2] Оставшаяся на фильтре фракция называется органический углерод в виде твердых частиц (POC).[3]
Растворенное органическое вещество (РОВ) это тесно связанный термин, который часто используется как синоним DOC. В то время как DOC относится конкретно к массе углерода в растворенном органическом материале, DOM относится к общей массе растворенного органического вещества. Таким образом, DOM также включает массу других элементов, присутствующих в органическом материале, таких как азот, кислород и водород. DOC - это компонент DOM, и его обычно примерно в два раза больше, чем DOC.[4] Многие утверждения, которые можно сделать о DOC, в равной степени применимы и к DOM, и наоборот.
DOC в изобилии морской и пресная вода систем и является одним из величайших резервуаров циклического органическая материя на Земле, что составляет такое же количество углерод как в атмосфере, и до 20% всего органического углерода.[5] В целом, органический углерод соединения являются результатом разложение процессы из мертвого органического вещества, включая растения и животных. DOC может происходить как внутри, так и снаружи любого водоема. DOC, происходящий из водоема, известен как автохтонный DOC и обычно происходит из водные растения или же водоросли, в то время как DOC, происходящий за пределами водоема, известен как аллохтонный DOC и обычно происходит из почвы или же наземные растения.[6] Когда вода поступает с участков суши с высокой долей органических почв, эти компоненты могут стекать в реки и озера в виде DOC.
Морской пул DOC важен для функционирования морских экосистем, поскольку они находятся на границе между химическим и биологическим мирами. DOC топливо морские пищевые сети, и является основным компонентом земного круговорот углерода.[7]
Обзор

DOC - это основное питательное вещество, поддерживающее рост микроорганизмы и играет важную роль в мировом цикл углерода сквозь микробная петля.[10] У некоторых организмов (стадий), которые не питаются в традиционном смысле, растворенное вещество может быть единственным внешним источником пищи.[11] Более того, DOC является индикатором органических нагрузок в ручьях, а также поддерживает наземную переработку (например, в почве, лесах и заболоченных территориях) органического вещества. Растворенный органический углерод имеет высокую долю биоразлагаемого растворенного органического углерода (BDOC) в потоках первого порядка по сравнению с потоками более высокого порядка. При отсутствии обширных водно-болотные угодья, болота, или же болота, концентрации DOC в базовом потоке в ненарушенных водоразделах обычно составляют приблизительно от 1 до 20 мг / л углерода.[12] Концентрации углерода значительно различаются в зависимости от экосистемы. Например, Эверглейдс может быть около верхней границы диапазона, а середина океанов может быть около дна. Иногда высокие концентрации органического углерода указывают на антропогенное влияние, но большая часть DOC возникает естественным образом.[13]
В BDOC фракция состоит из органических молекулы который гетеротрофный бактерии можно использовать как источник энергии и углерода. [14] Некоторая подгруппа DOC представляет собой предшественников побочных продуктов дезинфекции питьевой воды.[15] BDOC может способствовать нежелательному биологическому возобновлению роста в системах распределения воды.[16]
Растворенная фракция общий органический углерод (TOC) - это классификация операций. Многие исследователи используют термин «растворенные» для соединений, которые проходят через фильтр 0,45 мкм, но фильтры 0,22 мкм также используются для удаления более высоких концентраций коллоидов.
Практическое определение растворенного, обычно используемое в морская химия это все вещества, которые проходят через фильтр GF / F с номинальным размером пор примерно 0,7 мкм (фильтр из стекловолокна Whatman, задерживающий частицы 0,6–0,8 мкм[17]). Рекомендуемая процедура - это HTCO метод, который требует фильтрации через предварительно обожженные фильтры из стекловолокна, обычно по классификации GF / F.[18]
Лабильный и непокорный
Растворенное органическое вещество можно классифицировать как лабильное или стойкое, в зависимости от его реакционной способности. Непокорный DOC также называют огнеупорный DOC, и эти термины, кажется, используются как синонимы в контексте DOC. В зависимости от происхождения и состава DOC его поведение и цикличность различаются; лабильная фракция DOC быстро разлагается в результате процессов, опосредованных микробами или фотохимически, тогда как тугоплавкий DOC устойчив к разложению и может сохраняться в океане на протяжении тысячелетий. В прибрежных водах океана органическое вещество из опада наземных растений или почв оказывается более стойким.[19] и поэтому часто ведет себя консервативно. Кроме того, огнеупорный ДОУ образуется в океане в результате бактериальной трансформации лабильного ДОУ, что меняет его состав.[20][21][22]
Из-за непрерывного производства и разложения в естественных системах пул DOC содержит спектр реакционноспособных соединений, каждое со своей реакционной способностью,[23] которые были разделены на фракции от лабильных до непокорных, в зависимости от времени оборота,[24] как показано в следующей таблице ...
| Фракция DOC | акроним | время оборота | количество |
|---|---|---|---|
| лабильный | DOCL | часы в дни | <200 тг C |
| полустабильный | DOCSL | недели в месяцы | ∼600 тг C |
| полу-непокорный | DOCSR | десятилетия | ∼1400 тг C |
| непокорный | DOCR | тысячи лет | ∼63000 тг C |
| очень стойкий | десятки тысяч лет | ||
Этот широкий диапазон времени оборота или разложения был связан с химическим составом, структурой и размером молекул,[25][26] но разложение также зависит от условий окружающей среды (например, питательных веществ), разнообразия прокариот, окислительно-восстановительного состояния, доступности железа, ассоциаций минеральных частиц, температуры, воздействия солнечного света, биологического производства устойчивых соединений и эффекта прайминга или разбавления отдельных молекулы.[25][27][28][29][30][31] Например, лигнин может разлагаться в аэробных почвах, но он относительно устойчив в бескислородных морских отложениях.[32] Этот пример показывает, что биодоступность зависит от свойств экосистемы. Соответственно, даже обычно древние и стойкие соединения, такие как нефть, алициклические молекулы, богатые карбоксилом, могут разлагаться в соответствующих условиях окружающей среды.[33][34]
Наземные экосистемы
Почва


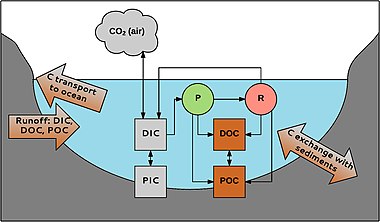
P = фотосинтез R = дыхание
Растворенное органическое вещество (РОВ) является одним из наиболее активных и мобильных углеродных резервуаров и играет важную роль в глобальном круговороте углерода.[41] Кроме того, растворенный органический углерод (DOC) влияет на отрицательные электрические заряды почвы. денитрификация процесс, кислотно-основные реакции в почвенном растворе задержка и перемещение питательных веществ (катионы ) и иммобилизация тяжелые металлы и ксенобиотики.[42] Почвенный РОВ может быть получен из различных источников (входов), таких как атмосферный углерод, растворенный в осадках, подстилке и растительных остатках, навозе, корневых выделениях и разложении почвенного органического вещества (ПОВ). В почве доступность РОВ зависит от его взаимодействия с минеральными компонентами (например, глинами, оксидами Fe и Al), которые модулируются: адсорбция и десорбция процессы.[43] Это также зависит от фракций ПОВ (например, стабилизированных органических молекул и микробной биомассы) в результате процессов минерализации и иммобилизации. Кроме того, интенсивность этих взаимодействий изменяется в зависимости от свойств почвы,[44] землепользование и растениеводство.[43][35]
При разложении органического материала большая часть углерода теряется в виде CO.2 в атмосферу путем микробного окисления. Тип почвы и ландшафтный склон, выщелачивание, и сток также являются важными процессами, связанными с потерями РОВ в почве.[45] В хорошо дренированных почвах выщелоченный ДОУ может достигать уровень грунтовых вод и высвобождают питательные вещества и загрязнители, которые могут загрязнять грунтовые воды,[46][47] тогда как сток переносит DOM и ксенобиотики в другие районы, реки и озера.[35]
Грунтовые воды
Осадки и поверхностные воды вымывают растворенный органический углерод (DOC) из растительности и подстилка и просачивается через столб почвы в насыщенная зона. Концентрация, состав и биодоступность DOC изменяются во время транспортировки через толщу почвы под действием различных физико-химических и биологических процессов, включая сорбция, десорбция, биоразложение и биосинтез. Гидрофобный молекулы предпочтительно распределяются по минералам почвы и имеют более длительное время удерживания в почве, чем гидрофильный молекулы. Гидрофобность и время удерживания коллоидов и растворенных молекул в почве зависят от их размера, полярности, заряда и биодоступность. Биодоступный РОВ подвергается микробному разложению, что приводит к уменьшению размера и молекулярной массы. Новые молекулы синтезируются почвенные микробы, и некоторые из этих метаболитов попадают в резервуар DOC в грунтовых водах.[36]
Пресноводные экосистемы
Водный углерод встречается в разных формах. Во-первых, проводится разделение на органический и неорганический углерод. Органический углерод представляет собой смесь органических соединений, происходящих из детрита или первичных продуцентов. Его можно разделить на POC (органический углерод в виде твердых частиц; частицы> 0,45 мкм) и DOC (растворенный органический углерод; частицы <0,45 мкм). DOC обычно составляет 90% от общего количества органического углерода в воде. Его концентрация колеблется от 0,1 до> 300 мг / л.[48]
Точно так же неорганический углерод также состоит из твердых частиц (PIC) и растворенной фазы (DIC). PIC в основном состоит из карбонаты (например, CaCO3), DIC состоит из карбоната (CO32-), бикарбонат (HCO3-), CO2 и пренебрежимо малая доля угольная кислота (H2CO3). Неорганические углеродные соединения находятся в равновесии, которое зависит от pH воды.[49] Концентрации DIC в пресной воде колеблются от примерно нуля в кислых водах до 60 мг C / л в районах с богатыми карбонатами отложениями.[50]
POC можно разложить с образованием DOC; DOC может стать POC флокуляция. Неорганический и органический углерод связаны через водные организмы. CO2 используется в фотосинтез (P), например макрофиты, произведено дыхание (R), и обменялись с атмосферой. Органический углерод вырабатывается организмами и выделяется во время и после их жизни; например, в реках 1–20% от общего количества DOC производится макрофитами.[38] Углерод может поступать в систему из водосборного бассейна и переносится в океаны реками и ручьями. Также происходит обмен с углеродом в отложениях, например, захоронение органического углерода, что важно для связывание углерода в водных средах обитания.[51]
Водные системы очень важны в глобальном связывании углерода; например, когда сравниваются различные европейские экосистемы, внутренние водные системы образуют второй по величине сток углерода (19–41 Тг C y-1); только леса поглощают больше углерода (125–223 Тг C y-1).[52][37]
Морские экосистемы

Источники
В морских системах DOC происходит от автохтонный или же аллохтонный источники. Автохтонный ДОУ производится в системе, в основном, за счет планктонных организмов. [53][54] а в прибрежных водах дополнительно бентосными микроводорослями, бентосными потоками и макрофитами,[55] тогда как аллохтонный РОУ в основном имеет наземное происхождение и дополняется грунтовыми водами и атмосферными поступлениями.[56][57] Помимо почвенного гуминовые вещества, наземный DOC также включает материал выщелоченный от растений, экспортированных во время дождя, выбросов растительных материалов в атмосферу и осаждения в водной среде (например, летучий органический углерод и пыльца), а также тысячи синтетических искусственных органических химикатов, которые можно измерить в океане в следовых концентрациях.[58][59][7]
Фитопланктон
Фитопланктон производит ДОУ путем внеклеточный выпуск обычно составляет от 5 до 30% их общей первичной продукции,[60] хотя это варьируется от вида к виду.[61] Тем не менее, это высвобождение внеклеточного DOC усиливается при ярком освещении и низком уровне питательных веществ и, следовательно, должно увеличиваться относительно от эвтрофных к олиготрофным областям, вероятно, как механизм рассеивания клеточной энергии.[62] Фитопланктон также может производить DOC за счет автолиз во время физиологических стрессовых ситуаций, например, при ограничении питательных веществ.[63] Другие исследования продемонстрировали производство DOC в связи с питанием мезо- и макрозоопланктона фитопланктоном и бактериями.[64][7]
Зоопланктон
Опосредованное зоопланктоном высвобождение DOC происходит через небрежное кормление, выделения и дефекация, которые могут быть важными источниками энергии для микробов.[65][64] Такое производство DOC является самым большим в периоды высокой концентрации пищи и преобладания крупных видов зоопланктона.[66][7]
Бактерии и вирусы
Бактерии часто рассматриваются как основные потребители DOC, но они также могут производить DOC во время деление клеток и вирусный лизис.[67][68][69] Биохимические компоненты бактерий в основном такие же, как и у других организмов, но некоторые соединения клеточной стенки уникальны и используются для отслеживания DOC, полученного из бактерий (например, пептидогликан ). Эти соединения широко распространены в океане, что позволяет предположить, что производство DOC бактериями может иметь важное значение в морских системах.[70] Вирусы - это самая многочисленная форма жизни в Мировом океане, заражающая все формы жизни, включая водоросли, бактерии и зоопланктон.[71] После заражения вирус либо переходит в спящий (лизогенный ) или продуктивный (литический ) государственный.[72] Литический цикл вызывает разрушение клетки (клеток) и высвобождение DOC.[73][7]

Справа: микробная петля, в которой бактерии используют растворенный органический углерод для получения биомассы, которая затем снова попадает в классический поток углерода через протистов.[74][75]

Макрофиты
морской макрофиты (т.е. макроводоросли и водоросли ) являются высокопродуктивными и распространяются на большие площади в прибрежных водах, но их производству DOC не уделялось особого внимания. Макрофиты выделяют DOC во время роста с консервативной оценкой (исключая высвобождение из разлагающихся тканей), предполагая, что высвобождение макроводорослей составляет 1-39% от их валовой первичной продукции,[77][78] в то время как морские травы выделяют менее 5% DOC от их валовой первичной продукции.[79] Было показано, что выпущенный DOC богат углеводами, причем их количество зависит от температуры и доступности света.[80][81] Было высказано предположение, что в глобальном масштабе сообщества макрофитов продуцируют ~ 160 Тг C год – 1 DOC, что составляет примерно половину годового поступления DOC в глобальные реки (250 Тг C год – 1).[80][7]
Морские отложения

Морские отложения представляют собой основные места деградации и захоронения ОВ в океане, где находятся микробы с плотностью до 1000 раз выше, чем в столб воды.[83] Концентрации РОУ в отложениях часто на порядок выше, чем в вышележащей водной толще.[84] Эта разница концентраций приводит к продолжающемуся диффузионному потоку и позволяет предположить, что отложения являются основным источником РОУ, выделяя 350 Тг С / год, что сопоставимо с поступлением РОУ из рек.[85] Эта оценка основана на рассчитанных диффузионных потоках и не включает события повторного взвешивания, которые также высвобождают DOC. [86] и поэтому оценка может быть консервативной. Кроме того, некоторые исследования показали, что геотермальные системы и просачивание нефти вносят свой вклад с предварительно состаренным DOC в глубокие слои. бассейны океана,[87][88] но последовательных глобальных оценок общего вклада в настоящее время нет. Глобально, грунтовые воды составляют неизвестную часть притока DOC пресной воды в океаны.[89] DOC в грунтовых водах представляет собой смесь наземных, инфильтрованных морских и микробиологических материалов, полученных на месте.[90] Этот поток DOC в прибрежные воды может быть важным, поскольку его концентрации в грунтовых водах обычно выше, чем в прибрежной морской воде.[91] но надежных глобальных оценок в настоящее время также нет.[7]
Раковины
Основными процессами, которые удаляют DOC из водной толщи океана, являются: (1) Термическая деградация, например, подводные гидротермальные системы;[92] (2) пузырь коагуляция и абиотический флокуляция в микрочастицы [93] или же сорбция к частицам;[94] (3) абиотическая деградация через фотохимические реакции;[95][96] и (4) биотическая деградация к гетеротрофный морские прокариоты.[97] Было высказано предположение, что комбинированные эффекты фотохимической и микробной деградации представляют собой основные поглотители DOC.[98][7]
Термическая деградация
 Удаление огнеупорного DOC в океанеПроизводство фитопланктона и динамика пищевых цепей в поверхностных водах высвобождают разнообразную смесь растворенных молекул с различной реакционной способностью. Бактерии и археи используют лабильные и полу-лабильные формы DOC в поверхностных и мезопелагических водах верхнего слоя океана, оставляя после себя обширный резервуар тугоплавкого DOC (RDOC), который сохраняется в океане на протяжении тысячелетий. Океан представляет собой неоднородную среду, в которой обитает большое разнообразие микробов и физико-химических процессов, способных удалить тугоплавкий DOC, когда эти молекулы встречаются с условиями окружающей среды и микробами, которые могут их разлагать. Физическое перемешивание переносит огнеупорный DOC по всему океану и, таким образом, увеличивает вероятность его удаления. Глубоководные океанические воды могут быть вовлечены в гидротермальную циркуляцию, а связанный с ними РОУ может быть удален путем термического разложения. Тонущие частицы из верхних слоев океана высвобождают лабильный DOC (LDOC), который запускает горячие точки микробной активности и способствует удалению тугоплавких молекул. Смешивание подземных вод с солнечными водами подвергает огнеупорный DOC воздействию более высоких температур и фотохимических процессов, которые могут минерализовать и преобразовывать тугоплавкие молекулы в простые соединения (например, пируват, формальдегид) для быстрого микробного использования. Таким образом, похоже, что время жизни тугоплавких молекул в океане регулируется скоростью глобальной опрокидывающейся циркуляции (GOC). Это соотношение указывает на замедление ГПЦ может привести к увеличению размера резервуара из огнеупорного DOC, предполагая постоянную скорость производства огнеупорного DOC (вставка панели).[99]
Удаление огнеупорного DOC в океанеПроизводство фитопланктона и динамика пищевых цепей в поверхностных водах высвобождают разнообразную смесь растворенных молекул с различной реакционной способностью. Бактерии и археи используют лабильные и полу-лабильные формы DOC в поверхностных и мезопелагических водах верхнего слоя океана, оставляя после себя обширный резервуар тугоплавкого DOC (RDOC), который сохраняется в океане на протяжении тысячелетий. Океан представляет собой неоднородную среду, в которой обитает большое разнообразие микробов и физико-химических процессов, способных удалить тугоплавкий DOC, когда эти молекулы встречаются с условиями окружающей среды и микробами, которые могут их разлагать. Физическое перемешивание переносит огнеупорный DOC по всему океану и, таким образом, увеличивает вероятность его удаления. Глубоководные океанические воды могут быть вовлечены в гидротермальную циркуляцию, а связанный с ними РОУ может быть удален путем термического разложения. Тонущие частицы из верхних слоев океана высвобождают лабильный DOC (LDOC), который запускает горячие точки микробной активности и способствует удалению тугоплавких молекул. Смешивание подземных вод с солнечными водами подвергает огнеупорный DOC воздействию более высоких температур и фотохимических процессов, которые могут минерализовать и преобразовывать тугоплавкие молекулы в простые соединения (например, пируват, формальдегид) для быстрого микробного использования. Таким образом, похоже, что время жизни тугоплавких молекул в океане регулируется скоростью глобальной опрокидывающейся циркуляции (GOC). Это соотношение указывает на замедление ГПЦ может привести к увеличению размера резервуара из огнеупорного DOC, предполагая постоянную скорость производства огнеупорного DOC (вставка панели).[99]
Термическая деградация РОУ обнаружен на высокотемпературных гидротермальных флангах хребтов, где концентрации РОУ на выходе ниже, чем в притоке. Хотя глобальное влияние этих процессов не исследовалось, текущие данные позволяют предположить, что это незначительный сток DOC.[100] Абиотическая флокуляция DOC часто наблюдается во время быстрых (минут) сдвигов солености при смешивании пресной и морской воды.[101] Флокуляция изменяет химический состав DOC за счет удаления гуминовый соединений и уменьшения размера молекул, превращая DOC в органические хлопья в виде частиц, которые могут осаждаться и / или потребляться травоям и питатели-фильтры, но он также стимулирует бактериальную деградацию флокулированного DOC.[102] Воздействие флокуляции на удаление DOC из прибрежных вод сильно различается, и некоторые исследования показывают, что он может удалить до 30% пула DOC,[103][104] в то время как другие находят гораздо более низкие значения (3–6%;[105]). Такие различия можно объяснить сезонными и системными различиями в химическом составе ДОУ, pH, концентрации катионов металлов, микробной реактивности и ионной силе.[101][106][7]
CDOM
В цветная фракция DOC (CDOM) поглощает свет в диапазоне синего и ультрафиолетового света и, следовательно, влияет на продуктивность планктона как отрицательно, поглощая свет, который в противном случае был бы доступен для фотосинтеза, так и положительно, защищая организмы планктона от вредного ультрафиолетового света.[107][108] Однако, поскольку воздействие ультрафиолетового излучения и способность к восстановлению чрезвычайно разнообразны, нет единого мнения о том, как изменения ультрафиолетового света могут повлиять на общие сообщества планктона.[109][110] Поглощение света CDOM инициирует комплекс фотохимических процессов, которые могут влиять на химический состав питательных веществ, следов металлов и DOC, а также способствовать разложению DOC.[111]
Фотодеградация
Фотодеградация включает преобразование CDOM в более мелкие и менее окрашенные молекулы (например, органические кислоты) или в неорганический углерод (CO, CO2) и питательные соли (NH + 4, HPO2−4).[112][113][114] Следовательно, это обычно означает, что фотодеградация превращает непокорные молекулы в лабильные молекулы DOC, которые могут быстро использоваться прокариотами для производства биомассы и дыхания. Однако он также может увеличить CDOM за счет преобразования таких соединений, как триглицериды, в более сложные ароматические соединения,[115][116] которые менее подвержены разложению микробами. Кроме того, УФ-излучение может производить, например, активные формы кислорода, которые вредны для микробов.[117] Воздействие фотохимических процессов на пул DOC зависит также от химического состава,[118] некоторые исследования предполагают, что недавно произведенный автохтонный DOC становится менее биодоступным, в то время как аллохтонный DOC становится более биодоступным для прокариот после воздействия солнечного света, хотя другие обнаружили обратное.[119][120][121] Фотохимические реакции особенно важны в прибрежных водах, которые получают высокие нагрузки наземного производного РОВ, при этом примерно 20–30% наземного РОУ быстро фотодеградируется и расходуется.[122] Глобальные оценки также предполагают, что в морских системах фотодеградация DOC производит ~ 180 Тг C год – 1 неорганического углерода, при этом дополнительные 100 Тг C год – 1 DOC становятся более доступными для микробной деградации.[123][124] Другая попытка оценки глобального океана также предполагает, что фотодеградация (210 Тг C год – 1) примерно такая же, как годовое глобальное поступление DOC в реках (250 Тг C год – 1;[125]), в то время как другие предполагают, что прямое фотодеградация превышает поступление РОУ в реках.[126][127][7]
Непокорный DOC

Распределение
Более точные методы измерения, разработанные в конце 1990-х годов, позволили хорошо понять, как растворенный органический углерод распределяется в морской среде как по вертикали, так и по поверхности.[128] Теперь понятно, что растворенный органический углерод в океане охватывает диапазон от очень лабильный до очень непокорных (тугоплавких). Лабильный растворенный органический углерод в основном вырабатывается морскими организмами и потребляется на поверхности океана и состоит из сахаров, белков и других соединений, которые легко используются морские бактерии.[129] Непоколебимый растворенный органический углерод равномерно распределен по толщине воды и состоит из высокомолекулярных и структурно сложных соединений, которые трудно использовать морским организмам, например, лигнин, пыльца, или же гуминовые кислоты.[130] Таким образом, наблюдаемое вертикальное распределение состоит из высоких концентраций лабильного РОУ в верхнем слое воды и низких концентраций на глубине.
 Экологические процессы, контролирующие очевидную сопротивляемость океанического DOCТочки представляют молекулы DOC, а стрелки представляют физико-химические и биологические процессы, которые влияют на концентрацию DOC и молекулярный состав. В поверхностном слое океана ДОУ, полученный в результате первичной продукции, быстро реминерализуется или трансформируется в результате микробной деградации (черная стрелка), фотохимической деградации (желтая стрелка) или обмена частицами (зеленая стрелка). Лабильные компоненты удаляются в толщу воды, и DOC становится разбавленным в результате таких процессов, как обмен частиц (коричневая стрелка), растворение осадка (серая стрелка) и микробная переработка (белая стрелка), которые продолжают изменять, добавлять и / или удалять молекулы из общего пула DOC. Таким образом, очевидная сопротивляемость DOC в глубинах океана - это возникающее свойство, которое в значительной степени контролируется окружающей средой.[76]
Экологические процессы, контролирующие очевидную сопротивляемость океанического DOCТочки представляют молекулы DOC, а стрелки представляют физико-химические и биологические процессы, которые влияют на концентрацию DOC и молекулярный состав. В поверхностном слое океана ДОУ, полученный в результате первичной продукции, быстро реминерализуется или трансформируется в результате микробной деградации (черная стрелка), фотохимической деградации (желтая стрелка) или обмена частицами (зеленая стрелка). Лабильные компоненты удаляются в толщу воды, и DOC становится разбавленным в результате таких процессов, как обмен частиц (коричневая стрелка), растворение осадка (серая стрелка) и микробная переработка (белая стрелка), которые продолжают изменять, добавлять и / или удалять молекулы из общего пула DOC. Таким образом, очевидная сопротивляемость DOC в глубинах океана - это возникающее свойство, которое в значительной степени контролируется окружающей средой.[76]
В дополнение к вертикальным распределениям были смоделированы и взяты образцы горизонтальных распределений.[131] В поверхностном океане на глубине 30 метров более высокие концентрации растворенного органического углерода обнаруживаются в Южно-Тихоокеанском круговороте, Южно-Атлантическом круговороте и Индийском океане.На глубине 3000 метров самые высокие концентрации находятся в глубоководных водах Северной Атлантики, где растворенный органический углерод с поверхности океана с высокой концентрацией удаляется на глубину. В то время как в северной части Индийского океана наблюдается высокий РОУ из-за высокого потока пресной воды и отложений. Поскольку временные масштабы горизонтального движения по дну океана составляют тысячи лет, тугоплавкий растворенный органический углерод медленно расходуется на своем пути из Северной Атлантики и достигает минимума в северной части Тихого океана.
Как возникающий
Растворенное органическое вещество представляет собой неоднородный пул из тысяч, а возможно, миллионов органических соединений. Эти соединения различаются не только по составу и концентрации (от пМ до мкМ), но также происходят из различных организмов (фитопланктон, зоопланктон и бактерии) и окружающей среды (наземная растительность и почвы, прибрежные экосистемы) и, возможно, были произведены недавно или тысячи лет назад. Более того, даже органические соединения, происходящие из одного источника и одного возраста, могли быть подвергнуты различным историям обработки до накопления в одном и том же пуле DOM.[76]
РОВ внутреннего океана представляет собой сильно модифицированную фракцию, которая остается после многих лет воздействия солнечного света, использования гетеротрофами, флокуляции и коагуляции, а также взаимодействия с частицами. Многие из этих процессов в пуле DOM зависят от соединения или класса. Например, конденсированные ароматические соединения обладают высокой светочувствительностью,[132] тогда как белки, углеводы и их мономеры легко усваиваются бактериями.[133][134][135] Микробы и другие потребители избирательны в выборе типа DOM, который они используют, и обычно предпочитают одни органические соединения другим. Следовательно, модель DOM становится менее реактивной, поскольку ее постоянно переделывают. Другими словами, пул DOM становится менее лабильным и более устойчивым с деградацией. По мере доработки органические соединения постоянно добавляются в общий пул DOM путем физического смешивания, обмена с частицами и / или производства органических молекул сообществом потребителей.[136][137][138][139] Таким образом, изменения состава, которые происходят во время разложения, более сложны, чем простое удаление более лабильных компонентов и, как следствие, накопление оставшихся менее лабильных соединений.[76]
Устойчивость к растворенному органическому веществу (т. Е. Его общая реакционная способность по отношению к разложению и / или использованию), следовательно, является возникающим свойством. Восприятие неподатливости DOM изменяется во время разложения органического вещества и в сочетании с любым другим процессом, который удаляет или добавляет органические соединения в рассматриваемый пул DOM.[76]
Взаимодействие с металлами
DOC также облегчает транспортировку металлы в водных системах. Форма металлов комплексы с DOC, улучшая растворимость металлов, а также уменьшая количество металлов биодоступность.
Изоляция и анализ DOM
РОВ содержится в природе в низких концентрациях для прямого анализа с ЯМР или же РС. Более того, образцы РОВ часто содержат высокие концентрации неорганических солей, которые несовместимы с такими методами.[140] Следовательно, необходим этап концентрирования и выделения образца.[141][142] Наиболее часто используемые методы изоляции: ультрафильтрация, обратный осмос и твердофазная экстракция.[143] Среди них твердофазная экстракция считается самой дешевой и простой техникой[144]
Смотрите также
Рекомендации
- ^ Рошан, С. и ДеВрис, Т. (2017) «Эффективное производство и экспорт растворенного органического углерода в олиготрофном океане». Nature Communications, 8(1): 1–8. Дои:10.1038 / s41467-017-02227-3.
- ^ «Органический углерод». Биогеохимические методы. Получено 2018-11-27.
- ^ Кенни, Джонатан Э .; Бида, Морган; Пагано, Тодд (октябрь 2014 г.). «Тенденции в уровнях аллохтонного растворенного органического углерода в природной воде: обзор потенциальных механизмов в условиях меняющегося климата». Вода. 6 (10): 2862–2897. Дои:10.3390 / w6102862.
- ^ Муди К.С. и Уорролл Ф. (2017) «Моделирование темпов разложения РОУ с использованием состава РОВ и гидроклиматических переменных». Журнал геофизических исследований: биогеонауки, 122(5): 1175–1191. Дои:10.1002 / 2016JG003493.
- ^ Хеджес, Джон И. (3 декабря 1991 г.). «Глобальные биогеохимические циклы: успехи и проблемы» (PDF). Морская химия. 39 (1–3): 67–93. Дои:10.1016 / 0304-4203 (92) 90096-с.
- ^ Kritzberg, Emma S .; Коул, Джонатан Дж .; Пейс, Майкл Л .; Гранели, Вильгельм; Бэйд, Даррен Л. (март 2004 г.). "Автохтонные и аллохтонные источники углерода бактерий: результаты для всего озера 13C сложение экспериментов " (PDF). Лимнология и океанография. 49 (2): 588–596. Bibcode:2004LimOc..49..588K. Дои:10.4319 / lo.2004.49.2.0588. ISSN 0024-3590.
- ^ а б c d е ж грамм час я j k л м п Лёнборг, К., Каррейра, К., Джикеллс, Т. и Альварес-Сальгадо, X.A. (2020) «Воздействие глобальных изменений на круговорот растворенного органического углерода в океане». Границы морских наук, 7: 466. Дои:10.3389 / fmars.2020.00466.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Монрой, П., Эрнандес-Гарсия, Э., Росси, В. и Лопес, К. (2017) "Моделирование динамического опускания биогенных частиц в океанический поток". Нелинейные процессы в геофизике, 24(2): 293–305. Дои:10.5194 / npg-24-293-2017.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 3.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 3.0. - ^ Саймон, М., Гроссарт, Х., Швейцер, Б. и Плуг, Х. (2002) "Микробная экология органических агрегатов в водных экосистемах". Водная микробная экология, 28: 175–211. Дои:10.3354 / ame028175.
- ^ Кирхман, Дэвид Л .; Судзуки, Йошими; Гарсайд, Кристофер; Даклоу, Хью В. (15 августа 1991 г.). «Высокая скорость оборота растворенного органического углерода во время весеннего цветения фитопланктона». Природа. 352 (6336): 612–614. Bibcode:1991Натура.352..612K. Дои:10.1038 / 352612a0. S2CID 4285758.
- ^ Jaeckle, W.B .; Манахан, Д.Т. (1989). «Питание« непитающей »личинкой: поглощение растворенных аминокислот из морской воды лецитотрофными личинками брюхоногих моллюсков. Haliotis rufescens". Морская биология. 103: 87–94. Дои:10.1007 / BF00391067. S2CID 84541307.
- ^ Черемисинов, Николай; Давлетшин, Антон (2015). «Операции ГРП: Справочник по практике экологического менеджмента». Управление окружением. ISBN 9781119099994.
- ^ Эльзер, Стивен (2014). «Коричневая вода: экологические и экономические последствия увеличения содержания растворенного органического углерода в озерах». Цитировать журнал требует
| журнал =(помощь) - ^ У, Цин; Чжао, Синь-Хуа; Ван, Сяо-Дань (2008). «Взаимосвязь между гетеротрофными бактериями и некоторыми физическими и химическими параметрами в сетях распределения питьевой воды северных городов Китая». 2008 2-я Международная конференция по биоинформатике и биомедицинской инженерии. С. 4713–4716. Дои:10.1109 / ICBBE.2008.336. ISBN 978-1-4244-1747-6. S2CID 24876521.
- ^ «Растворенный органический углерод (DOC)».
- ^ Narayana, P.S .; Варалакшми, Д; Пуллайя, Т; Самбасива Рао, K.R.S. (2018). Методология исследований в зоологии. п. 225. ISBN 9789388172400.
- ^ «Фильтры из стекловолокна Whatman®, класс GF / F». Merck.
- ^ Knap, A. Michaels; Близкий; А. Даклоу; Х. Диксон, А. (1994). Протоколы керновых измерений совместных исследований глобального потока в океане (JGOFS). JGOFS.
- ^ Cauwet G (2002) «ДОМ в прибрежной зоне». В: Hansell D и Carlson C (ред.) Биогеохимия растворенных в море органических веществ, страницы 579–610, Elsevier. ISBN 9780080500119.
- ^ Тремблей, Л. и Беннер, Р. (2006) "Вклад микробов в иммобилизацию азота и сохранение органических веществ в разлагающемся растительном детрите". Geochimica et Cosmochimica Acta, 70(1): 133–146. Дои:10.1016 / j.gca.2005.08.024.
- ^ Цзяо, Н., Херндл, Г.Дж., Ханселл, Д.А., Беннер, Р., Каттнер, Г., Вильгельм, С.В., Кирхман, Д.Л., Вайнбауэр, М.Г., Луо, Т., Чен, Ф. и Азам, Ф. ( 2010) «Микробиологическое производство стойких растворенных органических веществ: долгосрочное хранение углерода в мировом океане». Обзоры природы: микробиология, 8(8): 593–599. Дои:10.1038 / nrmicro2386.
- ^ Ли, С.А., Ким, Т. и Ким Г. (2020) «Сравнение наземных и морских источников растворенного органического углерода в прибрежной бухте с использованием стабильных изотопов углерода». Биогеонауки, 17(1). Дои:10.5194 / bg-17-135-2020.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ а б Вахатало, А.В., Аарнос, Х., Мантиниеми, С. (2010). Континуум биоразлагаемости и кинетика биоразложения естественного органического вещества, описываемая бета-распределением. Биогеохимия 100, 227–240. DOI: 10.1007 / s10533-010-9419-4
- ^ а б Ханселл, Д. А. (2013). Непоследовательные фракции растворенного органического углерода. Анна. Преподобный Mar. Sci. 5, 421–445. DOI: 10.1146 / annurev-marine-120710-100757
- ^ а б Амон, Р. М. У., и Беннер, Р. (1996). Бактериальная утилизация растворенных органических веществ различных классов размеров. Лимнол. Oceanogr. 41, 41–51. DOI: 10.4319 / lo.1996.41.1.0041
- ^ Беннер Р. и Амон Р. М. (2015). Континуум размер-реактивность основных биоэлементов в океане. Анна. Преподобный Mar. Sci. 7, 185–205. DOI: 10.1146 / annurev-marine-010213-135126
- ^ Тингстад, Т.Ф., Хавскум, Х., Каас, Х., Нильсен, Т.Г., Риман, Б., Лефевр, Д. и др. (1999). Взаимодействие бактерий с простейшими и разложение органического вещества в условиях ограничения фосфора: анализ эксперимента в помещении с использованием простой модели. Лимнол. Oceanogr. 44, 62–79. DOI: 10.4319 / lo.1999.44.1.0062
- ^ Дель-Джорджио, П., и Дэвис, Дж. (2003). «Паттерны лабильности и потребления растворенного органического вещества в водных экосистемах», в «Водные экосистемы: взаимодействие растворенных органических веществ», ред. С. Е. Финдли и Р. Л. Синсабо (Сан-Диего, Калифорния: Academic Press), 399–424. DOI: 10.1016 / B978-012256371-3 / 50018-4
- ^ Бианки, Т. С. (2011). Роль органического углерода земного происхождения в прибрежных водах океана: меняющаяся парадигма и эффект прайминга. Proc. Natl. Акад. Sci. США 108, 19473–19481. DOI: 10.1073 / pnas.1017982108
- ^ Каттнер, Г., Саймон, М., и Кох, Б. П. (2011). «Молекулярная характеристика растворенного органического вещества и ограничения для использования прокариотами», в Microbial Carbon Pump in the Ocean, ред. Н. Цзяо, Ф. Азам и С. Сансерс (Вашингтон, округ Колумбия: Science / AAAS).
- ^ Кейл, Р. Г., Майер, Л. М. (2014). «Минеральные матрицы и органическое вещество», в «Трактате по геохимии», 2-е изд., Ред. Х. Холланд и К. Турекян (Оксфорд: Elsevier), 337–359. DOI: 10.1016 / B978-0-08-095975-7.01024-X
- ^ Бьянки, Т.С., Цуй, X., Блэр, Н.Э., Бурдиге, Д.Дж., Эглинтон, Т.И., и Гали, В. (2018). Центры захоронения и окисления органического углерода на границе суши и океана. Орг. Геохим. 115, 138–155. DOI: 10.1016 / j.orggeochem.2017.09.008
- ^ Уорд, Н. Д., Кейл, Р. Г., Медейрос, П. М., Брито, Д. К., Кунья, А. К., Диттмар, Т. и др. (2013). Разложение макромолекул наземного происхождения в реке Амазонка. Nat. Geosci. 6, 530–533. DOI: 10.1038 / ngeo1817
- ^ Майерс-Пигг, А. Н., Лушуарн, П., Амон, Р. М. У., Прокушкин, А., Пирс, К., и Рубцов, А. (2015). Лабильный пирогенный растворенный органический углерод в крупных сибирских арктических реках: последствия для метаболических связей лесных пожаров и ручьев. Geophys. Res. Lett. 42, 377–385. DOI: 10.1002 / 2014GL062762
- ^ а б c Гмач, М.Р., Черубин, М.Р., Кайзер, К. и Черри, C.E.P. (2020) «Процессы, влияющие на растворенное органическое вещество в почве: обзор». Scientia Agricola, 77(3). Дои:10.1590 / 1678-992x-2018-0164.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ а б Шен, Ю., Шапель, Ф.Х., Стром, Э.В. и Беннер, Р. (2015) «Происхождение и биодоступность растворенного органического вещества в грунтовых водах». Биогеохимия, 122(1): 61–78. Дои:10.1038 / s41467-019-11394-4.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ а б Reitsema, R.E., Meire, P. и Schoelynck, J. (2018) «Будущее пресноводных макрофитов в меняющемся мире: количество и качество растворенного органического углерода и его взаимодействие с макрофитами». Границы науки о растениях, 9: 629. Дои:10.3389 / fpls.2018.00629.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ а б Томас, Дж. Д. (1997). Роль растворенных органических веществ, особенно свободных аминокислот и гуминовых веществ, в пресноводных экосистемах. Freshw. Биол. 38, 1–36. DOI: 10.1046 / j.1365-2427.1997.00206.x
- ^ Коул, Дж. Дж., Прейри, Ю. Т., Карако, Н. Ф., МакДауэлл, В. Х., Транвик, Л. Дж., Стригл, Р. Г. и др. (2007). Анализ глобального углеродного цикла: интеграция внутренних вод в углеродный баланс суши. Экосистемы 10, 172–185. DOI: 10.1007 / s10021-006-9013-8
- ^ Раймонд П. А., Хартманн Дж., Лауэрвальд Р., Собек С., Макдональд К., Гувер М. и др. (2013). Глобальные выбросы углекислого газа из внутренних вод. Nature 503, 355–359. DOI: 10.1038 / природа12760
- ^ Kalbitz, K .; Solinger, S .; Park, J.H .; Michalzik, B .; Мацнер, Э. 2000. Контроль за динамикой растворенного органического вещества в почвах: обзор. Почвоведение 165: 277–304.
- ^ Zech, W .; Senesi, N .; Guggenberger, G .; Kaiser, K .; Lehmann, J .; Miano, T.M .; Miltner, A .; Шрот, Г. 1997. Факторы, контролирующие гумификацию и минерализацию органического вещества почвы в тропиках. Геодерма 79: 117–161.
- ^ а б Saidy, A.R .; Смерник, Р.Дж .; Baldock, J.A .; Kaiser, K .; Сандерман, Дж. 2015. Микробная деградация органического углерода, сорбированного до филлосиликатных глин с покрытием из водного оксида железа и без него. Европейский журнал почвоведения 66: 83–94.
- ^ Kaiser, K .; Гуггенбергер, Г. 2007. Сорбционная стабилизация органического вещества микропористым гетитом: сорбция в мелкие поры против поверхностного комплексообразования. Европейский журнал почвоведения 58: 45–59.
- ^ Veum, K.S .; Goyne, K.W .; Motavalli, P.P .; Удаватта, Р.П. 2009. Сток и потеря растворенного органического углерода в результате исследования парных водосборов трех соседних сельскохозяйственных водосборов. Сельское хозяйство, экосистемы и окружающая среда 130: 115–122.
- ^ Veum, K.S .; Goyne, K.W .; Motavalli, P.P .; Удаватта, Р.П. 2009. Сток и потеря растворенного органического углерода в результате исследования парных водоразделов трех соседних сельскохозяйственных водосборов. Сельское хозяйство, экосистемы и окружающая среда 130: 115–122.
- ^ Sparling, G .; Chibnall, E .; Pronger, J .; Rutledge, S .; Wall, A .; Кэмпбелл, Д .; Шиппер, Л. 2016. Оценки ежегодных потерь растворенного органического углерода от вымывания пастбищ на аллофанических почвах, на которых пасется молочный скот, Вайкато, Новая Зеландия. Новозеландский журнал сельскохозяйственных исследований 59: 32–49.
- ^ Собек, С., Транвик, Л. Дж., Прери, Ю. Т., Кортелайнен, П., и Коул, Дж. Дж. (2007). Модели и регулирование растворенного органического углерода: анализ 7 500 широко распространенных озер. Лимнол. Oceanogr. 52, 1208–1219. DOI: 10.4319 / lo.2007.52.3.1208
- ^ Штумм В. и Морган Дж. Дж. (1996). Водная химия: химические равновесия и скорости в природных водах. Экологические науки и технологии. Нью-Йорк: John Wiley & Sons, Inc.
- ^ Мэдсен, Т. В., и Санд-Йенсен, К. (1991). Фотосинтетическая ассимиляция углерода в водных макрофитах. Акват. Бот. 41, 5–40. DOI: 10.1016 / 0304-3770 (91) 90037-6
- ^ Regnier, P., Friedlingstein, P., Ciais, P., Mackenzie, F. T., Gruber, N., Janssens, I.A., et al. (2013). Антропогенное возмущение потоков углерода с суши в океан. Nat. Geosci. 6, 597–607. DOI: 10.1038 / ngeo1830
- ^ Luyssaert, S., Abril, G., Andres, R., Bastviken, D., Bellassen, V., Bergamaschi, P., et al. (2012). Баланс CO2, CO, CH4 и N2O на суше и внутренних водах Европы в период с 2001 по 2005 гг. Biogeosciences 9, 3357–3380. DOI: 10.5194 / bg-9-3357-2012
- ^ Кавасаки Н. и Беннер Р. (2006). Бактериальное высвобождение растворенного органического вещества во время роста и разрушения клеток: молекулярное происхождение и состав. Лимнол. Oceanogr. 51, 2170–2180. DOI: 10.4319 / lo.2006.51.5.2170
- ^ Лёнборг, К., Альварес-Сальгадо, Х.А., Дэвидсон, К., и Миллер, А.Э. Дж. (2009). Производство биодоступного и тугоплавкого растворенного органического вещества прибрежными гетеротрофными микробными популяциями. Эстуар. Морской берег. Shelf Sci. 82, 682–688. DOI: 10.1016 / j.ecss.2009.02.026
- ^ Вада, С., Аоки, М. Н., Цучия, Ю., Сато, Т., Синагава, Х., и Хама, Т. (2007). Количественный и качественный анализ растворенного органического вещества, выделяемого из пещеры Эклония Кьельман в заливе Оура, Симода, полуостров Идзу, Япония. J. Exp. Mar. Biol. Ecol. 349, 344–358. DOI: 10.1016 / j.jembe.2007.05.024
- ^ Уилли, Дж. Д., Кибер, Р. Дж., Эйман, М. С. Младший, и Брукс Эйвери, Г. (2000). Дождевая вода растворяет концентрации органического углерода и глобальный поток. Glob. Биогеохим. Циклы 14, 139–148. DOI: 10.1029 / 1999GB900036
- ^ Раймонд, П. А., и Спенсер, Р. Г. М. (2015). «Речной РОВ», в «Биогеохимии растворенного в морской среде органического вещества», ред. Д. А. Ханселл и К. А. Карлсон (Амстердам: Elsevier), 509–533. DOI: 10.1016 / B978-0-12-405940-5.00011-X
- ^ Дакс, Дж., И Межанель, Л. (2010). Органические загрязнители в прибрежных водах, отложениях и биоте: актуальная движущая сила экосистем в антропоцене? Estuarines Coasts 33, 1–14. DOI: 10.1007 / s12237-009-9255-8
- ^ Раймонд П.А. и Спенсер Р.Г.М. (2015). «Речной РОВ», в «Биогеохимии растворенного в морской среде органического вещества», ред. Д. А. Ханселл и К. А. Карлсон (Амстердам: Elsevier), 509–533. DOI: 10.1016 / B978-0-12-405940-5.00011-X
- ^ Карл Д. М., Хебель Д. В., Бьоркман К. и Летелье Р. М. (1998). Роль высвобождения растворенного органического вещества в продуктивности олиготрофного севера Тихого океана. Лимнол. Oceanogr. 43, 1270–1286. DOI: 10.4319 / lo.1998.43.6.1270
- ^ Ветц, М. С., и Уилер, П. А. (2007). Выброс растворенного органического вещества прибрежными диатомовыми водорослями. Лимнол. Oceanogr. 52, 798–807. DOI: 10.4319 / lo.2007.52.2.0798
- ^ Торнтон, Д. С. О. (2014). Выпуск растворенного органического вещества (РОВ) фитопланктоном в современный и будущий океан. Евро. J. Phycol. 49, 20–46. DOI: 10.1080 / 09670262.2013.875596
- ^ Бокелл, В. Х. М. В., Хансен, Ф. К., Ригман, Р., и Бак, Р. П. М. (1992). Вызванное лизисом снижение Phaeocystis весеннее цветение и сцепление с микробной пищевой паутиной. Mar. Ecol. Прог. Сер. 81, 269–276. DOI: 10.3354 / meps081269
- ^ а б Хигум Б. Х., Петерсен Дж. У. и Сондергаард М. (1997). Растворенный органический углерод, выделяемый при выпасе зоопланктона - это высококачественный субстрат для бактерий. J. Plankton Res. 19, 97–111. DOI: 10.1093 / plankt / 19.1.97
- ^ Ламперт, В. (1978). Высвобождение растворенного органического углерода пастбищным зоопланктоном. Лимнол. Oceanogr. 23, 831–834. DOI: 10.4319 / lo.1978.23.4.0831
- ^ Джумарс, П. А., Пенри, Д. Л., Баросс, Дж. А., и Перри, М. Дж. (1989). Замыкание микробной петли: путь растворенного углерода к гетеротрофным бактериям в результате неполного проглатывания, переваривания и всасывания у животных. Deep Sea Res. 36, 483–495. DOI: 10.1016 / 0198-0149 (89) 90001-0
- ^ Итурриага, Р., Жолнай, А. (1981). Трансформация некоторых растворенных органических соединений естественной гетеротрофной популяцией. Mar. Biol. 62, 125–129. DOI: 10.1007 / BF00388174
- ^ Огава, Х., Амагай, Ю., Койке, И., Кайзер, К., и Беннер, Р. (2001). Производство тугоплавких растворенных органических веществ бактериями. Science 292, 917–920. DOI: 10.1126 / science.1057627
- ^ Кавасаки, Н., и Беннер, Р. (2006). Бактериальное высвобождение растворенного органического вещества во время роста и разрушения клеток: молекулярное происхождение и состав. Лимнол. Oceanogr. 51, 2170–2180. DOI: 10.4319 / lo.2006.51.5.2170
- ^ Маккарти, М., Пратум, Т., Хеджес, Дж., И Беннер, Р. (1997). Химический состав растворенного органического азота в океане. Природа 390, 150–154. DOI: 10.1038 / 36535
- ^ Саттл, К. А. (2005). Вирусы в море. Природа 437, 356–361. DOI: 10.1038 / nature04160
- ^ Вайнбауэр, М.А.Г. (2004). Экология прокариотических вирусов. FEMS Microbiol. Ред. 28, 127–181. DOI: 10.1016 / j.femsre.2003.08.001
- ^ Лёнборг, К., Мидделбо, М., и Брюссаард, К. П. Д. (2013). Вирусный лизис Micromonas pusilla: влияние на образование и состав растворенных органических веществ. Биогеохимия 116, 231–240. DOI: 10.1007 / s10533-013-9853-1
- ^ Крабберод, AK; Бьорбекмо, MFM; Шалчиан-Тебризи, К .; Логарес, Р. (2017). «Изучение океанического микроэукариотического взаимодействия с метаомическими подходами». Экология водных микробов. 79: 1–12. Дои:10.3354 / ame01811.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0 - ^ Делонг, Эдвард Ф .; Карл, Дэвид М. (2005). «Геномные перспективы в микробной океанографии». Природа. 437 (7057): 336–342. Дои:10.1038 / природа04157. PMID 16163343. S2CID 4400950.
- ^ а б c d е Вагнер, С., Шуботц, Ф., Кайзер, К., Халльманн, К., Васка, Х., Россель, П.Е., Хансман, Р., Элверт, М., Мидделбург, Дж. Дж., Энгель, А. и Блаттманн, TM (2020) «Предсказывающий ДОМ: Текущий взгляд на будущее океанического растворенного органического углерода». Границы морских наук, 7:341. Дои:10.3389 / fmars.2020.00341.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Брилинский, М. (1977). Высвобождение растворенного органического вещества некоторыми морскими макрофитами. Mar. Biol. 39, 213–220. DOI: 10.1007 / BF00390995
- ^ Прегнал, А. М. (1983). Высвобождение растворенного органического углерода из эстуарной приливной макроводоросли Enteromorpha prolifera. Mar. Biol. 73, 37–42. DOI: 10.1007 / BF00396283
- ^ Пенхейл П. А., Смит В. О. (1977). Экскреция растворенного органического углерода угрем (Zostera marina) и его эпифитами. Лимнол. Oceanogr. 22, 400–407. DOI: 10.4319 / lo.1977.22.3.0400
- ^ а б Баррон, К., Дуарте, К. М. (2015). Резервуары растворенного органического углерода и вывоз из прибрежного океана. Glob. Биогеохим. Циклы 29, 1725–1738. DOI: 10.1002 / 2014GB005056
- ^ Баррон, К., Дуарте, К. М. (2015). Резервуары растворенного органического углерода и вывоз из прибрежного океана. Glob. Биогеохим. Циклы 29, 1725–1738. DOI: 10.1002 / 2014GB005056
- ^ Мартин П., Черукуру Н., Тан А.С., Санвлани Н., Муджахид А. и Мюллер М. (2018) «Распределение и круговорот терригенного растворенного органического углерода в реках, истощающих торфяники, и прибрежных водах Саравака. , Борнео ", Биогеонауки, 15(2): 6847–6865. Дои:10.5194 / bg-15-6847-2018.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Хьюсон, И., О’нейл, Дж. М., Фурман, Дж. А. и Деннисон, В. К. (2001). Распределение вирусоподобных частиц и их изобилие в отложениях и вышележащих водах вдоль градиентов эвтрофикации в двух субтропических эстуариях. Лимнол. Oceanogr. 46, 1734–1746. DOI: 10.4319 / lo.2001.46.7.1734
- ^ Бурдиге, Д. Дж., И Гарднер, К. Г. (1998). Молекулярно-массовое распределение растворенного органического углерода в поровых водах морских отложений. Mar. Chem. 62, 45–64. DOI: 10.1016 / S0304-4203 (98) 00035-8
- ^ Бурдиге, Д. Дж., И Комада, Т. (2014). «Поровые воды осадка», в «Биогеохимии растворенных в море органических веществ», ред. Д. А. Хансен и К. А. Карлсон (Кембридж, Массачусетс: Academic Press), 535–577. DOI: 10.1016 / B978-0-12-405940-5.00012-1
- ^ Комада, Т., и Реймерс, К. Э. (2001). Распределение органического углерода между твердой фазой и фазой раствора при переходе река – океан в результате ресуспендирования. Mar. Chem. 76, 155–174. DOI: 10.1016 / S0304-4203 (01) 00055-X
- ^ Диттмар, Т., и Кох, Б.П. (2006). Термогенное органическое вещество растворяется в глубинах океана. Mar. Chem. 102, 208–217. DOI: 10.1016 / j.marchem.2006.04.003
- ^ Диттмар, Т., и Пэнг, Дж. (2009). Вызванная нагреванием молекулярная подпись в растворенном в море органическом веществе. Nat. Geosci. 2, 175–179. DOI: 10.1038 / ngeo440
- ^ Бернетт У. К., Аггарвал П. К., Аурели А., Бокуневич Х., Кейбл Дж. Э., Шаретт М. А. и др. (2006). Количественная оценка расхода подводных грунтовых вод в прибрежной зоне несколькими методами. Sci. Total Environ. 367, 498–543. DOI: 10.1016 / j.scitotenv.2006.05.009
- ^ Лонгнекер, К., Куявински, Э. Б. (2011). Состав растворенного органического вещества в грунтовых водах. Геохим. Cosmochim. Acta 75, 2752–2761. DOI: 10.1016 / j.gca.2011.02.020
- ^ Уэбб, Дж. Р., Сантос, И. Р., Махер, Д. Т., Тейт, Д. Р., Киронак, Т., Садат-Нури, М. и др. (2019). Подземные воды как источник растворенного органического вещества в прибрежных водах: выводы из наблюдений радона и РОВ в 12 мелководных прибрежных системах. Лимнол. Oceanogr. 64, 182–196. DOI: 10.1002 / lno.11028
- ^ Лэнг, С.К., Баттерфилд, Д.А., Лилли, М.Д., Пол Джонсон, Х., и Хеджес, Дж. И. (2006). Растворенный органический углерод в гидротермальных системах осей хребтов и флангов хребтов. Геохим. Cosmochim. Acta 70, 3830–3842. DOI: 10.1016 / j.gca.2006.04.031
- ^ Кернер М., Хоэнберг Х., Эртль С., Рекерманн М. и Спитзи А. (2003). Самоорганизация растворенных органических веществ в виде микрочастиц в речной воде. Природа 422, 150–154. DOI: 10.1038 / nature01469
- ^ Чин В. К., Орельяна М. В. и Вердуго П. (1998). Самопроизвольная сборка морских растворенных органических веществ в полимерные гели. Nature 391, 568–572. DOI: 10.1038 / 35345
- ^ Моран М.А. и Зепп Р.Г. (1997). Роль фотореакций в образовании биологически лабильных соединений из растворенного органического вещества. Лимнол. Oceanogr. 42, 1307–1316. DOI: 10.4319 / lo.1997.42.6.1307
- ^ Моппер, К., Кибер, Д. Дж., И Стаббинс, А. (2015). «Морская фотохимия органического вещества», в «Биогеохимии растворенного в морской среде органического вещества», под ред. К. А. Карлсона и Д. А. Ханселла (Амстердам: Elsevier), 389–450. DOI: 10.1016 / B978-0-12-405940-5.00008-X
- ^ Лёнборг, К., и Альварес-Сальгадо, X.А. (2012). Рециркуляция в сравнении с экспортом биодоступных растворенных органических веществ в прибрежном океане и эффективность насоса континентального шельфа. Glob. Биогеохим. Циклы 26: GB3018. DOI: 10.1029 / 2012GB004353
- ^ Карлсон, К.А., и Ханселл, Д.А. (2015). «Источники РОВ, поглотители, реакционная способность и бюджеты», в «Биогеохимии растворенных в море органических веществ», ред. К. А. Карлсон и Д. А. Ханселл (Сан-Диего, Калифорния: Academic Press), 65–126. DOI: 10.1016 / B978-0-12-405940-5.00003-0
- ^ Шен, Ю. и Беннер, Р. (2018) «Смешивание этого в углеродном цикле океана и удаление тугоплавкого растворенного органического углерода». Научные отчеты, 8(1): 1–9. Дои:10.1038 / s41598-018-20857-5.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Лэнг, С.К., Баттерфилд, Д.А., Лилли, М.Д., Пол Джонсон, Х., и Хеджес, Дж. И. (2006). Растворенный органический углерод в гидротермальных системах осей хребтов и флангов хребтов. Геохим. Cosmochim. Acta 70, 3830–3842. DOI: 10.1016 / j.gca.2006.04.031
- ^ а б Шолковиц, Э. Р. (1976). Флокуляция растворенных органических и неорганических веществ при смешивании речной и морской воды. Геохим. Cosmochim. Acta 40, 831–845. DOI: 10.1016 / 0016-7037 (76) 90035-1
- ^ Транвик, Л. Дж., И Зиберт, Дж. М. (1989). Воздействие флокулированных гуминовых веществ на свободные и прикрепленные пелагические микроорганизмы. Лимнол. Oceanogr. 34, 688–699. DOI: 10.4319 / lo.1989.34.4.0688
- ^ Малхолланд, П. Дж. (1981). Образование твердых частиц органического углерода в воде из юго-восточного болотного ручья. Лимнол. Oceanogr. 26, 790–795. DOI: 10.4319 / lo.1981.26.4.0790
- ^ Пауэлл, Р. Т., Лендинг, В. М., и Бауэр, Дж. Э. (1996). Коллоидные следы металлов, органический углерод и азот в юго-восточном устье США. Mar. Chem. 55, 165–176. DOI: 10.1016 / S0304-4203 (96) 00054-0
- ^ Шолковиц, Э. Р., Бойл, Э. А., и Прайс, Н. Б. (1978). Удаление растворенных гуминовых кислот и железа при перемешивании в эстуарии. Планета Земля. Sci. Lett. 40, 130–136. DOI: 10.1016 / 0012-821X (78) 90082-1
- ^ Волк, К., Белл, К., Ибрагим, Э., Вержес, Д., Эми, Г., и Лешевалье, М. (2000). Влияние усиленной и оптимизированной коагуляции на удаление органических веществ и их биоразлагаемых фракций в питьевой воде. Water Res. 34, 3247–3257. DOI: 10.1016 / S0043-1354 (00) 00033-6
- ^ Уильямсон, К. Э., Стембергер, Р. С., Моррис, Д. П., Фрост, Т. А., и Полсен, С. Г. (1996). Ультрафиолетовое излучение в озерах Северной Америки: оценки ослабления на основе измерений DOC и последствия для планктонных сообществ. Лимнол. Oceanogr. 41, 1024–1034. DOI: 10.4319 / lo.1996.41.5.1024
- ^ Уильямсон, К. Э., Оверхолт, Э. П., Пилла, Р. М., Лич, Т. Х., Брентруп, Дж. А., Нолл, Л. Б. и др. (2015). Экологические последствия длительного потемнения озер. Sci. Реп.5: 18666. DOI: 10.1038 / srep18666
- ^ Джеффри, У. Х., Аас, П., Лайонс, М. М., Коффин, Р. Б., Залогодатель, Р. Дж., И Митчелл, Д. Л. (1996). Фотоповреждения морского бактериопланктона, вызванные солнечной радиацией. Photochem. Photobiol. 64, 419–427. DOI: 10.1111 / j.1751-1097.1996.tb03086.x
- ^ Род С.С., Павловски М. и Толлриан Р. (2001). Влияние ультрафиолета на вертикальное распределение зоопланктона рода Daphnia. Природа 412, 69–72. DOI: 10.1038 / 35083567
- ^ Моппер, К., Кибер, Д. Дж., И Стаббинс, А. (2015). «Морская фотохимия органического вещества», в «Биогеохимии растворенного в морской среде органического вещества», под ред. К. А. Карлсона и Д. А. Ханселла (Амстердам: Elsevier), 389–450. DOI: 10.1016 / B978-0-12-405940-5.00008-X
- ^ Миллер, В. Л., и Зепп, Р. Г. (1995). Фотохимическое производство растворенного неорганического углерода из земного органического вещества: значение океанического цикла органического углерода. Geophys. Res. Lett. 22, 417–420. DOI: 10.1029 / 94GL03344
- ^ Моран М.А. и Зепп Р.Г. (1997). Роль фотореакций в образовании биологически лабильных соединений из растворенного органического вещества. Лимнол. Oceanogr. 42, 1307–1316. DOI: 10.4319 / lo.1997.42.6.1307
- ^ Моран М.А., Шелдон В.М. и Зепп Р.Г. (2000). Потеря углерода и изменения оптических свойств при длительной фотохимической и биологической деградации растворенного в эстуарии органического вещества. Лимнол. Oceanogr. 45, 1254–1264. DOI: 10.4319 / lo.2000.45.6.1254
- ^ Кибер Р. Дж., Гидро Л. Х. и Ситон П. Дж. (1997). Фотоокисление триглицеридов и жирных кислот в морской воде: значение для образования морских гуминовых веществ. Лимнол. Oceanogr. 42, 1454–1462. DOI: 10.4319 / lo.1997.42.6.1454
- ^ Берто, С., Лаурентис, Э. Д., Тота, Т., Кьявацца, Э., Даниэле, П. Г., Минелла, М. и др. (2016). Свойства гуминоподобного материала, возникающего в результате фототрансформации L-тирозина. Sci. Total Environ. 546, 434–444. DOI: 10.1016 / j.scitotenv.2015.12.047
- ^ Хадсон, Дж. Дж., Диллон, П. Дж. И Сомерс, К. М. (2003). Долгосрочные закономерности содержания растворенного органического углерода в бореальных озерах: роль падающей радиации, осадков, температуры воздуха, южных колебаний и кислотных отложений. Hydrol. Earth Syst. Sci. 7, 390–398. DOI: 10.5194 / hess-7-390-2003
- ^ Беннер, Р., Бенитес-Нельсон, Б., Кайзер, К., и Амон, Р. М. У. (2004). Экспорт молодого терригенного растворенного органического углерода из рек в Северный Ледовитый океан. Geophys. Res. Lett. 31: L05305. DOI: 10.1029 / 2003GL019251
- ^ Оберностерер, И., и Херндл, Г. Дж. (1995). Внеклеточное высвобождение фитопланктона и рост бактерий: зависимость от соотношения неорганических N: P. Mar. Ecol. Прог. Сер. 116, 247–257. DOI: 10.3354 / meps116247
- ^ Беннер, Р., Зиглер, С. (1999). «Создают ли фотохимические превращения растворенного органического вещества биорефрактерные, а также биореактивные субстраты?» в Трудах 8-го Международного симпозиума по микробной экологии, ред. К. Р. Белла, М. Брылински и П. Джонсон-Грин (Порт-Аранзас, Техас: Техасский университет в Остине).
- ^ Сульцбергер, Б., и Дюриш-Кайзер, Э. (2009). Химическая характеристика растворенного органического вещества (РОВ): необходимое условие для понимания вызванных УФ-излучением изменений абсорбционных свойств и биодоступности РОВ. Акват. Sci. 71, 104–126. DOI: 10.1007 / s00027-008-8082-5
- ^ Миллер, В. Л., и Моран, М. А. (1997). Взаимодействие фотохимических и микробных процессов в деградации тугоплавких растворенных органических веществ прибрежной морской среды. Лимнол. Oceanogr. 42, 1317–1324. DOI: 10.4319 / lo.1997.42.6.1317
- ^ Моран М.А. и Зепп Р.Г. (1997). Роль фотореакций в образовании биологически лабильных соединений из растворенного органического вещества. Лимнол. Oceanogr. 42, 1307–1316. DOI: 10.4319 / lo.1997.42.6.1307
- ^ Стаббинс, А., Уэр, Г., Ло, С.С., Моппер, К., Робинсон, К., и Апстилл-Годдард, Р.С. (2006). Фотопроизводство окиси углерода в открытом океане. Deep Sea Res. II Вверх. Stud. Oceanogr. 53, 1695–1705. DOI: 10.1016 / j.dsr2.2006.05.011
- ^ Миллер, В. Л., Моран, М. А., Шелдон, В. М., Зепп, Р. Г. и Опсал, С. (2002). Определение спектров кажущегося квантового выхода для образования биологически лабильных фотопродуктов. Лимнол. Oceanogr. 47, 343–352. DOI: 10.4319 / lo.2002.47.2.0343
- ^ Эндрюс, С.С., и Зафириу, О.С. (2000). Фотохимическое потребление кислорода в морских водах: основная причина окрашенных растворенных органических веществ? Лимнол. Oceanogr. 45, 267–277. DOI: 10.4319 / lo.2000.45.2.0267
- ^ Ван, X.-C., Чен, Р. Ф., и Гарднер, Г. Б. (2004). Источники и перенос растворенного и взвешенного органического углерода в устье реки Миссисипи и прилегающих прибрежных водах северной части Мексиканского залива. Mar. Chem. 89, 241–256. DOI: 10.1016 / j.marchem.2004.02.014
- ^ Шарп, Джонатан Х. (6 августа 1996 г.). «Морской растворенный органический углерод: верны ли старые значения?». Морская химия. 56 (3–4): 265–277. Дои:10.1016 / S0304-4203 (96) 00075-8.
- ^ Сондергаард, Мортен; Матиас Мидделбо (9 марта 1995 г.). «Межсистемный анализ лабильного растворенного органического углерода» (PDF). Серия "Прогресс морской экологии". 118: 283–294. Bibcode:1995MEPS..118..283S. Дои:10,3354 / meps118283.
- ^ Грубер, Дэвид Ф .; Жан-Поль Симжу; Сибил П. Зейтцингер; Гэри Л. Тэгон (июнь 2006 г.). «Динамика и характеристика тугоплавких растворенных органических веществ, производимых чистой бактериальной культурой в экспериментальной системе хищник-жертва». Прикладная и экологическая микробиология. 72 (6): 4184–4191. Дои:10.1128 / AEM.02882-05. ЧВК 1489638. PMID 16751530.
- ^ Hansell, Dennis A .; Крейг А. Карлсон; Дэниел Дж. Репета; Райнер Шлитцер (2009). «Растворенное органическое вещество в океане: разногласия побуждают к новым открытиям». Океанография. 22 (4): 202–211. Дои:10.5670 / oceanog.2009.109. HDL:1912/3183.
- ^ Стаббинс А., Ниггеманн Дж. И Дитмар Т. (2012). Фотолабильность растворенного черного углерода в глубинах океана. Биогеонауки 9, 1661–1670. DOI: 10.5194 / bg-9-1661-2012
- ^ Ходсон Р. Э., Маккуббин А. Э. и Помрой Л. Р. (1981). Утилизация растворенного аденозинтрифосфата свободноживущим и прикрепленным бактериопланктоном. Mar. Biol. 64, 43–51. DOI: 10.1007 / bf00394079
- ^ Холлибо, Дж. Т., и Азам, Ф. (1983). Микробное разложение растворенных белков в морской воде. Лимнол. Oceanogr. 28, 1104–1116. DOI: 10.4319 / lo.1983.28.6.1104
- ^ Фергюсон, Р. Л., и Сунда, В. Г. (1984). Использование аминокислот планктонными морскими бактериями: важность чистой техники и низких добавок субстрата. Лимнол. Oceanogr. 29, 258–274. DOI: 10.4319 / lo.1984.29.2.0258
- ^ Огава, Х., Амагай, Ю., Киоке, И., Кайзер, К., и Беннер, Р. (2001). Производство тугоплавких растворенных органических веществ бактериями. Science 292, 917–920. DOI: 10.1126 / science.1057627
- ^ Цзяо, Н., Херндл, Г. Дж., Ханселл, Д. А., Беннер, Р., Каттнер, Г., Вильгельм, С. В. и др. (2010). Микробиологическое производство устойчивых растворенных органических веществ: долгосрочное хранение углерода в мировом океане. Nat. Rev. Microbiol. 8, 593–599. DOI: 10.1038 / nrmicro2386
- ^ Кайзер, К., Беннер, Р. (2008). Основной вклад бактерий в океанический резервуар обломочного органического углерода и азота. Лимнол. Oceanogr. 53, 99–112. DOI: 10.4319 / lo.2008.53.1.0099
- ^ Шен Ю. и Беннер Р. (2018). Подмешивание его в круговорот углерода океана и удаление тугоплавкого растворенного органического углерода. Sci. Реп. 8: 2542. DOI: 10.1038 / s41598-018-20857-5
- ^ Неббиозо, Антонио; Пикколо, Алессандро (январь 2013 г.). «Молекулярная характеристика растворенного органического вещества (РОВ): критический обзор». Аналитическая и биоаналитическая химия. 405 (1): 109–124. Дои:10.1007 / s00216-012-6363-2. ISSN 1618-2642.
- ^ Неббиозо, Антонио; Пикколо, Алессандро (январь 2013 г.). «Молекулярная характеристика растворенного органического вещества (РОВ): критический обзор». Аналитическая и биоаналитическая химия. 405 (1): 109–124. Дои:10.1007 / s00216-012-6363-2. ISSN 1618-2642.
- ^ Minor, Elizabeth C .; Свенсон, Майкл М .; Mattson, Bruce M .; Ойлер, Алан Р. (2014). «Структурная характеристика растворенного органического вещества: обзор современных методов выделения и анализа». Environ. Наука: Процессы Влияние. 16 (9): 2064–2079. Дои:10.1039 / C4EM00062E. ISSN 2050-7887.
- ^ Грин, Нельсон У .; Пердью, Э. Майкл; Aiken, George R .; Батлер, Кенна Д .; Чен, Хунмэй; Диттмар, Торстен; Ниггеманн, Ютта; Стаббинс, Арон (2014-04-20). «Взаимное сравнение трех методов крупномасштабной изоляции океанического растворенного органического вещества». Морская химия. 161: 14–19. Дои:10.1016 / j.marchem.2014.01.012. ISSN 0304-4203.
- ^ Minor, Elizabeth C .; Свенсон, Майкл М .; Mattson, Bruce M .; Ойлер, Алан Р. (21.08.2014). «Структурная характеристика растворенного органического вещества: обзор современных методов выделения и анализа». Экологическая наука: процессы и воздействия. 16 (9): 2064–2079. Дои:10.1039 / C4EM00062E. ISSN 2050-7895.
внешняя ссылка
- Ханселл Д.А. и Карлсон К.А. (ред.) (2014) Биогеохимия растворенных в море органических веществ, Второе издание, Academic Press. ISBN 9780124071537.
- Стоун, Ричард (18 июня 2010 г.). "Морская биогеохимия: невидимая рука за огромным резервуаром углерода". Наука. 328 (5985): 1476–1477. Bibcode:2010Sci ... 328.1476S. Дои:10.1126 / science.328.5985.1476. PMID 20558685.



