Плавка цинка - Zinc smelting - Wikipedia
Плавка цинка это процесс преобразования цинк концентраты (руды содержащие цинк) в чистый цинк. Плавка цинка исторически была труднее, чем плавка из других металлов, например утюг, потому что, напротив, цинк имеет низкую точка кипения. При температурах, обычно используемых для плавки металлов, цинк газ что убежит от печь с дымовые газы и погибнуть, если не будут приняты специальные меры для предотвращения этого.
Наиболее часто обрабатываемый цинковый концентрат - сульфид цинка,[1] который получается путем концентрирования сфалерит с использованием пенная флотация метод. Вторичный (переработанный) цинковый материал, такой как оксид цинка, также обрабатывается сульфидом цинка.[2] Приблизительно 30% всего производимого цинка происходит из вторичных источников.[3]
Методы
Существует два метода плавки цинка: пирометаллургический процесс и процесс электролиза.[2] Оба метода все еще используются.[2][4] Оба эти процесса имеют один и тот же первый шаг: обжаривание.
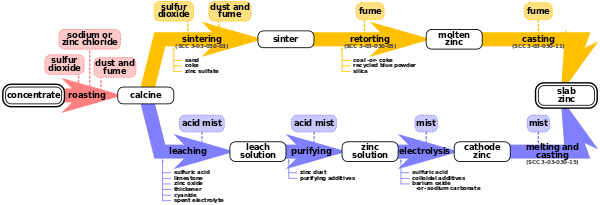
Жарка
Обжарка - это процесс окисления концентратов сульфида цинка при высоких температурах до неочищенного оксида цинка, который называется «кальцином цинка». Происходящие химические реакции следующие:
Примерно 90% цинка в концентратах окисляется до оксида цинка. Однако при температурах обжига около 10% цинка реагирует с примесями железа в концентратах сульфида цинка с образованием феррит цинка. Побочным продуктом обжарки является диоксид серы, который в дальнейшем преобразуется в серная кислота, а товар.[2] На связанной технологической схеме нефтеперерабатывающего завода представлена схема обжига цинка на заводе Noranda в восточной части Канады.[5]
Процесс обжарки зависит от типа используемого жаровни. Есть три типа обжарочных аппаратов: многоподовые, подвесные и с псевдоожиженным слоем.[1]
Жаровня с несколькими подами
В многоподовой обжарке концентрат падает через серию из 9 или более подов, установленных внутри цилиндрической колонны, выложенной кирпичом. Когда исходный концентрат падает через печь, он сначала сушится горячими газами, проходящими через поды, а затем окисляется с образованием кальцина. Реакции протекают медленно и могут поддерживаться только добавлением топлива. Обжарочные аппараты с несколькими подами не находятся под давлением и работают при температуре около 690 ° C (1270 ° F). Время работы зависит от состава концентрата и требуемого количества удаляемой серы. Многоподовые печи для обжарки могут производить кальцинированный материал высокой чистоты.[1]
Подвес жаровня
В установке для обжига суспензии концентраты выдуваются в камеру сгорания, очень похожую на камеру сгорания пылевидного угля. Обжарки состоят из огнеупорной подкладки цилиндрической стальной оболочки, с большим пространством сгорания в верхней части и от 2 до 4 очагов в нижней части, аналогичного тем, кратного под. Дополнительное измельчение, помимо того, которое требуется для многоподовой печи, обычно требуется для обеспечения того, чтобы передача тепла материалу была достаточно быстрой для протекания реакций обессеривания и окисления в камере печи. Подвесные ростеры не находятся под давлением и работают при температуре около 980 ° C (1800 ° F).[1]
Жаровня с псевдоожиженным слоем
В обжиговой печи с псевдоожиженным слоем тонкоизмельченные сульфидные концентраты взвешиваются и окисляются в слое сырья, поддерживаемом воздушным столбом. Как и в установке для обжига суспензии, скорость реакции обессеривания выше, чем в более старых многоподовых процессах. Обжарочные установки с псевдоожиженным слоем работают при давлении немного ниже атмосферного и при средней температуре 1000 ° C (1830 ° F). В процессе с псевдоожиженным слоем после воспламенения дополнительное топливо не требуется. Основными преимуществами этого ростера являются более высокая пропускная способность, большие возможности удаления серы и меньшие затраты на техническое обслуживание.[1]
Процесс электролиза
Процесс электролиза, также известный как гидрометаллургический процесс, процесс обжарки-выщелачивания-электролиза (RLE) или электролитический процесс, используется более широко, чем пирометаллургические процессы.[2]
Процесс электролиза состоит из 4 этапов: выщелачивания, очистки, электролиза, плавления и литья.
Выщелачивание
Основная химическая формула выщелачивания, которая управляет этим процессом:
На практике это достигается за счет процесса, называемого двойным выщелачиванием. Обожженный материал сначала выщелачивают в нейтральном или слабокислом растворе (серной кислоты), чтобы выщелачивать цинк из оксида цинка. Оставшийся кальцин затем выщелачивают в сильной серной кислоте для выщелачивания остального цинка из оксида цинка и феррита цинка. Результатом этого процесса является твердое тело и жидкость; жидкость содержит цинк и часто называется продуктом выщелачивания; твердое вещество называется остатком от выщелачивания и содержит драгоценные металлы (обычно свинец и серебро), которые продаются как побочный продукт. В продукте выщелачивания сильнокислотного выщелачивания также присутствует железо, которое удаляется на промежуточной стадии в виде гетит, ярозит, и гематит. Все еще кадмий, медь, мышьяк, сурьма, кобальт, германий, никель, и таллий в продукте выщелачивания. Следовательно, его нужно очистить.[1][2]
Очищение
В процессе очистки используется процесс цементации для дальнейшей очистки цинка. Он использует цинковую пыль и пар для удаления меди, кадмия, кобальта и никеля, которые могут помешать процессу электролиза. После очистки концентрация этих примесей ограничивается менее 0,05 миллиграмм на литр (4 × 10−7 фунт на галлон США). Очистка обычно проводится в больших резервуарах с мешалкой. Процесс протекает при температуре от 40 до 85 ° C (от 104 до 185 ° F) и давлении от атмосферного до 2,4 атм (240 кПа) (абсолютная шкала). Побочные продукты продаются для дальнейшей переработки.[1][2]
Раствор сульфата цинка должен быть очень чистым, чтобы электрохимическое извлечение было хоть сколько-нибудь эффективным. Примеси могут изменить напряжение разложения настолько, что электролизная ячейка производит в основном газообразный водород, а не металлический цинк.[6]
Электролиз
Цинк извлекается из очищенного раствора сульфата цинка путем электровыделение, который является специализированной формой электролиза. Процесс заключается в пропускании электрического тока через раствор в серии ячеек. Это вызывает осаждение цинка на катодах (алюминий листов) и кислорода для образования на анодах. Серная кислота также образуется в процессе и повторно используется в процессе выщелачивания. Каждые 24–48 часов каждая ячейка отключается, оцинкованные катоды удаляются и промываются, а цинк механически удаляется с алюминиевых пластин.[1][2]
Электролитические плавильные печи цинка содержат до нескольких сотен ячеек. Часть электрической энергии преобразуется в тепло, что увеличивает температуру электролита. Электролитические ячейки работают при температуре от 30 до 35 ° C (от 86 до 95 ° F) и при атмосферном давлении. Часть электролита непрерывно циркулирует через градирни как для охлаждения, так и для концентрирования электролита за счет испарения воды. Охлажденный и концентрированный электролит затем возвращается в ячейки.[1] На этот процесс приходится примерно треть всей энергии, потребляемой при выплавке цинка.[2]
Существует два распространенных процесса электролитического извлечения металла: низкая плотность тока процесс, и Высокая плотность тока Tainton процесс. В первом в качестве электролита используется 10% раствор серной кислоты с плотностью тока 270–325 ампер на квадратный метр. Последний использует в качестве электролита 22–28% раствор серной кислоты с плотностью тока около 1000 ампер на квадратный метр. Последний дает лучшую чистоту и имеет более высокую производительность на единицу объема электролита, но имеет тот недостаток, что он более горячий и вызывает большую коррозию емкости, в которой это делается. В любом из электролитических процессов на каждую метрическую тонну производства цинка затрачивается около 3900кВт⋅ч (14 ГДж ) электроэнергии.[6]
Плавка и литье
В зависимости от типа производимых конечных продуктов цинковые катоды, выходящие из электролизного завода, могут подвергаться дополнительной стадии преобразования в литейном производстве. Цинковые катоды плавятся в индукционных печах и отливаются в товарные продукты, такие как слитки. Другие металлы и компоненты сплавов могут быть добавлены для производства цинксодержащих сплавов, используемых при литье под давлением или общем гальваническом применении. Наконец, расплавленный цинк можно транспортировать на близлежащие перерабатывающие предприятия или к третьим сторонам, используя специально разработанные изолированные контейнеры. Так обстоит дело с Баленом и Буделом.[2]
Пирометаллургические процессы
Существует также несколько пирометаллургических процессов, которые восстанавливают оксид цинка с использованием углерода, а затем перегоняют металлический цинк из полученной смеси в атмосфере моноксида углерода. Основным недостатком любого пирометаллургического процесса является то, что его чистота составляет всего 98%; Стандартный состав - 1,3% свинца, 0,2% кадмия, 0,03% железа и 98,5% цинка.[7] Он может быть достаточно чистым для гальванизации, но недостаточным для сплавов для литья под давлением, для которых требуется специальный высококачественный цинк (чистота 99,995%).[7] Для достижения этой чистоты цинк должен быть изысканный.
Четыре типа промышленных пирометаллургических процессов: St. Joseph Minerals Corporation's (электротермический) процесс, доменная печь процесс, Нью-Джерси Цинк непрерывная вертикальная реторта процесс, и Горизонтальная реторта бельгийского типа процесс.
St. Joseph Mineral Company (электротермический) процесс
Этот процесс был разработан компанией St. Joseph Mineral Company в 1930 году и является единственным пирометаллургическим процессом, который до сих пор используется в США для плавки цинка. Преимущество этой системы заключается в том, что она способна плавить широкий спектр цинксодержащих материалов, включая пыль электродуговой печи.[1] Недостатком этого процесса является то, что он менее эффективен, чем процесс электролиза.[2]
Процесс начинается с операции спекания в нисходящем потоке. Агломерат, представляющий собой смесь кальцина обжиговой печи и кальцина из ДСП (электродуговая печь), загружается на конвейер шиберного типа, а затем газы сгорания прокачиваются через агломерат. Углерод в дымовых газах реагирует с некоторыми примесями, такими как свинец, кадмий и галогениды. Эти примеси удаляются в фильтрующие мешки. Агломерат после этого процесса, называемого агломератом продукта, обычно имеет состав из 48% цинка, 8% железа, 5% алюминия, 4% кремния, 2,5% кальция и меньших количеств магния, свинца и других металлов. Затем агломерат загружается с коксом в электрическую ретортную печь. Пара графитовых электродов сверху и снизу печи создает ток через смесь. Кокс обеспечивает электрическое сопротивление смеси, чтобы нагреть смесь до 1400 ° C (2550 ° F) и произвести окись углерода. Эти условия позволяют протекать следующей химической реакции:
Пары цинка и диоксид углерода проходят в вакуумный конденсатор, где цинк восстанавливается путем барботирования через ванну с расплавленным цинком. Более 95% паров цинка, выходящих из реторты, конденсируется в жидкий цинк. Диоксид углерода регенерируется углеродом, а монооксид углерода возвращается обратно в ретортную печь.[1]
Доменный процесс (Imperial Smelting Process)
Этот процесс был разработан Национальная металлургическая компания в Доки Эйвонмута, Англия, чтобы увеличить производство, повысить эффективность и снизить затраты на рабочую силу и техническое обслуживание. Л. Дж. Дерхэм предложил использовать распыление капель расплавленного свинца для быстрого охлаждения и поглощения паров цинка, несмотря на высокую концентрацию диоксида углерода. Затем смесь охлаждают, при этом цинк отделяется от свинца. Первый завод, использующий эту конструкцию, был открыт в 1950 году. Одним из преимуществ этого процесса является то, что он может одновременно производить свинцовый слиток и медный шлак. В 1990 году на его долю приходилось 12% мирового производства цинка.
Процесс начинается с загрузки твердого агломерата и нагретого кокса в верхнюю часть доменной печи. Подогретый воздух до температуры от 190 до 1050 ° C (от 370 до 1920 ° F) вдувается в нижнюю часть печи. Пары и сульфиды цинка выходят через верх и попадают в конденсатор. Шлак и свинец собираются на дне печи и регулярно выпускаются. Цинк очищается от пара в конденсаторе жидким свинцом. Жидкий цинк отделяется от свинца в охлаждающем контуре. Приблизительно 5000 метрических тонн (5,500 короткие тонны ) свинца требуются каждый год для этого процесса, однако этот процесс извлекает на 25% больше свинца из исходных руд, чем другие процессы.
Вертикальная реторта непрерывного действия New Jersey Zinc

Цинк процесс в Нью-Джерси[8] больше не используется для производства первичного цинка в США, Европе и Японии, однако по-прежнему используется для обработки вторичных производств. Пик этого процесса пришелся на 1960 год, когда на его долю приходилось 5% мирового производства цинка. Модифицированная версия этого процесса все еще используется в Хулудао, Китай, где было произведено 65 000 метрических тонн в год.[7]
Этот процесс начинается с обжига концентратов, смешанных с углем и брикетированный в два этапа. Затем брикеты нагревают в автогенный установка для коксования при 700 ° C (1292 ° F), а затем загружается в реторту. Для брикетирования кальцина есть три причины: обеспечить свободное движение шихты вниз; для обеспечения теплопередачи через поперечное сечение практического размера; чтобы обеспечить адекватную пористость для прохождения восстановленных паров цинка к верхней части реторты. Восстановленный пар цинка, который собирается в верхней части реторты, затем конденсируется в жидкость.[7]
Overpelt усовершенствовал эту конструкцию, использовав только одну большую камеру конденсации вместо множества маленьких, как это было изначально задумано. Это позволяло рециркулировать окись углерода в печи для нагрева реторт.[7]
Этот процесс был лицензирован для Imperial Smelting Corporation (ISC), расположенной в г. Avonmouth, Англия, где в течение многих лет производился большой завод по производству вертикальных реторт (VR). Он использовался до середины 1970-х годов, когда его заменил завод компании Imperial Smelting Furnace (ISF). Завод VR снесли в 1975 году.
Горизонтальный ретортный процесс бельгийского типа
Этот процесс был основным процессом, использовавшимся в Великобритании с середины 19 века до 1951 года.[7][9] Процесс был очень неэффективным, так как он был разработан как мелкомасштабная партия. Каждая реторта производила всего 40 килограммов (88 фунтов), поэтому компании складывали их в банки и использовали одну большую газовую горелку для их нагрева.[9] Бельгийский процесс требует повторной дистилляции для удаления примесей свинца, кадмия, железа, меди и мышьяка.[6]
История
Хотя некоторые изделия из цинка, по-видимому, были сделаны во времена классической античности в Европа,[10] первое массовое производство цинка, по-видимому, было в Индия начиная с 12 века и позже в Китай с 16 века.[11] В Индии цинк производили в Заваре с 12 по 18 века. Найденная здесь сфалеритовая руда предположительно была преобразована в оксид цинка через обжаривание, хотя никаких археологических свидетельств этого не найдено. Считается, что плавка проводилась в герметичных цилиндрических ретортах для глины, заполненных смесью обожженной руды, доломит, и органический материал, возможно коровий навоз, а затем помещают вертикально в печь и нагревают примерно до 1100 ° C. Монооксид углерода образовавшийся в результате обугливания органического материала, оксид цинка восстановился бы до паров цинка, которые затем сжижались в коническом глиняном конденсаторе на дне реторты, капая в сборный сосуд. В период с 1400 по 1800 год производство оценивается примерно в 200 кг / день.[12] Цинк также выплавляли в Китае с середины шестнадцатого века.[13]
Крупномасштабное производство цинка в Европе началось с Уильям Чемпион, который запатентовал процесс дистилляции цинка в 1738 году.[14] В процессе Чемпиона цинковая руда (в данном случае карбонат ZnCO3) запаивали в большие восстановительные котлы с древесным углем и нагревали в печи. Затем пары цинка спускались по железной конденсационной трубе, пока не достигли заполненного водой сосуда на дне.[15] Чемпион открыл свой первый цинковый завод в г. Бристоль, Англия, но вскоре расширилась до Warmley и к 1754 году построили здесь четыре цинковые печи.[16] Хотя Champion удалось произвести около 200 тонн цинка,[16] его бизнес-планы не увенчались успехом, и к 1769 году он стал банкротом.[15] Однако выплавка цинка в этом районе продолжалась до 1880 года.[16]

Эволюция содержания извлекаемой цинковой руды в Канаде и Австралии
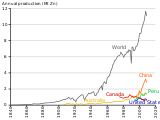
Историческая эволюция производства цинка, добываемого в разных странах.
| Год | По горизонтали возразить | Вертикальный возразить | Электротермический | Взрыв печь | Электролитический |
|---|---|---|---|---|---|
| <1916 | >90 | ||||
| 1929 | 28 | ||||
| 1937 | c. 33 | ||||
| 1960 | 34.5 | 11 | 7.5 | 2 | 45 |
| 1970 | 15 | 10 | 6.5 | 12.5 | 56 |
| 1980 | 3 | 7 | 6 | 10 | 74 |
Раннее европейское производство цинка также имело место в Силезия, в Каринтия, И в Вассал, Бельгия. В каринтийском процессе, который использовался в работах, основанных в 1798 году Бергратом Диллинджером, дровяная печь нагревала большое количество небольших вертикальных реторт,[19] и пары цинка затем падали через керамическую трубу в общую конденсационную камеру внизу. К 1840 году этот процесс не использовался. В бельгийских и силезских процессах использовались горизонтальные реторты.[20] В Силезии Иоганн Рухберг построил печь для дистилляции цинка в 1799 году, сначала использовав горшки, но позже перейдя на реторты с плоским дном, называемые «муфелями», прикрепленные к горизонтальным трубкам, изогнутым вниз, в которых конденсировался цинк. Силезский процесс в конечном итоге слился с бельгийским процессом. Этот процесс, разработанный Жан-Жак Даниэль Дони, был введен в обращение 1805–1810 гг., и использовались реторты с цилиндрическим поперечным сечением.[19][20] Конденсаторы представляли собой горизонтальные глиняные трубы, выходящие из концов реторт.[21] Объединенный "белго-силезский" горизонтальный ретортный процесс получил широкое распространение в Европе к третьей четверти XIX века, а затем и в Соединенных Штатах.[20]
Экспериментальные попытки извлечь цинк с помощью электролиза начались в 19 веке, но единственным коммерчески успешным применением до 1913 года был процесс, использованный в Великобритания и Австрия, где цинк и хлор были совместно произведены электролизом водной хлорид цинка решение.[22] В Анаконда Медная Компания, в Анаконда, Монтана, а Объединенная горно-металлургическая компания, в Тащить, британская Колумбия, оба построили успешные электролитические заводы в 1915 году с использованием применяемого в настоящее время процесса сульфата цинка.[23] Значение этого метода продолжает расти, и в 1975 году на его долю приходилось 68% мирового производства цинка.[24]
Процесс непрерывной вертикальной реторты был введен в 1929 году компанией New Jersey Zinc. В этом процессе использовалась реторта со стенками из карбида кремния, высотой около 9 метров и сечением 2 на 0,3 метра. Стенки реторты нагревали до 1300 ° C, и брикеты, состоящие из агломерированной цинковой руды, кокса, угля и переработанного материала, подавали в верхнюю часть реторты. Газообразный цинк отводили из верхней части колонны, и после 20-часового прохождения через реторту отработанные брикеты были удалены из нижней части.[25] Для конденсации газообразного цинка компания сначала использовала простую кирпичную камеру с карборундовыми перегородками, но эффективность была низкой. В 1940-х годах был разработан конденсатор, который конденсировал пары цинка на брызгах жидких капель цинка, выбрасываемых электрическим рабочим колесом.[26]
Электротермический процесс, разработанный Ведущая компания Св. Иосифа, было несколько похоже.[25][27] Первый коммерческий завод, использующий этот процесс, был построен в 1930 году на нынешнем месте Джозефтаун, Пенсильвания. Электротермическая печь представляла собой стальной цилиндр высотой около 15 метров и диаметром 2 метра, облицованный огнеупорным кирпичом. Смесь агломерированной руды и кокса подавали в верхнюю часть печи, и между угольными электродами в печи подавали ток 10 000–20 000 ампер при разности потенциалов 240 вольт, повышая температуру до 1200–1400 ° C. С.[25][27] Эффективный конденсатор был разработан для этого процесса с 1931 по 1936 год; он состоял из ванны с жидким цинком, через которую отсасывались выхлопные газы. Цинк, содержащийся в газовом потоке, абсорбировался жидкой ванной.[26]
Доменный процесс был разработан в 1943 году в Эйвонмуте, Англия, компанией Императорская металлургическая корпорация,[28] который стал частью Рио Тинто Цинк в 1968 г.[29] Он использует распыление капель расплавленного свинца для конденсации паров цинка.[30]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм час я j k Сборник коэффициентов выбросов загрязнителей воздуха (PDF), 1, Агентство по охране окружающей среды США, 1995 г., архивировано из оригинал (PDF) на 2010-02-25.
- ^ а б c d е ж грамм час я j k Процесс плавки цинка, заархивировано из оригинал на 2008-04-14, получено 2008-04-13.
- ^ Цинковое литье: системный подход (PDF), Интерцинк, 1992 г..
- ^ Наши объекты - Monaca, получено 2008-04-13.
- ^ Иллюстрация процесса обжига цинка в Норанде http://www.norandaincomefund.com/pdfs/refinery_flowsheet.pdf
- ^ а б c Саманс, Карл Х. (1949), Технические металлы и их сплавы, Нью-Йорк: Макмиллан.
- ^ а б c d е ж Портер, Фрэнк (1991), Справочник по цинку: свойства, обработка и использование в дизайне, CRC Press, стр. 16–17, ISBN 0-8247-8340-9.
- ^ Патент США 2457552
- ^ а б Обработка цинка, Энциклопедия Britannica Inc., получено 2008-04-18.
- ^ стр. 1–3, Цинк в классической древности, П. Т. Крэддок, стр. 1–6 в 2000 лет цинка и латуни, под редакцией П. Крэддок, Лондон: Британский музей, 1998, ред. изд., ISBN 0-86159-124-0.
- ^ «обработка цинка», Encyclopædia Britannica Online, 2009. Доступно через 8 октября 2009 г.
- ^ С. 35–46, «Цинк в Индии», П. Т. Крэддок, И. К. Фристоун, Л. К. Гурджар, А. П. Миддлтон и Л. Виллис, стр. 27–72 в Craddock 1998.
- ^ п. 23, Цинковая скульптура в Америке: 1850-1950 гг., Кэрол А. Гриссом, Associated University Press, 2009 г., ISBN 0-87413-031-X.
- ^ С. 24–26, Гриссом 2009.
- ^ а б стр. 147–148, Латунь и цинк в Европе от средневековья до середины девятнадцатого века, Joan Day, стр. 133–158 в Craddock 1998.
- ^ а б c п. 26, Гриссом 2009.
- ^ стр. 162, 213, 214, Технология производства цинка 1801–1950: обзор, J. K. Almond, стр. 159–228 в 2000 лет цинка и латуни, под редакцией П. Крэддок, Лондон: Британский музей, 1998, ред. изд., ISBN 0-86159-124-0.
- ^ п. 15, Портер 1991.
- ^ а б стр. 151–152, День в Крэддоке 1998.
- ^ а б c стр. 179–181, Технология производства цинка 1801–1950: обзор, J. K. Almond, стр. 159–228 в Craddock 1998.
- ^ С. 198–199, Миндаль в Крэддоке, 1998.
- ^ С. 210–213, Миндаль в Крэддоке 1998.
- ^ п. 21, Электролитическое осаждение и гидрометаллургия цинка, Оливер Колдуэлл Ралстон, McGraw-Hill Book Company, Inc., 1921.
- ^ п. 214, Миндаль в Крэддоке 1998.
- ^ а б c п. 184, Миндаль в Крэддоке 1998.
- ^ а б С. 201–202, Миндаль в Крэддоке 1998.
- ^ а б стр. 196–197, Миндаль в Крэддоке 1998.
- ^ Пол Т. Крэддок, изд. (1998). 2000 лет цинку и латуни. Британский музей Периодическая газета. британский музей. стр.229 ff. ISSN 0142-4815.
- ^ «Рио Тинто Ко». Путеводитель Грейс. Получено 2014-10-27.
- ^ п. 229, 233, 234, Разработка цинк-свинцовой доменной печи как исследовательский проект, С. В. К. Морган, стр. 229–241 в Craddock 1998.






