Карбонилдиимидазол - Carbonyldiimidazole
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 1,1'-карбонилдиимидазол | |
| Другие имена N, N'-карбонилдиимидазол CDI Реагент Staab | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.007.718 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C7ЧАС6N4О | |
| Молярная масса | 162.152 г · моль−1 |
| Внешность | Белый мелкий порошок |
| Температура плавления | 119 ° С (246 ° F, 392 К) |
| Реагирует с водой | |
| Опасности | |
| Главный опасности | Вызывает коррозию некоторых металлов. химические ожоги при попадании на кожу или в глаза. |
| Паспорт безопасности | Внешний паспорт безопасности материала |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H302, H314, H315, H319 | |
| P260, P264, P270, P280, P301 + 312, P301 + 330 + 331, P302 + 352, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P321, P330, P332 + 313, P337 + 313, P362, P363, P405, P501 | |
| Родственные соединения | |
Родственные соединения | фосген, имидазол |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
1,1'-Карбонилдиимидазол (CDI) является органическое соединение с молекулярной формулой (C3ЧАС3N2)2CO. Это белый кристаллический твердый. Часто используется для соединения аминокислоты за пептид синтез и как реагент в органический синтез.
Подготовка
CDI может быть непосредственно получен реакцией фосген с четырьмя эквивалентами имидазол в безводных условиях.[1] Удаление побочного продукта, имидазолия хлорид, и растворитель приводит к кристаллическому продукту с выходом ~ 90%.[2]
- 4 C3ЧАС4N2 + C (O) Cl2 → (C3ЧАС3N2)2CO + 2 [C3ЧАС3N2ЧАС2] Cl
В этом превращении имидазол служит как нуклеофилом, так и основанием. Альтернативный предшественник 1- (триметилсилил) имидазол требует более подготовительных усилий с тем преимуществом, что сопутствующий триметилсилилхлорид является летучим.
CDI легко гидролизуется с возвращением имидазола:
- (C3ЧАС3N2)2CO + H2О → 2 С3ЧАС4N2 + CO2
Чистоту CDI можно определить по количеству CO2 который образуется при гидролизе.[3]
Использование в синтезе
CDI в основном используется для превращения аминов в амиды, карбаматы, мочевина. Его также можно использовать для превращения спиртов в сложные эфиры.[1]
Кислотные производные
CDI способствует образованию амида. Хотя реакционная способность CDI меньше хлорангидриды, с ним легче обращаться и он позволяет избежать использования тионилхлорид в образовании хлорангидрида, который может вызвать побочные реакции.[3] Раннее применение этого типа реакции было отмечено при образовании пептидных связей (с CO2 формирование как движущая сила). Предлагаемый механизм реакции между карбоновой кислотой и CDI представлен ниже.
В области пептидного синтеза этот продукт можно обработать амином, таким как тот, который содержится в аминокислоте, для высвобождения имидазольной группы и связывания пептидов. Побочные продукты, диоксид углерода и имидазол, относительно безвредны.[4] Рацемизация аминокислоты также имеет тенденцию быть минимальным, что отражает мягкие условия реакции.
CDI также можно использовать для этерификация, несмотря на то что алкоголиз требует тепла или наличия таких сильнодействующих нуклеофилов, как этоксид натрия,[1][3] или другие сильные основания, такие как NaH. Эта реакция обычно имеет хороший выход и широкий диапазон, хотя образование сложного эфира из третичных спиртов, когда кислотный реагент имеет относительно кислый α-протон, является проблематичным, поскольку C-C конденсации может произойти, хотя это само по себе может быть желательной реакцией.[1] Аналогичная реакция с участием тиолы и селенолы могут давать соответствующие эфиры.[5] Реакция спирта также может быть использована для образования гликозидных связей.[6]
Точно так же вместо спирта можно использовать кислоту для образования ангидрид, несмотря на то что дициклогексилкарбодиимид - более типичный реагент. В равновесие может быть сдвинут в пользу ангидрида за счет использования кислоты в соотношении 2: 1, которая образует нерастворимую соль с имидазолом. Типичными кислотами являются трифтор- и трихлоруксусные кислоты. Таким образом, симметричные ангидриды могут быть образованы заменой этой трифтор- или трихлорацетильной группы кислотой, которая использовалась для образования исходного реагента.
Другая родственная реакция - это реакция муравьиная кислота с CDI с образованием формилизированного имидазола. Этот реагент хороший формилирующий агент и может регенерировать незамещенный имидазол (с образованием моноксида углерода) при нагревании.
Еще одна реакция включает ацилирование трифенилалкелинфосфоранов.
- (C6ЧАС5)3P = CHR + R'-CO-Im → (C6ЧАС5)3п+-CHR-COR '+ Я−
(C6ЧАС5)3п+-CHR-COR '+ (C6ЧАС5)3P = CHR → (C6ЧАС5)3P = CR-COR '+ (С6ЧАС5)3п+-CH2р
- (C6ЧАС5)3P = CHR + R'-CO-Im → (C6ЧАС5)3п+-CHR-COR '+ Я−
Они могут пройти Реакция Виттига с образованием α, β ненасыщенных кетонов или альдегидов.
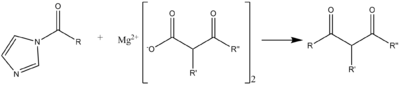
Реагент может даже вступать в реакцию с перекись сформировать пероксикарбоновая кислота, которые могут далее реагировать с образованием диацилпероксидов. Группа имидазола также восстанавливается LiAlH4 с образованием альдегидов из карбоновой кислоты (а не аминов или спиртов). Реагент также может реагировать с Реактивы Гриньяра с образованием кетонов.[1]
Реакция C-C ацилирования может происходить с малоновый эфир Соединение -типа, на следующей схеме полезно для синтеза макролидных антибиотиков.[7]
Другие реакции
N-фенилиминопроизводное CDI может быть образовано по реакции Виттига с трифенилфосфин фенилимид.[1]
- OCIm2 + Ph3P = NPh → PhN = CIm2 + Ph3PO
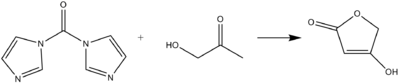
CDI может действовать как карбонильный эквивалент при образовании тетроновые кислоты или же пульвиноны из гидроксикетонов и дикетонов в основных условиях.[8]
Спирт, обработанный по меньшей мере 3 эквивалентами активированного галогенида (такого как аллилбромид или йодметан) и CDI, дает соответствующий галогенид с хорошим выходом. Лучше всего работают бромирование и йодирование, хотя эта реакция не сохраняет стереохимия алкоголя. В аналогичном контексте CDI часто используется в реакциях дегидратации.[3]
Поскольку CDI является эквивалентом фосген, его можно использовать в аналогичной реакции, однако с повышенной селективностью: он позволяет синтезировать асимметричные бисалкилкарбонаты.[9]
Смотрите также
- Тиокарбонилдиимидазол (TCDI) аналог тиомочевины
Рекомендации
- ^ а б c d е ж Х.А. Стааб (1962). «Синтезы с использованием гетероциклических амидов (азолидов)». Angewandte Chemie International Edition на английском языке. 1 (7): 351–367. Дои:10.1002 / anie.196203511.
- ^ Х.А. Стааб и К. Вендель (1973). «1,1'-Карбонилдиимидазол». Органический синтез.; Коллективный объем, 5, п. 201
- ^ а б c d А. Армстронг; Венджу Ли (2007). «N, N'-Карбонилдиимидазол». Энциклопедия реагентов для органического синтеза. Дои:10.1002 / 9780470842898.rc024.pub2.
- ^ Р. Пол и Г. В. Андерсон (1960). "N, N'-Карбонилдиимидазол, новый пептидообразующий реагент"'". Журнал Американского химического общества. 82 (17): 4596–4600. Дои:10.1021 / ja01502a038.
- ^ Х.-Ж. Гайс (1977). «Синтез эфиров тиола и селенола из карбоновых кислот и тиолов или селенолов соответственно». Angewandte Chemie International Edition на английском языке. 16 (4): 244–246. Дои:10.1002 / anie.197702441.
- ^ М.Дж. Форд и С.В. Лей (1990). «Простая процедура гликозидирования в одном сосуде с помощью (1-имидазолилкаронил) гликозидов и бромида цинка». Synlett. 1990 (05): 255–256. Дои:10.1055 / с-1990-21053.
- ^ Д.В. Брукс; и другие. (1979). «С-ацилирование в практически нейтральных условиях». Angewandte Chemie International Edition на английском языке. 18: 72–74. Дои:10.1002 / anie.197900722.
- ^ П.Дж. Джеррис; и другие. (1979). «Легкий синтез простых тетроновых кислот и пульвинонов». Буквы Тетраэдра. 47 (47): 4517–4520. Дои:10.1016 / S0040-4039 (01) 86637-5.
- ^ Стив П. Раннард, Никола Дж. Дэвис (1999). «Управляемый синтез асимметричных диалкил и циклических карбонатов с использованием высокоселективных реакций имидазол-карбоксильных эфиров». Органические буквы. 1 (6): 933–936. Дои:10.1021 / ol9908528.