Гликогенин-1 - Glycogenin-1 - Wikipedia
Гликогенин-1 является фермент который участвует в биосинтезе гликоген. Он способен к самогликозилированию, образуя олигосахарид праймер, который служит субстратом для гликогенсинтазы. Это делается с помощью механизма между подразделениями. Он также играет роль в регуляции метаболизма гликогена. Рекомбинантный человеческий гликогенин-1 экспрессировался в Кишечная палочка и очищены с использованием обычных хроматография техники.[5]
Метаболизм гликогена
Гликоген - разветвленный полисахарид. Это основное средство глюкоза хранение в клетках животных. В организме человека двумя основными тканями, хранящими гликоген, являются печень и скелетные мышцы.[6] Гликоген обычно больше сконцентрирован в печени, но поскольку у людей гораздо больше мышечной массы, наши мышцы хранят около трех четвертей общего гликогена в нашем организме.
Расположение гликогена
Функция гликогена печени заключается в поддержании гомеостаза глюкозы, генерируя глюкозу посредством гликогенолиз чтобы компенсировать снижение уровня глюкозы, которое может происходить между приемами пищи. Благодаря наличию глюкозо-6-фосфатаза фермент, гепатоциты способны превращать гликоген в глюкозу, высвобождая ее в кровь для предотвращения гипогликемия.
В скелетных мышцах гликоген используется в качестве источника энергии для сокращения мышц во время упражнений. Различные функции гликогена в мышцах или печени заставляют механизмы регуляции его метаболизма различаться в каждой ткани.[7] Эти механизмы основаны главным образом на различиях в структуре и регуляции ферментов, катализирующих синтез, гликогенсинтаза (GS) и деградация, гликогенфосфорилаза (GF).
Синтез гликогена
Гликогенин является инициатором биосинтеза гликогена.[8][9] Этот белок представляет собой гликозилтрансферазу, обладающую способностью к аутогликозилированию с использованием UDP-глюкозы,[10] который помогает в росте до образования олигосахарида, состоящего из 8 глюкоз. Гликогенин - это олигомер, и он способен взаимодействовать с несколькими белками. В последние годы было идентифицировано семейство белков, GNIP (белок, взаимодействующий с гликогенином), которые взаимодействуют с гликогенином, стимулируя его активность по аутогликолизилированию.
Гликогенин-1
У человека два изоформы гликогенина может быть выражен: гликогенин-1, с молекулярной массой 37 кДа и кодируется геном GYG1, который экспрессируется в основном в мышцах; и гликогенин-2 с молекулярной массой 66 кДа, кодируемый геном GYG2, который экспрессируется в основном в печени, сердечной мышце и других типах тканей, но не в скелетных мышцах.[11]Гликогенин-1 был описан путем анализа гликогена скелетных мышц. Было установлено, что эта молекула объединена Ковалентная связь каждой зрелой молекуле мышечного гликогена.[12]
Ген
Структура
Ген гликогенина-1, размером более 13 килобайт, состоит из семи экзоны и шесть интроны. Его проксимальный промоутер содержит Коробка ТАТА, а циклический AMP реагирующий элемент и два предполагаемых сайта связывания Sp1 в Остров CpG, участок ДНК с высокой частотой CpG сайты. Также есть девять Электронные коробки которые связывают основная спираль-петля-спираль факторов транскрипции, специфичных для мышц.[13]
Расположение и транскрипция
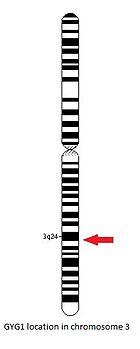
Ген GYG1 расположен на длинном плече хромосома 3 между положениями 24 и 25, от пары оснований 148,709,194 до пары оснований 148,745,455.[14]
Транскрипция гликогенина-1 человека в основном инициируется на 80 и 86 пар оснований выше транслятора кодон начало. Факторы транскрипции имеют разные сайты связывания для своего развития, некоторыми примерами являются: GATA, активаторный белок 1 и 2 (AP-1 и AP-2) и многочисленные потенциальные сайты связывания Octamer-1.[15]
Дефицит
Дефицит гликогенина-1 приводит к Болезнь накопления гликогена тип XV.
Мутация
Дефицит гликогенина-1 обнаружен в последовательности гена гликогенина-1, GYG1, что выявило несмысловую мутацию в одном аллель и миссенс-мутация, Thr83Met, в другом. Миссенс-мутация привела к инактивации аутогликозилирования гликогенина-1, что необходимо для праймирования синтеза гликогена в мышцах. Аутогликозилирование гликогенина-1 происходит в Tyr195 посредством гулозо-1-O-тирозиновой связи. Индуцированная миссенс-мутация этого остатка приводит к инактивированному аутогликозилированию. Однако было показано, что миссенс-мутация, затрагивающая некоторые другие остатки гликогенина-1, устраняет аутогликозилирование.
Последствия
Фенотипическими особенностями скелетных мышц у пациента с этим заболеванием являются истощение мышечного гликогена, митохондриальная пролиферация и заметное преобладание медленных окислительных мышечных волокон. Мутации в гене гликогенина-1 GYG1 также являются причиной кардиомиопатия и аритмия.[11]
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000163754 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000019528 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Подробная информация о гликогенине-1, 1-333 а.о., рекомбинантном белке. [1].
- ^ Алонсо, доктор медицины, Ломако Дж., Ломако В.М., Уилан В.Дж. (июнь 1995 г.). «Каталитическая активность гликогенина в дополнение к автокаталитическому самогликозилированию». Журнал биологической химии. 270 (25): 15315–9. Дои:10.1074 / jbc.270.25.15315. PMID 7797519.
- ^ Ньюсхолм Э.А. и Старт К. (1973). В регуляции метаболизма J. Wiley & sons. ред. Лондон Глава 3.
- ^ Ломако Дж., Ломако В. М., Уилан В. Дж. (Декабрь 1988 г.). «Самогликозилирующий белок является праймером для биосинтеза гликогена в мышцах кролика». Журнал FASEB. 2 (15): 3097–103. Дои:10.1096 / fasebj.2.15.2973423. PMID 2973423. S2CID 24083688.
- ^ Viskupic E, Cao Y, Zhang W, Cheng C, DePaoli-Roach AA, Roach PJ (декабрь 1992 г.). "Гликогенин скелетных мышц кролика. Молекулярное клонирование и производство полнофункционального белка в Escherichia coli". Журнал биологической химии. 267 (36): 25759–63. PMID 1281472.
- ^ Скурат А.В., Роуч П.Дж. (январь 1996 г.). «Множественные механизмы фосфорилирования С-концевых регуляторных участков в мышечной гликогенсинтазе кролика, экспрессируемой в клетках COS». Биохимический журнал. 313 (Pt 1) (Pt 1): 45–50. Дои:10.1042 / bj3130045. ЧВК 1216907. PMID 8546708.
- ^ а б Муслеми А.Р., Линдберг С., Нильссон Дж., Тайшарги Х., Андерссон Б., Олдфорс А (апрель 2010 г.). «Дефицит гликогенина-1 и инактивированное праймирование синтеза гликогена». Медицинский журнал Новой Англии. 362 (13): 1203–10. Дои:10.1056 / NEJMoa0900661. PMID 20357282.
- ^ Чжай Л., Дитрих А., Скурат А.В., Роуч П.Дж. (январь 2004 г.). «Структурно-функциональный анализ GNIP, белка, взаимодействующего с гликогенином». Архивы биохимии и биофизики. 421 (2): 236–42. Дои:10.1016 / j.abb.2003.11.017. PMID 14984203.
- ^ van Maanen MH, Fournier PA, Palmer TN, Abraham LJ (июль 1999 г.). «Характеристика гена гликогенина-1 человека: идентификация регуляторного домена, специфичного для мышц». Ген. 234 (2): 217–26. Дои:10.1016 / s0378-1119 (99) 00211-5. PMID 10395894.
- ^ "Где находится ген GYG1?" [2].
- ^ ван Маанен М., Фурнье П.А., Палмер Т.Н., Абрахам Л.Дж. (октябрь 1999 г.). «Характеристика кДНК гликогенина-1 мыши и промоторной области». Biochimica et Biophysica Acta (BBA) - Структура и экспрессия гена. 1447 (2–3): 284–90. Дои:10.1016 / s0167-4781 (99) 00159-1. PMID 10542328.
внешняя ссылка
- ван Маанен М., Фурнье П.А., Палмер Т.Н., Абрахам Л.Дж. (октябрь 1999 г.). «Характеристика кДНК гликогенина-1 мыши и промоторной области». Biochimica et Biophysica Acta (BBA) - Структура и экспрессия гена. 1447 (2–3): 284–90. Дои:10.1016 / s0167-4781 (99) 00159-1. PMID 10542328.
- van Maanen MH, Fournier PA, Palmer TN, Abraham LJ (июль 1999 г.). «Характеристика гена гликогенина-1 человека: идентификация регуляторного домена, специфичного для мышц». Ген. 234 (2): 217–26. Дои:10.1016 / s0378-1119 (99) 00211-5. PMID 10395894.




