Тетрамерный белок - Tetrameric protein

А тетрамерный белок это белок с четвертичная структура из четырех субъединиц (тетрамерная). Гомотетрамеры иметь четыре одинаковых подразделения (Такие как глутатион S-трансфераза ), и гетеротетрамеры находятся комплексы различных субъединиц. Тетрамер может быть собран как димер димеров с двумя гомодимер субъединицы (такие как сорбитолдегидрогеназа ) или два гетеродимер субъединицы (такие как гемоглобин ).
Субъединичные взаимодействия в тетрамерах
Взаимодействия между субъединицами, образующими тетрамер, в первую очередь определяются нековалентным взаимодействием.[1] Гидрофобные эффекты, водородные связи и электростатические взаимодействия являются основными источниками этого процесса связывания между субъединицами. Для гомотетрамерных белков, таких как Сорбитолдегидрогеназа (SDH), структура, как полагают, эволюционировала от мономерной к димерной и, наконец, к тетрамерной структуре. Процесс связывания в SDH и многих других тетрамерных ферментах можно описать увеличением свободная энергия который можно определить по скорости ассоциации и диссоциации.[1] На следующем изображении показана сборка четырех субъединиц (A, B, C и D) в SDH.
Водородные связи между субъединицами
Было показано, что сети водородных связей между субъединицами важны для стабильности тетрамерной четвертичная структура белка. Например, исследование SDH с использованием различных методов, таких как белок выравнивание последовательностей, структурные сравнения, расчеты энергии, эксперименты по гель-фильтрации и эксперименты по кинетике ферментов, могут выявить важную сеть водородных связей, которая стабилизирует тетрамерную четвертичную структуру в млекопитающее SDH.[1]
Тетрамеры в иммунологии
В иммунология, Тетрамеры MHC могут быть использованы в тетрамерные анализы, чтобы количественно определить количество антиген-специфичных Т-клетки (особенно CD8 + Т-клетки). Тетрамеры MHC основаны на рекомбинантных молекулы класса I которые под действием бактериального BirA были биотинилированы. Эти молекулы сворачиваются с помощью представляющего интерес пептида и β2M и тетрамеризуются флуоресцентно меченным стрептавидин. (Стрептавидин связывается с четырьмя биотины на молекулу.) Этот тетрамерный реагент будет специфически метить Т-клетки, которые экспрессируют Т-клеточные рецепторы, специфичные для данного комплекса пептид-MHC. Например, тетрамер Kb / FAPGNYPAL будет специфически связываться с вирусом Сендай. цитотоксические Т-клетки в мыши C57BL / 6. Антигенспецифические ответы могут быть измерены как CD8 +, тетрамер + Т-клетки как доля всех CD8 + лимфоцитов.
Причина использования тетрамера, в отличие от одной меченой молекулы MHC класса I, заключается в том, что тетраэдрические тетрамеры могут связываться с тремя TCR сразу, обеспечивая специфическое связывание, несмотря на низкое (10-6 молярное) сродство типичного взаимодействия пептида класса I с TCR.MHC класс II тетрамеры также могут быть получены, хотя с ними труднее работать на практике.[нужна цитата ]
Гомотетрамеры и гетеротетрамеры
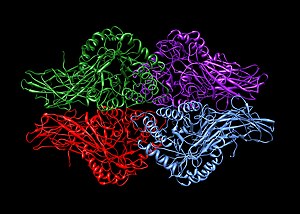

А гомотетрамер представляет собой белковый комплекс, состоящий из четырех идентичных субъединиц, которые связаны, но не связаны ковалентно.[2] И наоборот, a гетеротетрамер представляет собой комплекс из 4 субъединиц, в котором различаются одна или несколько субъединиц.[3]
Примеры гомотетрамеров включают:
- ферменты, такие как бета-глюкуронидаза (на фото)
- факторы экспорта, такие как SecB из кишечная палочка[4]
- магний переносчики ионов, такие как CorA.[5]
- лектины Такие как Конканавалин А
- IMPDH и IMPDH2
Примеры гетеротетрамеров включают гемоглобин (на фото), Рецептор NMDA, немного аквапорины,[6] немного Рецепторы AMPA, а также некоторые ферменты.[7]
Очистка гетеротетрамеров
Ионообменная хроматография полезен для выделения специфических гетеротетрамерных белковых ансамблей, что позволяет очищать специфические комплексы как по количеству, так и по положению заряженных пептидных меток.[8][9] Аффинная хроматография на никеле также может быть использован для очистки гетеротетрамера.[10]
Внутригенное дополнение
Множественные копии полипептида, кодируемого ген часто может образовывать агрегат, называемый мультимером. Когда мультимер образуется из полипептидов, продуцируемых двумя разными мутант аллели конкретного гена смешанный мультимер может проявлять большую функциональную активность, чем несмешанные мультимеры, образованные каждым из мутантов по отдельности. Когда смешанный мультимер демонстрирует повышенную функциональность по сравнению с несмешанными мультимерами, это явление упоминается как внутригенная комплементация. У людей аргининосукцинатлиаза (ASL) представляет собой гомотетрамерный фермент, который может подвергаться внутригенной комплементации. Расстройство ASL у людей может возникать в результате мутаций в ASL ген, особенно мутации, которые влияют на активный сайт тетрамерного фермента. Расстройство ASL связано со значительной клинической и генетической гетерогенностью, которая, как считается, отражает обширную внутригенную комплементацию, имеющую место у разных отдельных пациентов.[11][12][13]
Рекомендации
- ^ а б c Hellgren M, Kaiser C, de Haij S, Norberg A, Höög JO (2007). «Сеть водородных связей в сорбитолдегидрогеназе млекопитающих стабилизирует тетрамерное состояние и имеет важное значение для каталитической силы». Клетка. Мол. Life Sci. 64 (23): 3129–3138. Дои:10.1007 / s00018-007-7318-1. PMID 17952367. S2CID 22090973.
- ^ «GO-термин: гомотетрамеризация белков». YeastGenome. Архивировано из оригинал 27 сентября 2011 г.. Получено 14 мая 2011.
- ^ «GO-термин: гетеротетрамеризация белка». YeastGenome. Архивировано из оригинал 27 сентября 2011 г.. Получено 14 мая 2011.
- ^ Ватанабэ, М. Блобель, G (апрель 1989 г.). «Цитозольный фактор, очищенный от Escherichia coli, необходим и достаточен для экспорта препротеина и является гомотетрамером SecB». Труды Национальной академии наук Соединенных Штатов Америки. 86 (8): 2728–32. Bibcode:1989PNAS ... 86,2728 Вт. Дои:10.1073 / pnas.86.8.2728. ЧВК 286991. PMID 2649892.
- ^ Уоррен, М. А .; Кухарский, Л. М .; Veenstra, A .; Shi, L .; Грулич, П. Ф .; Магуайр, М. Э. (1 июля 2004 г.). "Транспортер CorA Mg2 + - гомотетрамер". Журнал бактериологии. 186 (14): 4605–4612. Дои:10.1128 / JB.186.14.4605-4612.2004. ЧВК 438605. PMID 15231793.
- ^ Neely, John D .; Christensen, Birgitte M .; Нильсен, Сорен; Агре, Питер (1 августа 1999 г.). «Гетеротетрамерный состав водных каналов Аквапорин-4». Биохимия. 38 (34): 11156–63. Дои:10.1021 / bi990941s. PMID 10460172.
- ^ Chang, T.-H .; Hsieh, F.-L .; Ко, Т.-П .; Teng, K.-H .; Liang, P.-H .; Wang, A.H.-J. (5 февраля 2010 г.). «Структура гетеротетрамерной геранилпирофосфат-синтазы из мяты (Mentha piperita) Раскрывает межсубъединенное регулирование ». Растительная клетка. 22 (2): 454–467. Дои:10.1105 / tpc.109.071738. ЧВК 2845413. PMID 20139160.
- ^ Sakash, J.B .; Кантровиц, Э. Р. (2000). "Вклад отдельных межцепочечных взаимодействий в стабилизацию T- и R-состояний кишечная палочка аспартат-транскарбамоилаза ". J Biol Chem. 275 (37): 28701–7. Дои:10.1074 / jbc.M005079200. PMID 10875936.
- ^ Фэйрхед, М. (2013). «Соединение по принципу Plug-and-Play через определенные двухвалентные стрептавидины». Дж Мол Биол. 426 (1): 199–214. Дои:10.1016 / j.jmb.2013.09.016. ЧВК 4047826. PMID 24056174.
- ^ Ховарт, Марк; Chinnapen, Daniel J-F; Герроу, Кимберли; Доррестейн, Питер С.; Гранди, Мелани Р.; Kelleher, Neil L; Эль-Хусейни, штат Алабама; Тинг, Алиса Y (2006). «Моновалентный стрептавидин с одним фемтомолярным сайтом связывания биотина». Методы природы. 3 (4): 267–73. Дои:10.1038 / nmeth861. ЧВК 2576293. PMID 16554831.
- ^ Тернер М.А., Симпсон А., Макиннес Р.Р., Хауэлл П.Л. (август 1997 г.). «Аргининосукцинатлиаза человека: структурная основа для внутригенной комплементации». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 94 (17): 9063–8. Bibcode:1997PNAS ... 94.9063T. Дои:10.1073 / пнас.94.17.9063. ЧВК 23030. PMID 9256435.
- ^ Ю. Б., Хауэлл П. Л. (октябрь 2000 г.). «Внутригенная комплементация, структура и функция аргининосукцинатлиазы». Клетка. Мол. Life Sci. 57 (11): 1637–51. Дои:10.1007 / PL00000646. PMID 11092456. S2CID 1254964.
- ^ Ю Б., Томпсон Г. Д., Ип П., Хауэлл П. Л., Дэвидсон А. Р. (декабрь 2001 г.). «Механизмы внутригенной комплементации в локусе аргининосукцинатлиазы человека». Биохимия. 40 (51): 15581–90. Дои:10.1021 / bi011526e. PMID 11747433.
