Глутатион S-трансфераза - Glutathione S-transferase
| Глутатион S-трансфераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
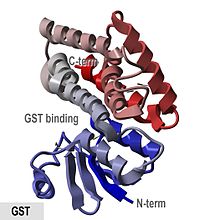 Кристаллографическая структура глутатиона S-трансфераза из Anopheles cracens.[1] | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 2.5.1.18 | ||||||||
| Количество CAS | 50812-37-8 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Глутатион S-трансферазы (GST), ранее известный как лигандины, составляют семейство эукариотических и прокариотических II этап метаболический изоферменты наиболее известны своей способностью катализировать сопряжение приведенной формы глутатион (GSH) в ксенобиотик субстраты с целью детоксикации. Семейство GST состоит из трех надсемейств: цитозольный, митохондриальный, и микросомальный -также известный как MAPEG —белки.[1][2][3] Члены суперсемейства GST чрезвычайно разнообразны по аминокислотная последовательность, и большая часть последовательностей, депонированных в общедоступных базах данных, имеет неизвестное назначение.[4] В Инициатива по ферментной функции (EFI) использует GST в качестве модельного суперсемейства для определения новых функций GST.
GST могут составлять до 10% цитозольного белка в некоторых органах млекопитающих.[5][6] GST катализируют конъюгацию GSH - через сульфгидрильную группу - с электрофильными центрами на широком спектре субстратов, чтобы сделать соединения более растворимыми в воде.[7][8] Эта активность выводит токсины из эндогенных соединений, таких как перекисные липиды и способствует разрушению ксенобиотиков. GST могут также связывать токсины и функционировать как транспортные белки, что дало начало раннему термину GST, лигандин.[9][10]
Классификация
| Глутатион S-трансфераза, C-терминальный домен | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Символ | GST_C | ||||||||
| Pfam | PF00043 | ||||||||
| ИнтерПро | IPR004046 | ||||||||
| SCOP2 | 2gst / Объем / СУПФАМ | ||||||||
| OPM суперсемейство | 178 | ||||||||
| Белок OPM | 5i9k | ||||||||
| CDD | cd00299 | ||||||||
| |||||||||
Последовательность и структура белков являются важными дополнительными критериями классификации для трех надсемейства (цитозольный, митохондриальный и MAPEG) GST: в то время как классы из цитозольного суперсемейства GST обладают более 40% гомология последовательностей, представители других классов могут иметь менее 25%. Цитозольные GST делятся на 13 классов в зависимости от их структуры: альфа, бета, дельта, эпсилон, дзета, тета, мю, ню, пи, сигма, тау, фи и омега. Митохондриальные GST относятся к классу каппа. Суперсемейство микросомальных GST MAPEG состоит из подгрупп, обозначенных I-IV, между которыми аминокислота последовательности имеют менее 20% идентичности. Человеческие цитозольные GST относятся к классам альфа, дзета, тета, мю, пи, сигма и омега, тогда как известно, что существуют шесть изоферментов, принадлежащих к классам I, II и IV суперсемейства MAPEG.[8][12][13]
Номенклатура
Стандартизованная номенклатура GST, впервые предложенная в 1992 г., идентифицирует виды, к которым принадлежит интересующий изофермент, с помощью строчной буквы (например, «h» для человека), которая предшествует аббревиатуре GST. Класс изоферментов впоследствии идентифицируется заглавной буквой (например, «A» для альфа), за которой следует арабская цифра, представляющая класс. подсемейство (или субъединица). Поскольку митохондриальные и цитозольные GST существуют как димеры, и только гетеродимеры образуются между членами одного и того же класса, второй подсемейский компонент димера фермента обозначается дефисом, за которым следует дополнительная арабская цифра.[12][13] Следовательно, если человеческий глутатион S-трансфераза является гомодимером в подсемействе 1 pi-класса, его имя будет записано как «hGSTP1-1».
Ранняя номенклатура GST называла их белками «Y», имея в виду их разделение на фракцию «Y» (в отличие от фракций «X и Z») с использованием хроматографии на сефадексе G75.[14] Когда были идентифицированы субъединицы GST, они были обозначены как Ya, Yp и т. Д. С, если необходимо, номером, идентифицирующим изоформу мономера (например, Yb1). Литвак и другие предложил термин «лигандин» для обозначения белков, ранее известных как белки «Y».[10]
В клинической химии и токсикологии чаще всего используются термины альфа-GST, мю-GST и пи-GST.
Структура
| Идентификаторы | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Символ | GST_N | ||||||||
| Pfam | PF02798 | ||||||||
| Pfam клан | CL0172 | ||||||||
| ИнтерПро | IPR004045 | ||||||||
| PROSITE | PS50404 | ||||||||
| SCOP2 | 1g7o / Объем / СУПФАМ | ||||||||
| |||||||||
Сайт связывания глутатиона или "G-сайт" расположен в тиоредоксин -подобный домен как цитозольных, так и митохондриальных GST. Область, содержащая наибольшую вариативность между разными классами, - это область спираль α2, где один из трех различных аминокислотных остатков взаимодействует с глицин остаток глутатиона. Две подгруппы цитозольных GST были охарактеризованы на основе их взаимодействия с глутатионом: группа Y-GST, которая использует тирозин остаток для активации глутатиона и S / C-GST, который вместо этого использует серин или же цистеин остатки.[8][15]
- "Белки GST представляют собой глобулярные белки с N-концевой смешанный спиральный и бета-цепочечный домен и полностью спиральный C-терминальный домен ".
В свинья Фермент p-класса pGTSP1-1 был первым GST, структура которого была определена, и он является представителем других членов суперсемейства цитозольных GST, которые содержат тиоредоксиноподобный N-Терминал домен, а также C-Терминал домен, состоящий из альфа спирали.[8][16]
Млекопитающее цитозольные GST димерный, причем обе субъединицы принадлежат к одному классу GST, хотя и не обязательно идентичны. В мономеры имеют размер примерно 25 кДа.[12][17] Они активны на широком спектре субстратов со значительным перекрытием.[18] В следующей таблице перечислены все ферменты GST каждого класса, которые, как известно, существуют в Homo sapiens, как обнаружено в UniProtKB / Swiss-Prot база данных.
| GST класс | Homo sapiens Члены класса GST (22) |
|---|---|
| Альфа | GSTA1, GSTA2, GSTA3, GSTA4, GSTA5 |
| Дельта | |
| Каппа | GSTK1 |
| Му | GSTM1, GSTM1L (РНКи), GSTM2, GSTM3, GSTM4, GSTM5 |
| Омега | GSTO1, GSTO2 |
| число Пи | GSTP1 |
| Тета | GSTT1, GSTT2, GSTT4 |
| Зета | GSTZ1 (также известная как MAAI-Maleylacetoacetate isomerase) |
| Микросомальный | MGST1, MGST2, MGST3 |
Функция
Активность GST зависит от постоянного поступления GSH из синтетических ферментов. гамма-глутамилцистеин синтетаза и глутатионсинтетаза, а также действие специфических переносчиков по удалению конъюгатов GSH из клетки. Основная роль GST заключается в детоксикации ксенобиотиков путем катализирования нуклеофильная атака посредством GSH на электрофильных атомах углерода, серы или азота указанных неполярных ксенобиотических субстратов, тем самым предотвращая их взаимодействие с важнейшими клеточными белками и нуклеиновыми кислотами.[13][19] В частности, функция GST в этой роли двоякая: связывать оба субстрата на гидрофобных участках фермента. ЧАС-сайт и GSH на соседнем гидрофильном участке G, которые вместе образуют активный сайт фермента; а затем активировать тиол группа GSH, обеспечивающая нуклеофильную атаку на субстрат.[12] Молекула глутатиона связывается в щели между N- и C-концевые домены - предполагается, что каталитически важные остатки находятся в N-терминальный домен.[20] Обе субъединицы димера GST, гетеро- или гомодимерные по природе, содержат один сайт связывания без субстрата, а также сайт связывания GSH. Однако в гетеродимерных комплексах GST, таких как комплексы, образованные цитозольными мю- и альфа-классами, зазор между двумя субъединицами является домом для дополнительного высокоаффинного несубстратного сайта связывания ксенобиотиков, который может объяснить способность ферментов образовывать гетеродимеры.[19][21]
Соединения, нацеленные таким образом на GST, охватывают широкий спектр экологических или других экзогенных токсинов, включая химиотерапевтические агенты и другие лекарственные средства, пестициды, гербициды, канцерогены и эпоксиды различного происхождения; действительно, GST ответственны за сопряжение β1-8,9-эпоксид, реакционноспособный промежуточный продукт, образованный из афлатоксин B1, который является важным средством защиты от токсина у грызунов. Реакции детоксикации включают первые четыре стадии: меркаптуровая кислота синтез,[19] при конъюгации с GSH, которая делает субстраты более растворимыми и позволяет им удаляться из клетки с помощью переносчиков, таких как белок 1, связанный с множественной лекарственной устойчивостью (MRP1 ).[8] После экспорта продукты конъюгации превращаются в меркаптуровую кислоту и выводятся через моча или же желчь.[13]
Большинство изоферментов млекопитающих обладают сродством к субстрату. 1-хлор-2,4-динитробензол и спектрофотометрические анализы с использованием этого субстрата обычно используются для определения активности GST.[22] Однако некоторые эндогенные соединения, например билирубин, могут подавлять активность GST. У млекопитающих изоформы GST имеют клеточно-специфическое распределение (например, α-GST в гепатоцитах и π-GST в желчных путях печени человека).[23]
Роль в передаче сигналов клетки

Хотя они наиболее известны своей способностью конъюгировать ксенобиотики с GSH и тем самым детоксифицировать клеточную среду, GST также способны связывать не субстратные лиганды, с важными клеточная сигнализация подразумеваемое. Было показано, что несколько изоферментов GST из различных классов ингибируют функцию киназа участвует в Путь MAPK что регулирует распространение клеток и смерть, не позволяя киназе выполнять свою роль в обеспечении сигнального каскада.[24]
Цитозольный GSTP1-1, хорошо охарактеризованный изофермент семейства GST млекопитающих, экспрессируется главным образом в тканях сердца, легких и головного мозга; Фактически, это наиболее распространенный GST, экспрессируемый вне печени.[24][25] Основываясь на его сверхэкспрессии в большинстве линий опухолевых клеток человека и распространенности в опухолях, устойчивых к химиотерапии, GSTP1-1, как полагают, играет роль в развитии рака и его потенциале. сопротивление к медикаментозному лечению. Дополнительным доказательством этого является знание того, что GSTP может выборочно подавлять C-Июнь фосфорилирование JNK, предотвращая апоптоз.[24] Во время низкого клеточного стресса комплекс образуется за счет прямого белок-белковые взаимодействия между GSTP и C-конце JNK, эффективно предотвращая действие JNK и тем самым его индукцию пути JNK. Сотовый окислительный стресс вызывает диссоциацию комплекса, олигомеризацию GSTP и индукцию пути JNK, что приводит к апоптоз.[26] Связь между ингибированием GSTP проапоптотического пути JNK и сверхэкспрессией изофермента в устойчивых к лекарствам опухолевых клетках может сама объяснять способность опухолевых клеток избегать апоптоза, опосредованного лекарствами, которые не являются субстратами GSTP.[24]
Как и GSTP, GSTM1 участвует в регуляции путей апоптоза через прямые межбелковые взаимодействия, хотя и действует на ASK1, который находится выше JNK. Механизм и результат аналогичны GSTP и JNK в том, что GSTM1 секвестрирует ASK1 посредством образования комплекса и предотвращает его индукцию проапоптотических стр.38 и части JNK сигнального каскада MAPK. Подобно GSTP, GSTM1 взаимодействует со своим партнером в отсутствие окислительного стресса, хотя ASK1 также участвует в тепловой удар ответ, который также предотвращается во время секвестрации ASK1. Тот факт, что высокие уровни GST связаны с устойчивостью к апоптозу, индуцированному рядом веществ, включая химиотерапевтические агенты, подтверждает его предполагаемую роль в предотвращении передачи сигналов MAPK.[26]
Последствия для развития рака
Появляется все больше доказательств, подтверждающих роль GST, особенно GSTP, в развитии рака и устойчивости к химиотерапии. Связь между GSTP и раком наиболее очевидна в сверхэкспрессии GSTP при многих формах рака, но это также подтверждается тем фактом, что трансформированный фенотип опухолевых клеток связан с аберрантно регулируемыми сигнальными путями киназы и клеточной зависимостью от сверхэкспрессируемых белков. То, что большинство противораковых препаратов являются плохими субстратами для GSTP, указывает на то, что роль повышенного уровня GSTP во многих линиях опухолевых клеток заключается не в детоксикации соединений, а в другой цели; Эта гипотеза также подтверждается общим обнаружением сверхэкспрессии GSTP в линиях опухолевых клеток, которые не устойчивы к лекарствам.[27]
Клиническое значение
Помимо своей роли в развитии рака и устойчивости к химиотерапевтическим препаратам, GST участвуют в различных заболеваниях в силу своего участия в GSH. Хотя доказательства влияния GST минимальны. полиморфизмы классов альфа, мю, пи и тета на предрасположенность к различным типам рака многочисленные исследования выявили такие генотипические вариации в астма, атеросклероз, аллергия, и другие воспалительный болезни.[19]
Потому что сахарный диабет это заболевание, которое включает окислительное повреждение, и метаболизм GSH нарушен у пациентов с диабетом, GST могут представлять собой потенциальную мишень для лекарственного лечения диабета. Кроме того, инсулин известно, что введение приводит к увеличению экспрессии гена GST через Путь PI3K / AKT / mTOR и снижение внутриклеточного окислительного стресса, в то время как глюкагон снижает экспрессию такого гена.[28]
Гены GST (GSTO) класса омега, в частности, связаны с неврологическими заболеваниями, такими как Болезнь Альцгеймера, Болезнь Паркинсона, и боковой амиотрофический склероз; опять же, считается, что виновником является окислительный стресс, снижение экспрессии гена GSTO приводит к снижению возраста начала заболевания.[29]
Выпуск GST как признак повреждения органа
Высокие внутриклеточные концентрации GST в сочетании с их клеточно-специфическим клеточным распределением позволяют им функционировать в качестве биомаркеров для локализации и мониторинга повреждений определенных типов клеток. Например, гепатоциты содержат высокий уровень альфа-GST, и было обнаружено, что сывороточный альфа-GST является индикатором повреждения гепатоцитов в трансплантация, токсичность и вирусные инфекции.[30][31][32]
Точно так же у людей клетки проксимальных канальцев почек содержат высокие концентрации альфа-GST, тогда как клетки дистальных канальцев содержат pi-GST.[33] Это конкретное распределение позволяет использовать измерение GST в моче для количественной оценки и локализации повреждения почечных канальцев у трансплантация, нефротоксичность и ишемическое повреждение.[34]
В доклинических исследованиях на грызунах было показано, что альфа-GST в моче и сыворотке являются чувствительными и специфическими индикаторами некроза проксимальных канальцев почек и некроза гепатоцитов соответственно.[35][36]
GST-метки и анализ GST pull-down
GST может быть добавлен к интересующему белку для очистки его от раствора в процессе, известном как анализ методом вытягивания вниз. Это достигается путем вставки кодирующей последовательности ДНК GST рядом с последовательностью, которая кодирует интересующий белок. Таким образом, после транскрипции и трансляции белок GST и интересующий белок будут экспрессироваться вместе как гибридный белок. Поскольку белок GST обладает сильным сродством связывания с GSH, к смеси белков можно добавлять шарики, покрытые этим соединением; в результате интересующий белок, присоединенный к GST, будет прилипать к гранулам, изолируя белок от остальных белков в растворе. Гранулы извлекают и промывают свободным GSH, чтобы отделить интересующий белок от гранул, в результате чего получают очищенный белок. Этот метод можно использовать для выяснения прямых межбелковых взаимодействий. Недостатком этого анализа является то, что интересующий белок присоединяется к GST, изменяя его нативное состояние.[37][38]
GST-тег часто используется для разделения и очистки белков, содержащих слитый с GST белок. Тег 220 аминокислоты (примерно 26 кДа) размером,[39] что по сравнению с такими тегами, как Myc-tag или ФЛАГ-тег, довольно большой. Его можно соединить с N-терминал или же C-терминал протеина. Однако многие коммерчески доступные источники плазмид, меченных GST, включают тромбин домен для расщепления GST-метки во время очистки белка.[37][40]
Смотрите также
- Аффинная хроматография
- Бактериальная глутатионтрансфераза
- Глутатион S-трансфераза Mu 1
- Глутатион S-трансфераза, C-терминальный домен
- GSTP1
- Белок, связывающий мальтозу
- Белковая метка
Рекомендации
- ^ а б PDB: 1R5A; Udomsinprasert R, Pongjaroenkit S, Wongsantichon J, Oakley AJ, Prapanthadara LA, Wilce MC, Ketterman AJ (июнь 2005 г.). «Идентификация, характеристика и структура нового изофермента глутатионтрансферазы класса Delta». Биохимический журнал. 388 (Pt 3): 763–71. Дои:10.1042 / BJ20042015. ЧВК 1183455. PMID 15717864.
- ^ Шихан Д., Мид Дж., Фоли В.М., Дауд Калифорния (ноябрь 2001 г.). «Структура, функция и эволюция трансфераз глутатиона: значение для классификации не млекопитающих членов древнего суперсемейства ферментов». Биохимический журнал. 360 (Чт 1): 1–16. Дои:10.1042/0264-6021:3600001. ЧВК 1222196. PMID 11695986.
- ^ Аллокати Н., Федеричи Л., Масулли М., Ди Илио С. (январь 2009 г.). «Трансферазы глутатиона в бактериях». Журнал FEBS. 276 (1): 58–75. Дои:10.1111 / j.1742-4658.2008.06743.x. PMID 19016852.
- ^ Аткинсон Х. Дж., Бэббит ПК (ноябрь 2009 г.). «Трансферазы глутатиона являются структурными и функциональными отклонениями в тиоредоксиновой складке». Биохимия. 48 (46): 11108–16. Дои:10.1021 / bi901180v. ЧВК 2778357. PMID 19842715.
- ^ Бойер Т.Д. (март 1989 г.). "Глутатион S-трансферазы: обновление ». Гепатология. 9 (3): 486–96. Дои:10.1002 / hep.1840090324. PMID 2646197.
- ^ Муканганьяма С., Безабих М., Роберт М., Нгаджи Б.Т., Капче Г.Ф., Нгандеу Ф., Абегаз Б. (август 2011 г.). «Оценка новых натуральных продуктов в качестве ингибиторов человеческой глутатионтрансферазы P1-1». Журнал ингибирования ферментов и медицинской химии. 26 (4): 460–7. Дои:10.3109/14756366.2010.526769. PMID 21028940. S2CID 41391243.
- ^ Дуглас К.Т. (1987). «Механизм действия глутатион-зависимых ферментов». Достижения в энзимологии и смежных областях молекулярной биологии. Достижения в энзимологии и смежных областях молекулярной биологии. 59. стр.103–67. Дои:10.1002 / 9780470123058.ch3. ISBN 9780470123058. PMID 2880477.
- ^ а б c d е Окли А (май 2011 г.). «Трансферазы глутатиона: структурная перспектива». Обзоры метаболизма лекарств. 43 (2): 138–51. Дои:10.3109/03602532.2011.558093. PMID 21428697. S2CID 16400885.
- ^ Ливер MJ, Джордж С.Г. (1998). "Рыбный глутатион S-трансфераза, эффективно связывающая конечные продукты перекисного окисления липидов ». Исследования морской среды. 46 (1–5): 71–74. Дои:10.1016 / S0141-1136 (97) 00071-8.
- ^ а б Литвак Г., Кеттерер Б., Ариас И.М. (декабрь 1971 г.). «Лигандин: печеночный белок, который связывает стероиды, билирубин, канцерогены и ряд экзогенных органических анионов». Природа. 234 (5330): 466–7. Дои:10.1038 / 234466a0. PMID 4944188. S2CID 4216672.
- ^ PDB: 2GST; Джи Х, Джонсон В.В., Сесай М.А., Дикерт Л., Прасад С.М., Аммон Х.Л., Армстронг Р.Н., Гиллиланд Г.Л. (февраль 1994 г.). «Структура и функция сайта связывания ксенобиотического субстрата глутатиона. S-трансферазы, что выявлено с помощью рентгеноструктурного анализа комплексов продуктов с диастереомерами 9- (S-глутатионил) -10-гидрокси-9,10-дигидрофенантрен ». Биохимия. 33 (5): 1043–52. Дои:10.1021 / bi00171a002. PMID 8110735.
- ^ а б c d Итон Д.Л., Баммлер Т.К. (июнь 1999 г.). "Краткий обзор глутатиона S-трансферазы и их значение для токсикологии ». Токсикологические науки. 49 (2): 156–64. Дои:10.1093 / toxsci / 49.2.156. PMID 10416260.
- ^ а б c d Джозефи П.Д. (июнь 2010 г.). «Генетические вариации ферментов глутатионтрансферазы человека: значение для фармакологии и токсикологии». Геномика и протеомика человека. 2010: 876940. Дои:10.4061/2010/876940. ЧВК 2958679. PMID 20981235.
- ^ Леви А.Дж., Гатмайтан З., Ариас И.М. (ноябрь 1969 г.). «Две фракции цитоплазматических белков печени, Y и Z, и их возможная роль в захвате печенью билирубина, сульфобромофталеина и других анионов». Журнал клинических исследований. 48 (11): 2156–67. Дои:10.1172 / JCI106182. ЧВК 297469. PMID 4980931.
- ^ Аткинсон Х. Дж., Бэббит ПК (ноябрь 2009 г.). «Трансферазы глутатиона являются структурными и функциональными отклонениями в тиоредоксиновой складке». Биохимия. 48 (46): 11108–16. Дои:10.1021 / bi901180v. ЧВК 2778357. PMID 19842715.
- ^ Пак А. К., Мун Дж. Х., Чан Э. Х., Пак Х, Ан И. Ю., Ли К. С., Чи Ю. М. (март 2013 г.). "Структура глутатиона класса GST, специфичного для моллюсков S-трансфераза антарктического двустворчатого моллюска Laternula elliptica обнаруживает новую архитектуру активного участка ". Белки. 81 (3): 531–7. Дои:10.1002 / prot.24208. PMID 23152139.
- ^ Landi S (октябрь 2000 г.). «Класс млекопитающих тета GST и дифференциальная восприимчивость к канцерогенам: обзор». Мутационные исследования. 463 (3): 247–83. Дои:10.1016 / с 1383-5742 (00) 00050-8. PMID 11018744.
- ^ Раза Х (ноябрь 2011 г.). «Двойная локализация глутатиона S-трансфераза в цитозоле и митохондриях: влияние на окислительный стресс, токсичность и болезнь ». Журнал FEBS. 278 (22): 4243–51. Дои:10.1111 / j.1742-4658.2011.08358.x. ЧВК 3204177. PMID 21929724.
- ^ а б c d Hayes JD, Flanagan JU, Jowsey IR (2005). «Трансферазы глутатиона». Ежегодный обзор фармакологии и токсикологии. 45: 51–88. Дои:10.1146 / annurev.pharmtox.45.120403.095857. PMID 15822171.
- ^ Нисида М., Харада С., Ногучи С., Сато Й., Иноуэ Х., Такахаши К. (август 1998 г.). «Трехмерная структура кишечная палочка глутатион S-трансфераза в комплексе с глутатионсульфонатом: каталитическая роль Cys10 и His106 ». Журнал молекулярной биологии. 281 (1): 135–47. Дои:10.1006 / jmbi.1998.1927. PMID 9680481.
- ^ Варго М.А., Колман РФ (январь 2001 г.). "Маркировка сродства крысиного глутатиона S-трансферазный изофермент 1-1 посредством 17β-йодацетоксиэстрадиол-3-сульфата ». Журнал биологической химии. 276 (3): 2031–6. Дои:10.1074 / jbc.M008212200. PMID 11031273.
- ^ Habig WH, Pabst MJ, Fleischner G, Gatmaitan Z, Arias IM, Jakoby WB (октябрь 1974 г.). "Личность глутатиона S-трансфераза B с лигандином, основным связывающим белком печени ». Труды Национальной академии наук Соединенных Штатов Америки. 71 (10): 3879–82. Дои:10.1073 / пнас.71.10.3879. ЧВК 434288. PMID 4139704.
- ^ Беккет GJ, Hayes JD (1987). «Глутатион S-измерения трансфераз и заболевания печени у человека ». Журнал клинической биохимии и питания. 2: 1–24. Дои:10.3164 / jcbn.2.1.
- ^ а б c d Лаборде Э (сентябрь 2010 г.). «Трансферазы глутатиона как медиаторы сигнальных путей, участвующих в пролиферации и гибели клеток». Гибель клеток и дифференциация. 17 (9): 1373–80. Дои:10.1038 / cdd.2010.80. PMID 20596078.
- ^ Адлер В., Инь З., Фукс С.И., Бенезра М., Розарио Л., Тью К.Д., Пинкус М.Р., Сардана М., Хендерсон К.Дж., Вольф С.Р., Дэвис Р.Дж., Ронаи З. (март 1999 г.). "Регулирование передачи сигналов JNK посредством GSTp". Журнал EMBO. 18 (5): 1321–34. Дои:10.1093 / emboj / 18.5.1321. ЧВК 1171222. PMID 10064598.
- ^ а б Townsend DM, Tew KD (октябрь 2003 г.). «Роль глутатиона-S-трансфераза при устойчивости к противораковым препаратам ». Онкоген. 22 (47): 7369–75. Дои:10.1038 / sj.onc.1206940. ЧВК 6361125. PMID 14576844.
- ^ Тью К.Д., Маневич Ю., Грек С., Сюн Ю., Уйс Дж., Таунсенд Д.М. (июль 2011 г.). "Роль глутатиона S-трансфераза P в сигнальных путях и S-глутатионилирование при раке ». Свободная радикальная биология и медицина. 51 (2): 299–313. Дои:10.1016 / j.freeradbiomed.2011.04.013. ЧВК 3125017. PMID 21558000.
- ^ Franco R, Schoneveld OJ, Pappa A, Panayiotidis MI (2007). «Центральная роль глутатиона в патофизиологии болезней человека». Архив физиологии и биохимии. 113 (4–5): 234–58. Дои:10.1080/13813450701661198. PMID 18158646. S2CID 35240599.
- ^ Board PG (май 2011 г.). «Трансферазы глутатиона омега-класса: структура, функции и генетика». Обзоры метаболизма лекарств. 43 (2): 226–35. Дои:10.3109/03602532.2011.561353. PMID 21495794. S2CID 27736207.
- ^ Беккет Г.Дж., Чепмен Б.Дж., Дайсон Э.Х., Хейс Дж.Д. (январь 1985 г.). "Плазменный глутатион S-измерения трансферазы после передозировки парацетамола: свидетельство раннего гепатоцеллюлярного повреждения ». Кишечник. 26 (1): 26–31. Дои:10.1136 / гут.26.1.26. ЧВК 1432412. PMID 3965363.
- ^ Хьюз В.Ф., Трул А.К., Гимсон А., Френд П.Дж., Джеймисон Н., Дункан А., Уайт Д.Г., Прево А.Т., Александр Г.Дж. (ноябрь 1997 г.). "Рандомизированное исследование для оценки клинических преимуществ сывороточного альфа-глутатиона. S-мониторинг концентрации трансферазы после трансплантации печени ». Трансплантация. 64 (10): 1446–52. Дои:10.1097/00007890-199711270-00013. PMID 9392310.
- ^ Loguercio C, Caporaso N, Tuccillo C, Morisco F, Del Vecchio Blanco G, Del Vecchio Blanco C (март 1998 г.). «Трансферазы альфа-глутатиона при хроническом гепатите, связанном с ВГС: новый прогностический индекс ответа на терапию интерфероном?». Журнал гепатологии. 28 (3): 390–5. Дои:10.1016 / s0168-8278 (98) 80311-5. PMID 9551675.
- ^ Харрисон Д. Д., Харбанда Р., Каннингем Д. С., Маклеллан Л. И., Хейс Д. Д. (июнь 1989 г.). "Распространение глутатиона S-изоферменты трансферазы в почках человека: основа для возможных маркеров почечного повреждения ». Журнал клинической патологии. 42 (6): 624–8. Дои:10.1136 / jcp.42.6.624. ЧВК 1141991. PMID 2738168.
- ^ Сундберг А.Г., Аппельквист Е.Л., Бекман Л., Даллнер Г. (1994). «Мочевой pi-класс глутатионтрансферазы как индикатор повреждения канальцев в почках человека». Нефрон. 67 (3): 308–16. Дои:10.1159/000187985. PMID 7936021.
- ^ Харпур Е., Эннулат Д., Хоффман Д., Беттон Дж., Готье Дж. К., Рифке Б., Баунус Д., Шустер К., Бойхаузен С., Гаффрой М., Шоу М., Лок Е., Петтит С. (август 2011 г.). «Биологическая квалификация биомаркеров химически индуцированной почечной токсичности у двух линий самцов крыс». Токсикологические науки. 122 (2): 235–52. Дои:10.1093 / toxsci / kfr112. PMID 21593213.
- ^ Бейли В.Дж., Держатель Д., Патель Х, Девлин П., Гонсалес Р.Дж., Гамильтон В., Муниаппа Н., Хамлин Д.М., Томас К.Э., Систаре Ф.Д., Глааб В.Е. (декабрь 2012 г.). "Оценка эффективности трех биомаркеров лекарственного поражения печени у крыс: альфа-глутатиона. S-трансфераза, аргиназа 1 и 4-гидроксифенилпируват диоксигеназа » (PDF). Токсикологические науки. 130 (2): 229–44. Дои:10.1093 / toxsci / kfs243. PMID 22872058.
- ^ а б Бенард V, Бокоч GM (2002). «Анализ активации Cdc42, Rac и Rho GTPase методами аффинности». Пути G-белка - Часть C, Эффекторные механизмы. Методы в энзимологии. 345. С. 349–59. Дои:10.1016 / с0076-6879 (02) 45028-8. ISBN 9780121822460. PMID 11665618.
- ^ Рен Л., Чанг Э., Макки К., Хаас А.Л., Каборд Б., Валид Коронфлех М. (ноябрь 2003 г.). «Глутатион S-трансферазный анализ с использованием дегидратированной иммобилизованной глутатионовой смолы ». Аналитическая биохимия. 322 (2): 164–9. Дои:10.1016 / j.ab.2003.07.023. PMID 14596823.
- ^ Long F, Cho W, Ishii Y (сентябрь 2011 г.). «Выражение и очищение 15N- и 13С-изотоп, меченный 40-остатками β-амилоидного пептида человека при болезни Альцгеймера, для структурного анализа на основе ЯМР ". Экспрессия и очистка белков. 79 (1): 16–24. Дои:10.1016 / j.pep.2011.05.012. ЧВК 3134129. PMID 21640828.
- ^ Тинта Т., Кристиансен Л.С., Конрад А., Либерлес Д.А., Тюрк В., Мунк-Петерсен Б., Пишкур Дж., Клаузен А.Р. (июнь 2012 г.). «Дезоксирибонуклеозидкиназы двух водных бактерий с высокой специфичностью к тимидину и дезоксиаденозину». Письма о микробиологии FEMS. 331 (2): 120–7. Дои:10.1111 / j.1574-6968.2012.02565.x. PMID 22462611.
внешняя ссылка
- Обзор глутатиона S-Трансферазы
- Глутатион + S-трансфераза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- EC 2.5.1.18
- Приготовление слитых белков GST
- Справочник по системе слияния генов GST
