Трифторметилирование - Trifluoromethylation
Трифторметилирование в органическая химия описывает любые органическая реакция что вводит трифторметил группа в органическом соединении.[1][2][3][4] Трифторметилированные соединения играют важную роль в фармацевтическая индустрия и агрохимикаты. Несколько примечательных фармацевтический соединения включают трифторметильную группу: флуоксетин, мефлохин, Лефлуномид, нулитамид, дутастерид, бикалутамид, настойчивый, целекоксиб, фипронил, флуазинам, пентиопирад, пикоксистробин, флуридон, норфлуразон, сорафениб и трифлуразин. Соответствующий агрохимикат трифлуралин. Разработка синтетических методов присоединения трифторметильных групп к химическим соединениям активно ведется в академических исследованиях.
История
Первым, кто исследовал связь трифторметильных групп с биологической активностью, был Ф. Леманн в 1927 году.[5] Ранний обзор появился в 1958 году.[6] Ранний синтетический метод был разработан Фредерик Свартс в 1892 г.,[7] на основе фторид сурьмы. В этой реакции бензотрихлорид реагировал с SbF3 сформировать PhCF2Cl и PhCF3. В 1930-е гг. Кинетические химикаты и IG Farben заменил SbF3 с HF. Реакция Маклафлина-Троуэра (1968) - ранний реакция сочетания с использованием йодофторалканов, йодоароматических соединений и медь.[8] В 1969 году Кобаяси и Кумадаки адаптировали свой протокол для трифторметилирования.[9][10]
 |
| Реакция Маклафлина-Троуэра (1968) |
Реагенты
Трифторметилтриметилсилан
Подготовка трифторметилтриметилсилан об этом сообщил Инго Рупперт в 1984 году.[11] В 1989 году Пракаш и Олах впервые сообщили об активации TMSCF.3 фторидом для проведения нуклеофильного трифторметилирования карбонильных соединений.[12] В том же году Стахли описал аналогичные реакции для синтеза трифторметилированных фенолов и анилинов.[13] С тех пор TMSCF3 широко используется в качестве нуклеофильного трифторметилирующего агента.[14][15]
Примером может служить трифторметилирование циклогексанон в THF с использованием фторид тетрабутиламмония.[16]
 |
| Трифторметилирование с использованием трифторметилтриметилсилан[16] |
Подложки могут быть арилгалогенидами.[17][18] (Трифторметил) триметоксиборат калия для этой цели был синтезирован из B (OMe)3, CF3SiMe3 и К.Ф.[19] Сообщалось также о функционализации арила за счет активации C-H.[20][21]
Трифторацетат натрия
Трифторацетат натрия в качестве реагента для трифторметилирования был введен Мацуи в 1981 году. В первоначальном объеме субстрат представлял собой ароматический галогенид и соль металла иодид меди (I).[22][23]
Трифторметан
Фтороформ (CF3H) был использован в качестве реагента трифторметилирования для альдегидов в сочетании с сильным основанием[24]
 |
| Трифторметилирование фтороформ фоллеас 1998 г.[24] |
Трифториодметан
Трифториодметан является реагентом в реакциях ароматического сочетания. Он также использовался с Enones, например с халкон, реакция, катализируемая диэтилцинк и Катализатор Уилкинсона:[25]
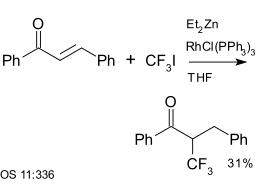 |
| Трифторметилирование с использованием диэтилцинк и Катализатор Уилкинсона[25] |
Трифторметилсульфон
Трифторметилсульфон (PhSO2CF3) и трифторметилсульфоксид (PhSOCF3) может использоваться для трифторметилирования электрофилов[26]
Трифторметансульфонилхлорид
Трифторметансульфонилхлорид (или мелочь хлорид, CF3SO2Cl) можно использовать в высокоэффективном методе введения трифторметильной группы в ароматические и гетероароматические системы, включая известные фармацевтические препараты, такие как Липитор. Химия носит общий характер и мягкая, и использует фотоокислительный катализатор и источник света комнатной температуры.[27]
Трифторметансульфинат натрия
Трифторметансульфинат натрия (CF3ТАК2Na) в качестве реагента для трифторметилирования был введен Ланглуа в 1991 г.[28] Реакция требует трет-бутилгидропероксид и, как правило, металл и действует по радикальному механизму. Реагент нанесен на гетероциклические субстраты.[29]
 |
| Трифторирование Реагент Ланглуа 2011[29] |
Реагенты Умемото
Реагенты Умемото представляют собой (трифторметил) дибензогетероциклические соли.[30][31]
Трифторметилметаллические реагенты
Многие CF3-содержащие комплексы металлов, некоторые из которых могут быть использованы для трифторметилирования. Самый очевидный реагент - CF3Li, который может быть получен при обмене на иодид лития. Однако это соединение нестабильно даже при низких температурах. Это деградирует до фторид лития и дифторкарбен. Более пригодны реагенты трифторметилмеди (I). Эти реагенты генерируются in situ в результате реакции CF3I с медным порошком в полярных растворителях.[32] Hg (CF3)2, полученный декарбоксилированием трифторацетата, оказался полезным для трифторметилирования других металлов.[33]
Типы реакции
Реакции ароматического сочетания
В реакции сочетания между ароматические соединения и комплексы металл-трифторметил, металл обычно представляет собой медь, Pd и Ni менее заметны.[1] Реакции бывают стехиометрическими или каталитическими. В реакции Маклафлина-Троуэра (1962) йодобензол реагирует с трифториодметан (CF3I) и медный порошок в диметилформамид от 150 ° C до трифторметилбензол. Промежуточное соединение в этом типе реакции представляет собой комплекс перфторметил-металл.
А ацетат палладия В каталитической реакции, описанной в 1982 году, использовался цинковый порошок с основным промежуточным продуктом, который предположительно был CF3ZnI с Pd (0) является активным катализатором.[34][35] О первом катализируемом медью взаимодействии сообщалось в 2009 году на основе йодарен, а трифторметилсилан, йодид меди и 1,10-фенантролин.[36] Варианты включают другой CF3 донор (трифторметил) триметоксиборат калия,[37] использование арила бороновые кислоты[38][39] или использование трифторметила сульфония соль[40] или использование фенантролинового комплекса трифторметилмеди (I).[41] Каталитический палладий о каталитической реакции сообщили в 2010 году с использованием арилгалогениды, (трифторметил) триэтилсилан и димер хлорида аллилпалладия[42]
 |  |
| Ароматическое трифторметилирование Kitazume 1982[34] | Ароматический каталитический трифторметилирование Oishi 2009[36] |
Радикальное трифторметилирование
В радикальное трифторметилирование активным веществом является трифторметил свободный радикал.[43] Реагенты, такие как бромтрифторметан и галоформ были использованы для этой цели[44][45][46] но в ответ на Монреальский протокол альтернативы, такие как трифториодметан были разработаны в качестве замены.[47][48] Одна конкретная комбинация - CF3Я / триэтилборан[49][50]Другие реагенты, генерирующие CF3 радикальные трифторметансульфинат натрия и бис (трифторацетил) пероксид.
 |
| Трифторметилирование с использованием CF3Я и триэтилборан. База 2,6-лутидин[49] |
В CF3 радикал атом фтора является электроноакцепторная группа через индуктивный эффект но также слабый пи донор через взаимодействие фтора одинокая пара с радикальным центром SOMO. По сравнению с метильный радикал CF3 радикал пирамидальный (угол 107,8 ° C) с большим инверсионный барьер, электрофильный а также более реактивный. В реакции с стирол он в 440 раз более реактивен.[51] Ранний отчет (1949 г.) описывает фотохимическая реакция из иодтрифторметана с этиленом до 3-иод-1,1,1-трифторпропана.[52] Реагенты, о которых сообщалось для прямого трифторметилирования аренов, представляют собой CF3Я, CF3Br (термический или фотохимический), серебро трифторацетат / TiO2 (фотохимический) и трифторметансульфинат натрия / Cu (OSO2CF3)2/ tBuOOH.
Нуклеофильное трифторметилирование
При нуклеофильном трифторметилировании активным веществом является CF3− анион.[53] Однако было широко распространено мнение, что трифторметил-анион является временным веществом и, следовательно, не может быть выделен или обнаружен в конденсированной фазе. Вопреки распространенному мнению, CF3 анион, с [K (18-краун-6)]+ как противодействие, было произведено и охарактеризовано Пракашем и сотрудниками.[54] Проблемы, связанные с наблюдением за МВ3 анион ссылается на его сильную основную природу и его тенденцию к образованию пентакоординированных соединений кремния, таких как [Me3Si (CF3)2]− или я3Si (F) (CF3)]−.
Реакционная способность фтороформ в сочетании с сильной базой, такой как т-БуОК с карбонил соединения в DMF это пример.[53] Здесь CF3− и ДМФ образуют полуаминолатный аддукт ([Me2NCH (O) CF3] K).[24][55][56][57]
 |
| трифторметилирование с использованием метилфторсульфонилдифторацетата. Промежуточный - CF3Cu[58] |
Электрофильное трифторметилирование
В электрофильное трифторметилирование активная трифторметильная донорная группа несет положительный заряд.[59][60] Изготовление CF3+ катион был описан как «чрезвычайно твердый» [61] Первый соответствующий реагент - диарил (трифторметил). сульфония соль (Ar2S+CF3SbF6−) был разработан в 1984 году реакцией арилтрифторметилсульфоксида 1 с SF3+SbF6− с последующей реакцией с богатым электронами ареном.[62] Реагент использовали при трифторметилировании тиофенолята.S- (трифторметил) дибензотиофения тетрафторборат представляет собой коммерчески доступный и известный реагент трифторметилирования, основанный на том же принципе, впервые задокументированном в 1990 году.[63][64] В этом типе соединения сера заменена на кислород, селен и теллур. Примеры субстратов, которые были исследованы: пиридин, анилин, трифенилфосфин и литиевая соль фенилацетилен.
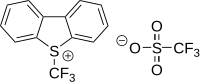 | 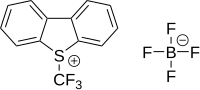 | 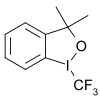 |
| 5- (Трифторметил) дибензотиофений трифторметансульфонат | 5- (Трифторметил) дибензотиофения тетраборат | 3,3-диметил-1- (трифторметил) -1,2-бензиодоксол |
Другой группой доноров трифторметила являются гипервалентный йод (III) –CF3 реагенты например 3,3-диметил-1- (трифторметил) -1,2-бензиодоксол.[65][66][67][68] Субстратами являются тиолы, спирты, фосфины, (гетеро) арены,[69] неактивированные олефины[70] и ненасыщенные карбоновые кислоты.[71]
 |
| Трифторметилирование тиольной группы с использованием гипервалентного йода [69] |
В механизм реакции электрофильного трифторметилирования был описан как противоречивый с полярное замещение или же перенос одного электрона как вероятные кандидаты.[61]
Асимметричное трифторметилирование
В асимметричный При трифторметилировании трифторметильная группа добавляется к субстрату в энантиоселективный путь.[72][73] Реагент Рупперта был использован для этой цели в асимметричная индукция подход к функционализации хирального аминокислота производные,[74] сахариды,[75] и стероиды.Поскольку для реагента Рупперта требуется фторид тетраалкиламмония, хиральные фториды аммония использовались в асимметричный катализ.[76][77]В области электрофильного трифторметилирования ранний вклад включал реакцию енолята металла с солью трифторметилхалькогена в присутствии хирального борного катализатора.[78]
 | 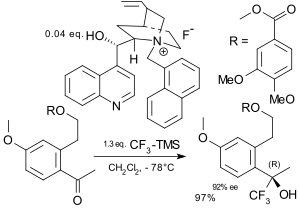 |
| Асимметричное трифторметилирование Iseki 1994[76] | Асимметричное трифторметилирование Caron 2003[77] |
Более свежие примеры высокоэнантиоселективных методов α-трифторметилирования карбонилов доступны через енаминный катализ альдегидов (фоторедокс[79] или йодоний[80]), медный катализ β-кетоэфиров,[81] и радикальное присоединение к енолятам циркония.[82]
Рекомендации
- ^ а б Томашенко, О. А .; Грушин, В. В. (2011). «Ароматическое трифторметилирование комплексами металлов». Химические обзоры. 111 (8): 4475–4521. Дои:10.1021 / cr1004293. PMID 21456523.
- ^ Furuya, T .; Камлет, А. С .; Риттер, Т. (2011). «Катализ фторирования и трифторметилирования». Природа. 473 (7348): 470–477. Bibcode:2011Натура.473..470F. Дои:10.1038 / природа10108. ЧВК 3119199. PMID 21614074.
- ^ Besset, T .; Schneider, C.D .; Кахард, Д. (2012). «Прирученный арен и трифторметилирование гетероарена». Angewandte Chemie International Edition. 51 (21): 5048–5050. Дои:10.1002 / anie.201201012. PMID 22488902.
- ^ Alonso, C.N .; Мартинес де Маригорта, Э .; Rubiales, G .; Паласиос, Ф. (2015). «Реакции трифторметилирования углерода углеводородных производных и гетероаренов». Химические обзоры. 115 (4): 1847–1935. Дои:10.1021 / cr500368h. PMID 25635524.
- ^ Леманн, Ф. "Химический состав и активность. Ароматические соединения фтора". Arch. опыт Патол. Фармакол 130 (1928): 250-255.
- ^ Йель, Х. Л. (1959). «Трифторметильная группа в медицинской химии». Журнал медицинской и фармацевтической химии. 1 (2): 121–133. Дои:10.1021 / jm50003a001. PMID 13665284.
- ^ Свартс (1892). Акад. Рой. Бельг. 3 (24): 474. Отсутствует или пусто
| название =(помощь) - ^ McLoughlin, V.C.R .; Троуэр, Дж. (1969). «Путь к фторалкилзамещенным ароматическим соединениям с участием фторалкилмеди промежуточных продуктов». Тетраэдр. 25 (24): 5921–5940. Дои:10.1016 / S0040-4020 (01) 83100-8.
- ^ Кобаяши, Ю .; Кумадаки, И. (1969). «Трифторметилирование ароматических соединений». Буквы Тетраэдра. 10 (47): 4095–4096. Дои:10.1016 / S0040-4039 (01) 88624-X.
- ^ Folléas, B. ̂T .; Marek, I .; Normant, J. F .; Сен-Жалм, Л. (2000). «Фтороформ: эффективный предшественник трифторметилирования альдегидов». Тетраэдр. 56 (2): 275–283. Дои:10.1016 / S0040-4020 (99) 00951-5.
- ^ Рупперт, Инго; Шлих, Клаус; Вольбах, Вольфганг (январь 1984). «Диэрстен CF3-заместитель органил (хлор) силан». Буквы Тетраэдра. 25 (21): 2195–2198. Дои:10.1016 / S0040-4039 (01) 80208-2.
- ^ Пракаш, Г. К. Сурья; Кришнамурти, Рамеш; Олах, Джордж А. (январь 1989 г.). «Синтетические методы и реакции. 141. Индуцированное фтором трифторметилирование карбонильных соединений трифторметилтриметилсиланом (TMS-CF3). Эквивалент трифторметида». Журнал Американского химического общества. 111 (1): 393–395. Дои:10.1021 / ja00183a073.
- ^ Стали, Дж. Патрик; Белл, Дональд Р. (июнь 1989 г.). «Новый метод синтеза трифторметилзамещенных фенолов и анилинов». Журнал органической химии. 54 (12): 2873–2877. Дои:10.1021 / jo00273a020.
- ^ Г. К. Сурья Пракаш; Андрей К. Юдин (1997). «Перфторалкилирование кремнийорганическими реагентами». Химические обзоры. 97 (3): 757–786. Дои:10.1021 / cr9408991. PMID 11848888.CS1 maint: несколько имен: список авторов (связь)
- ^ Сяо Лю, Цун Сю, Ман Ван и Цюнь Лю (2015). «Трифторметилтриметилсилан: нуклеофильное трифторметилирование и не только». Химические обзоры. 115 (2): 683–730. Дои:10.1021 / cr400473a. PMID 24754488.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Рамая, Пичика; Кришнамурти, Рамеш; К. Сурья Пракаш, Г. (1995). «1-ТРИФТОРОМЕТИЛ-1-ЦИКЛОГЕКСАНОЛ». Органический синтез. 72 (72): 232. Дои:10.15227 / orgsyn.072.0232.
- ^ Morimoto, H .; Цубого, Т .; Litvinas, N.D .; Хартвиг, Дж. Ф. (2011). «Широко применяемый медный реагент для трифторметилирования и перфторалкилирования арилйодидов и бромидов». Angewandte Chemie. 123 (16): 3877–3882. Дои:10.1002 / ange.201100633.
- ^ Оиси, Масахиро; Кондо, Хидеаки; Ами, Хидеки (2009). «Катализатор ароматического трифторметилирования в меди». Химические коммуникации. 2009 (14): 1909–1911. Дои:10.1039 / B823249K. PMID 19319442.
- ^ Knauber, T .; Arikan, F .; Röschenthaler, G.-V .; Гуссен, Л. Дж. (2011). «Катализируемое медью трифторметилирование арилйодидов с помощью (трифторметил) триметоксибората». Химия: европейский журнал. 17 (9): 2689–2697. Дои:10.1002 / chem.201002749. PMID 21274956.
- ^ Йе, Инда; Ли, Шин Хи; Сэнфорд, Мелани С. (2011). «Серебряное трифторметилирование аренов с использованием TMSCF3». Органические буквы. 13 (20): 5464–5467. Дои:10.1021 / ol202174a. ЧВК 3229100. PMID 21932827.
- ^ Хафнер, А .; Брэзе, С. (2012). «Орто-трифторметилирование функциональных ароматических триазенов». Angewandte Chemie International Edition. 51 (15): 3713–3715. Дои:10.1002 / anie.201107414. PMID 22318969.
- ^ Мацуи, Киёидэ; Тобита, Эцуко; Андо, Мидори; Кондо, Киёси (1981). «Удобное трифторметилирование ароматических галогенидов трифторацетатом натрия». Письма по химии. 10 (12): 1719–1720. Дои:10.1246 / cl.1981.1719.
- ^ Langlois, Bernard R .; Рокес, Николас (октябрь 2007 г.). «Нуклеофильное трифторметилирование арилгалогенидов метилтрифторацетатом». Журнал химии фтора. 128 (10): 1318–1325. Дои:10.1016 / j.jfluchem.2007.08.001.
- ^ а б c Фоллеас, Бенуа; Марек, Илан; Норман, Жан-Ф; Джалмс, Лоран Сен (май 1998 г.). «Фтороформ: эффективный предшественник трифторметилирования альдегидов». Буквы Тетраэдра. 39 (19): 2973–2976. Дои:10.1016 / S0040-4039 (98) 00391-8.
- ^ а б Сато, Казуюки; Омотэ, Масааки; Андо, Акира; Кумадаки, Ицумаро (2006). «ТРИФТОРОМЕТИЛИРОВАНИЕ В А-ПОЛОЖЕНИИ b, b-НЕНАСЫЩЕННЫХ КЕТОНОВ: 4-ФЕНИЛ-3- (ТРИФТОРОМЕТИЛ) БУТАН-2-ОНА». Органический синтез. 83 (83): 177. Дои:10.15227 / orgsyn.083.0177.
- ^ Пракаш, Г. К. Сурья; Ху, Дзинбо; Олах, Джордж А. (сентябрь 2003 г.). «Алкоксид- и гидроксид-индуцированное нуклеофильное трифторметилирование с использованием трифторметилсульфона или сульфоксида». Органические буквы. 5 (18): 3253–3256. Дои:10.1021 / ol035045u. PMID 12943400.
- ^ Nagib, David A .; Макмиллан, Дэвид В. К. (8 декабря 2011 г.). «Трифторметилирование аренов и гетероаренов с помощью фотоокислительного катализа». Природа. 480 (7376): 224–228. Bibcode:2011Натура.480..224Н. Дои:10.1038 / природа10647. ЧВК 3310175. PMID 22158245.
- ^ Langlois, Bernard R .; Лоран, Элиан; Ройдот, Натали (декабрь 1991 г.). «Трифторметилирование ароматических соединений трифторметансульфинатом натрия в окислительных условиях». Буквы Тетраэдра. 32 (51): 7525–7528. Дои:10.1016 / 0040-4039 (91) 80524-А.
- ^ а б Ji, Y .; Brueckl, T .; Baxter, R.D .; Fujiwara, Y .; Seiple, I. B .; Вс, С .; Blackmond, D.G .; Баран, П.С. (15 августа 2011 г.). «Врожденное C-H трифторметилирование гетероциклов». Труды Национальной академии наук. 108 (35): 14411–14415. Bibcode:2011PNAS..10814411J. Дои:10.1073 / pnas.1109059108. ЧВК 3167544. PMID 21844378.
- ^ Чжан, Цай (11 июля 2014 г.). «Последние достижения в трифторметилировании органических соединений с использованием реагентов Умемото». Органическая и биомолекулярная химия. 12 (34): 6580–9. Дои:10.1039 / C4OB00671B. PMID 25011917.
- ^ Ли, Хуэйцинь (3 сентября 2012 г.). "Реагент Умемото". Synlett. 23 (15): 2289–2290. Дои:10.1055 / с-0032-1317176.
- ^ Дональд Дж. Бертон, Лонг Лу "Фторированные металлоорганические соединения" Вопросы современной химии, 1997, Vol. 193, стр. 45.
- ^ Рейнт Юджен "Бис (трифторметил) ртуть" 1986, том 24, с. 52. Дои:10.1002 / 9780470132555.ch16
- ^ а б Китадзуме, Томоя; Исикава, Нобуо (1982). «Катализируемые палладием реакции перекрестного связывания между аллилом, винилом или арилгалогенидом и перфторалкилйодидом с цинком и ультразвуковым облучением». Письма по химии. 11 (1): 137–140. Дои:10.1246 / кл.1982.137.
- ^ Китадзуме, Томоя; Исикава, Нобуо (1985). «Селективное перфторалкилирование под действием ультразвука в желаемом положении органических молекул». Журнал Американского химического общества. 107 (18): 5186–5191. Дои:10.1021 / ja00304a026.
- ^ а б Oishi, M .; Kondo, H .; Ами, Х. (2009). «Катализатор ароматического трифторметилирования в меди». Chem. Сообщество. 2009 (14): 1909–1911. Дои:10.1039 / B823249K. PMID 19319442.
- ^ Knauber, T .; Arikan, F .; Roschenthaler, G.-V .; Гуссен, Л. Дж. (2011). «Катализируемое медью трифторметилирование арилиодидов (трифторметил) триметоксиборатом калия». Chem. Евро. J. 17 (9): 2689–2697. Дои:10.1002 / chem.201002749. PMID 21274956.
- ^ Chu, L .; Цин, Ф.-Л. (2010). «Медь-опосредованное окислительное трифторметилирование бороновых кислот». Орг. Латыш. 12 (21): 5060–5063. Дои:10.1021 / ol1023135. PMID 20923196.
- ^ Senecal, Todd D .; Парсонс, Эндрю Т .; Бухвальд, Стивен Л. (18 февраля 2011 г.). "Трифторметилирование арила при комнатной температуре посредством окислительного перекрестного взаимодействия с участием меди". Журнал органической химии. 76 (4): 1174–1176. Дои:10.1021 / jo1023377. ЧВК 3093444. PMID 21235259.
- ^ Cheng-, Cheng-Pan; Чжан, Пан; Ван, Линг; и другие. (2011). «Медь-опосредованное трифторметилирование гетероароматических соединений солями трифторметилсульфония». Энгью. Chem. Int. Эд. 50 (8): 1896–1900. Дои:10.1002 / anie.201006823. PMID 21328665.
- ^ Morimoto, H .; Цубого, Т .; Litvinas, N.D .; Хартвиг, Дж. Ф. (2011). «Медный реагент широкого применения для трифторметилирования и перфторалкилирования арилиодидов и бромидов». Энгью. Chem. Int. Эд. 50 (16): 3793–3798. Дои:10.1002 / anie.201100633. ЧВК 3159489. PMID 21442711.
- ^ Чо, Э. Дж .; Senecal, T. D .; Кинзель, Т .; Zhang, Y .; Уотсон, Д. А .; Бухвальд, С. Л. (24 июня 2010 г.). «Катализируемое палладием трифторметилирование арилхлоридов». Наука. 328 (5986): 1679–1681. Bibcode:2010Sci ... 328.1679C. Дои:10.1126 / science.1190524. ЧВК 3005208. PMID 20576888.
- ^ Ма, Джун-Ан; Кахард, Доминик (сентябрь 2007 г.). «Стратегии нуклеофильного, электрофильного и радикального трифторметилирования». Журнал химии фтора. 128 (9): 975–996. Дои:10.1016 / j.jfluchem.2007.04.026.
- ^ Андрие, Клод П .; Гелис, Лоуренс; Савант, Жан-Мишель (январь 1989 г.). «Необычные реакции, возникающие в результате присоединения к олефинам трифторметильных радикалов, полученных в результате диссоциативного переноса электрона между электрохимически генерируемыми ароматическими анион-радикалами и трифторметилбромидом». Буквы Тетраэдра. 30 (37): 4961–4964. Дои:10.1016 / S0040-4039 (01) 80554-2.
- ^ Унеяма, Кендзи; Китагава, Коити; Китагава, Коити (январь 1991 г.). «Перфторалкил-селенирование олефинов». Буквы Тетраэдра. 32 (3): 375–378. Дои:10.1016 / S0040-4039 (00) 92632-7.
- ^ Унеяма, Кендзи; Канаи, Масатоми (декабрь 1991 г.). «Генерация перфторалкильных радикалов при низкой температуре с помощью теллуролата опосредованного переноса электрона». Буквы Тетраэдра. 32 (50): 7425–7426. Дои:10.1016 / 0040-4039 (91) 80124-О.
- ^ Расмуссон, Гэри Х .; Браун, Рональд Д.; Арт, Глен Э. (март 1975 г.). «Фотокаталитическая реакция трифторметилиодида со стероидными диенонами». Журнал органической химии. 40 (6): 672–675. Дои:10.1021 / jo00894a002. PMID 1133630.
- ^ Лан-Харгест, Сюань-Инь; Эллиотт, Джон Д .; Eggleston, Drake S .; Меткалф, Брайан В. (январь 1987 г.). «Фотохимическая перегруппировка трифлата стероидного диенола». Буквы Тетраэдра. 28 (52): 6557–6560. Дои:10.1016 / S0040-4039 (00) 96912-0.
- ^ а б Миура, Кацукиё; Такеяма, Ёсихиро; Осима, Коитиро; Утимото, Киитиро (1991). «Триэтилборан-индуцированное перфторалкилирование силиленольных эфиров и кетен-силилацеталей перфторалкилйодидами». Бюллетень химического общества Японии. 64 (5): 1542–1553. Дои:10.1246 / bcsj.64.1542.
- ^ Миура, Кацукиё; Танигучи, Масахико; Нодзаки, Кёко; Осима, Коитиро; Утимото, Киитиро (январь 1990 года). «Триэтилборан индуцировал перфторалкилирование простых эфиров силиленола или простых эфиров гермиленола перфторалкилиодидами». Буквы Тетраэдра. 31 (44): 6391–6394. Дои:10.1016 / S0040-4039 (00) 97073-4.
- ^ Студер, Армидо (3 сентября 2012 г.). "Ренессанс" в радикальном трифторметилировании ". Angewandte Chemie International Edition. 51 (36): 8950–8958. Дои:10.1002 / anie.201202624. PMID 22890985.
- ^ Haszeldine, Р. Н. (1949). «603. Реакции фторуглеродных радикалов. Часть I. Реакция йодтрифторметана с этиленом и тетрафторэтиленом». Журнал химического общества (возобновлено): 2856. Дои:10.1039 / JR9490002856.
- ^ а б Langlois, Bernard R .; Биллард, Тьерри; Руссель, Сольвейг (февраль 2005 г.). «Нуклеофильное трифторметилирование». Журнал химии фтора. 126 (2): 173–179. Дои:10.1016 / j.jfluchem.2004.11.007.
- ^ Проф. Д-р Г.К. Сурья Пракаш, д-р Фанг Ван, Чжэ Чжан, проф. Д-р Ральф Хейгес, д-р Мартин Рам, проф. Д-р Карл О. Кристе, д-р Томас Мэтью, проф. Д-р Джордж А. Олах (2014). «Долгоживущий анион трифторметанида: ключевое промежуточное соединение в нуклеофильном трифторметилировании». Энгью. Chem. Int. Эд. 53 (43): 11575–11578. Дои:10.1002 / anie.201406505. PMID 25146595.CS1 maint: несколько имен: список авторов (связь)
- ^ Шоно, Тацуя; Ишифуне, Манабу; Окада, Тосио; Кашимура, Сигенори (январь 1991 г.). «Электроорганическая химия. 130. Новое трифторметилирование альдегидов и кетонов с помощью электрогенерированного основания». Журнал органической химии. 56 (1): 2–4. Дои:10.1021 / jo00001a002.
- ^ Бардади, Рашид; Трупель, Мишель; Перихон, Жак (1998). «Сочетание фтороформа с альдегидами с использованием электрогенерированного основания». Химические коммуникации (12): 1251–1252. Дои:10.1039 / A801406J.
- ^ Большой, Сильви; Рокес, Николас; Ланглуа, Бернар Р. (декабрь 2000 г.). «Нуклеофильное трифторметилирование карбонильных соединений и дисульфидов трифторметаном и кремнийсодержащими основаниями». Журнал органической химии. 65 (26): 8848–8856. Дои:10.1021 / jo000150s. PMID 11149825.
- ^ Фэй, Сян-Шу; Тиан, Вэй-Шэн; Дин, Кай; Ван, Юнь; Цин-Юнь, Чен (2010). «Новый удобный путь трифторметилирования стероидных молекул». Орг. Синтезатор. 87 (87): 126. Дои:10.15227 / orgsyn.087.0126.
- ^ Shibata, N .; Мацнев, А .; Кахард, Д. (2010). «Стабильные электрофильные трифторметилирующие реагенты: краткая историческая перспектива». Журнал органической химии Бейльштейна. 6: 65. Дои:10.3762 / bjoc.6.65. ЧВК 2919266. PMID 20703379.
- ^ Умемото, Т. (1996). «Электрофильные перфторалкилирующие агенты». Химические обзоры. 96 (5): 1757–1778. Дои:10.1021 / cr941149u. PMID 11848810.
- ^ а б Barata-Vallejo, S. N .; Lantaño, B .; Постиго, А. (2014). «Последние достижения в реакциях трифторметилирования с электрофильными реагентами трифторметилирования». Химия: европейский журнал. 20 (51): 16806–16829. Дои:10.1002 / chem.201404005. PMID 25335765.
- ^ Ягупольский, Л. М .; Кондратенко, Н. В .; Тимофеева, Г. Н. J. Org. Chem. СССР 1984, 20, 103–106.
- ^ Teruo, U .; Суми, И. (1990). «Трифторметилирующие агенты с переменной мощностью, система солей (трифторметил) дибензотио и -селенофения». Буквы Тетраэдра. 31 (25): 3579–3582. Дои:10.1016 / S0040-4039 (00) 94447-2.
- ^ Умемото, Т .; Исихара, С. (1993). «Электрофильные трифторметилирующие агенты с переменной мощностью. Система солей S-, Se- и Te- (трифторметил) дибензотио-, -селено- и -теллурофения». Журнал Американского химического общества. 115 (6): 2156–2164. Дои:10.1021 / ja00059a009.
- ^ Eisenberger, P .; Gischig, S .; Тонни, А. (2006). «Новые соединения на основе гипервалентного йода 10-I-3 для электрофильного трифторметилирования». Химия: европейский журнал. 12 (9): 2579–2586. Дои:10.1002 / chem.200501052. PMID 16402401.
- ^ Kieltsch, I .; Eisenberger, P .; Тонни, А. (2007). "Мягкое электрофильное трифторметилирование углеродных и сероцентрированных нуклеофилов гипервалентным йодом (III) -CF3 реагентом". Angewandte Chemie International Edition. 46 (5): 754–757. Дои:10.1002 / anie.200603497. PMID 17154193.
- ^ Eisenberger, P .; Kieltsch, I .; Арманино, Н .; Тонни, А. (2008). «Мягкое электрофильное трифторметилирование вторичных и первичных арил- и алкилфосфинов с использованием реагентов гипервалентного йода (iii) –CF3». Химические коммуникации (13): 1575–7. Дои:10.1039 / B801424H. PMID 18354804.
- ^ Stanek, K .; Koller, R .; Тонни, А. (2008). «Реакционная способность реагента для трифторметилирования гипервалентного йода 10-I-3 с фенолами». Журнал органической химии. 73 (19): 7678–7685. Дои:10.1021 / jo8014825. PMID 18771328.
- ^ а б «Приготовление агента переноса трифторметила: 1-трифторметил-1,3-дигидро-3,3-диметил-1,2-бензиодоксол». Органический синтез. 88: 168. 2011. Дои:10.15227 / orgsyn.088.0168.
- ^ Parsons, A.T .; Бухвальд, С. Л. (2011). «Катализируемое медью трифторметилирование неактивированных олефинов». Angewandte Chemie International Edition. 50 (39): 9120–9123. Дои:10.1002 / anie.201104053. ЧВК 3390945. PMID 21919144.
- ^ Он, З .; Luo, T .; Hu, M .; Cao, Y .; Ху, Дж. (2012). «Катализируемое медью ди- и трифторметилирование α, β-ненасыщенных карбоновых кислот: протокол для винилового фторалкилирования». Angewandte Chemie International Edition. 51 (16): 3944–3947. Дои:10.1002 / anie.201200140. PMID 22407851.
- ^ Ма, Джун-Ан; Кахард, Доминик (декабрь 2004 г.). «Реакции асимметричного фторирования, трифторметилирования и перфторалкилирования». Химические обзоры. 104 (12): 6119–6146. Дои:10.1021 / cr030143e. PMID 15584697.
- ^ Линь, Цзинь-Хун; Сяо, Цзи-Чанг (ноябрь 2014 г.). «Последние достижения в реакциях асимметричного фторирования и фторалкилирования посредством органокатализа». Буквы Тетраэдра. 55 (45): 6147–6155. Дои:10.1016 / j.tetlet.2014.09.031.
- ^ Скилз, Джерри У .; Фукс, Виктор; Мяо, Клара; Сорсек, Рональд; Grozinger, Karl G .; Mauldin, Scott C .; Витоус, Яна; Муи, Филип В .; Джейкобер, Стивен (февраль 1992 г.). «Ингибирование эластазы лейкоцитов человека (HLE) N-замещенными пептидилтрифторметилкетонами». Журнал медицинской химии. 35 (4): 641–662. Дои:10.1021 / jm00082a005. PMID 1542092.
- ^ Bansal, Romesh C .; Дин, Барбара; Хакомори, Сен-ирох; Тоёкуни, Тацуши (1991). «Синтез трифторметилового аналога L-фукозы и 6-дезокси-D-альтрозы». Журнал химического общества, химические коммуникации (12): 796. Дои:10.1039 / C39910000796.
- ^ а б Исэки, Кацухико; Нагаи, Такабуми; Кобаяши, Йоширо (май 1994 г.). «Асимметрическое трифторметилирование альдегидов и кетонов трифторметилтриметилсиланом, катализируемое хиральными фторидами четвертичного аммония». Буквы Тетраэдра. 35 (19): 3137–3138. Дои:10.1016 / S0040-4039 (00) 76850-X.
- ^ а б Карон, Стефан; Делай, Нга; Арпин, Патрис; Лариве, Александр (август 2003 г.). «Энантиоселективное добавление трифторметил-аниона к арилкетонам и альдегидам». Синтез. 2003 (11): 1693–1698. Дои:10.1055 / с-2003-40889.
- ^ Умемото, Теруо; Адачи, Кендзи (сентябрь 1994 г.). «Новый метод трифторметилирования енолят-анионов и приложения для регио-, диастерео- и энантиоселективного трифторметилирования». Журнал органической химии. 59 (19): 5692–5699. Дои:10.1021 / jo00098a030.
- ^ Nagib, David A .; Скотт, Марк Э .; Макмиллан, Дэвид В. К. (2009). «Энантиоселективное α-трифторметилирование альдегидов с помощью фоторедокс-органокатализа». Журнал Американского химического общества. 131 (31): 10875–10877. Дои:10.1021 / ja9053338. ЧВК 3310169. PMID 19722670.
- ^ Аллен, Анна Е .; Макмиллан, Дэвид В. К. (2010). «Продуктивное слияние йодониевых солей и органокатализа: нефотолитический подход к энантиоселективному α-трифторметилированию альдегидов». Журнал Американского химического общества. 132 (14): 4986–4987. Дои:10.1021 / ja100748y. ЧВК 2880471. PMID 20297822.
- ^ Дэн, Цин-Хай; Wadepohl, Hubert; Гаде, Лутц Х. (2012). "Высокоэнантиоселективное электрофильное трифторметилирование β-кетоэфиров, катализируемое медью". Журнал Американского химического общества. 134 (26): 10769–10772. Дои:10.1021 / ja3039773. PMID 22693950.
- ^ Herrmann, Aaron T .; Смит, Линдси Л .; Закарян, Армен (2012). «Простой метод асимметричного трифторметилирования -ацилоксазолидинонов посредством присоединения радикалов к енолятам циркония, катализируемого Ru». Журнал Американского химического общества. 134 (16): 6976–6979. Дои:10.1021 / ja302552e. ЧВК 3375393. PMID 22486383.

