Цианирование - Cyanation
В органическом синтезе, цианирование прикрепление или замена цианид группа по разным субстраты. Такие преобразования имеют высокую ценность, потому что они создают связь C-C. более того нитрилы универсальные функциональные группы.
Цианирование с образованием зр.3 нитрилы
Обычно алкилнитрилы образуются через SN1 или SNЦианирование 2-го типа алкил-электрофилами. Показательным является синтез бензилцианид по реакции бензилхлорид и цианид натрия.[1] В некоторых случаях цианид меди используется вместо цианида натрия.[2]
Цианирование кетонов или альдегидов дает соответствующие циангидрины, что можно сделать непосредственно с цианид-ионом ( циангидриновая реакция ) или с помощью бисульфата с последующим вытеснением сульфита:[3][4]
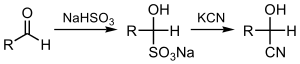
Связанная реакция гидроцианирование, в котором устанавливаются элементы H-CN.
Цианирование аренов
Cyanation of arenes предлагает доступ к бензойная кислота производные, а также полезность самих арилнитрилов в качестве тонких химикатов:

Известно множество механически различных путей цианата аренов:
С ареном как двухэлектронным электрофилом
В то время как классический Реакция Розенмунда фон-Брауна использует стехиометрический цианид меди (I) как источник цианирования,[5] были разработаны более новые варианты, которые каталитический в медь:[6]

К тому же, катализируемый палладием цианирование арилгалогениды были широко исследованы. В общем, KCN или его менее токсичный суррогат Zn (CN)2 используются как нуклеофильный источники цианида. Чтобы еще больше уменьшить токсичность обеспокоенность, феррицианид калия также использовался в качестве источника цианида. Каталитические циклы как полагают, проходят стандартный путь Pd (0 / II) с восстановительное устранение ковка ключевой связи C-C. Распространенная проблема - дезактивация Pd (II) избытком цианида.[7] Разработаны условия катализа палладием арилиодидов, бромидов и даже хлоридов:[8]

Цианирование, катализируемое никелем, позволяет избежать использования драгоценных металлов и может бензилцианид или ацетонитрил как источник цианида, через восстановительный разрыв связи C-C:[9]

Sandmeyer цианирование - это средство преобразования анилин производные бензонитрилов.[10] Обычно предполагается, что цианирование является двухэлектронным, в то время как с радикальный посредников в отсутствие металлов реакция скорее всего радикальная.[11]
С ареном как двухэлектронным нуклеофилом
Металлизированные арены могут быть цианированы электрофильный источники цианида, в том числе цианамиды, цианаты, диметилмалононитрил или этил (этоксиметилен) цианоацетат. Эти методы могут применяться с посредничеством переходного металла или без него:[12]

С ареном как радикальным электрофилом
Радикальные подходы к арене C-H цианирование известно. Фоторедокс Медиаторы (металлические или органические) наиболее распространены:[13][14]

использованная литература
- ^ Адамс, Роджер; Тал, А. Ф. (1922). «Цианид бензила». Органический синтез. 2: 9. Дои:10.15227 / orgsyn.002.0009.
- ^ Ю. В. Супневский; П. Л. Зальцберг (1928). «Аллилцианид». Орг. Синтезатор. 8: 4. Дои:10.15227 / orgsyn.008.0004.
- ^ Моури, Дэвид Т. (1948). «Приготовление нитрилов». Химические обзоры. 42 (2): 189–283. Дои:10.1021 / cr60132a001. ISSN 0009-2665.
- ^ Corson, B.B .; Dodge, R.A .; Harris, S.A .; Йеу, Дж. С. (1926). «Миндальная кислота». Орг. Синтезатор. 6: 58. Дои:10.15227 / orgsyn.006.0058.
- ^ Варжеча, Клаус-Дитер. «цианидное замещение бромбензола».
- ^ Ву, Джефф (2002). «Каталитическая реакция Розенмунда – фон Брауна в ионных жидкостях на основе галогенидов». Буквы Тетраэдра. 43: 387. Дои:10.1016 / с0040-4039 (01) 02168-2.
- ^ Коэн, Дэниел (2015). «Мягкое катализируемое палладием цианирование (гетеро) арилгалогенидов и трифлатов в водной среде». Органические буквы. 17: 202. Дои:10.1021 / ol5032359.
- ^ Цзинь, Фуцян (2000). «Катализируемые палладием реакции цианирования арилхлоридов». Буквы Тетраэдра. 41: 3271. Дои:10.1016 / s0040-4039 (00) 00384-1.
- ^ Уэда, Йохей (2019). «Катализируемое никелем цианирование арилгалогенидов и трифлатов с использованием ацетонитрила через разрыв связи C – CN с помощью 1,4-бис (триметилсилил) -2,3,5,6-тетраметил-1,4-дигидропиразина». Химическая наука. 10: 994. Дои:10.1039 / c8sc04437f.
- ^ Х. Т. Кларк; Р. Р. Рид (1925). «о-Толунитрил и п-Толунитрил». Орг. Синтезатор. 4: 69. Дои:10.15227 / orgsyn.004.0069.
- ^ Барберо, Маргарита (2016). «Бездомное цианирование по Сандмейеру арендиазония о-бензолдисульфонимидов». Органическая и биомолекулярная химия. 14: 1437. Дои:10.1039 / c5ob02321a. HDL:2318/1554335.
- ^ Ривз, Джонатан (2015). «Транснитриляция из диметилмалононитрила в арил-Гриньяр и литиевые реагенты: практический метод синтеза арилнитрила». Журнал Американского химического общества. 137: 9481. Дои:10.1021 / jacs.5b06136.
- ^ Равелли, Давиде; Протти, Стефано; Фаньони, Маурицио (2016). «Реакции образования углерод-углеродной связи через фотогенерированные промежуточные соединения». Химические обзоры. 116: 9850–9913. Дои:10.1021 / acs.chemrev.5b00662.
- ^ Ли, Джи Джек (2015). Активация связи C-H в органическом синтезе. CRC Press, Taylor & Francis Group.
