HK1 - HK1
Гексокиназа-1 (HK1) - это фермент что у людей кодируется HK1 ген на 10-й хромосоме. Гексокиназы фосфорилат глюкоза производить глюкозо-6-фосфат (G6P), первый шаг в большинстве путей метаболизма глюкозы. Этот ген кодирует повсеместную форму гексокиназы, которая локализуется в внешняя мембрана митохондрий. Мутации в этом гене были связаны с гемолитическая анемия из-за дефицита гексокиназы. Альтернативная сварка этого гена приводит к пяти вариантам транскрипта, которые кодируют разные изоформы, некоторые из которых тканеспецифичны. Каждая изоформа имеет свой N-конец; остальная часть белка идентична среди всех изоформ. Описан шестой вариант транскрипции, но из-за наличия нескольких стоп-кодоны, не считается, что он кодирует белок. [предоставлено RefSeq, апрель 2009 г.][5]
Структура
HK1 является одной из четырех высокогомологичных изоформ гексокиназы в клетках млекопитающих.[6][7]
Ген
В HK1 ген охватывает примерно 131 kb и состоит из 25 экзоны. Альтернативная сварка из его 5 ’экзонов продуцирует разные транскрипты в разных типах клеток: экзоны 1-5 и экзон 8 (экзоны T1-6) являются экзонами, специфичными для семенников; экзон 6, расположенный примерно в 15 т.п.н. ниже экзонов, специфичных для семенников, является эритроид -специфический экзон (экзон R); и экзон 7, расположенный примерно в 2,85 т.п.н. ниже экзона R, является первым 5’-экзоном для повсеместно экспрессируемой изоформы HK1. Более того, экзон 7 кодирует порин-связывающий домен (PBD), консервативный у млекопитающих. HK1 гены. Между тем, оставшиеся 17 экзонов являются общими для всех изоформ HK1.
Помимо экзона R, участок проксимального промоутер который содержит элемент GATA, сайт SP1, CCAAT и мотив, связывающий Ets, необходим для экспрессии HK-R в эритроидных клетках.[6]
Протеин
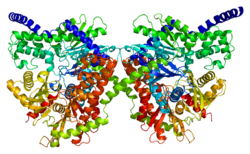
Этот ген кодирует 100 кДа гомодимер с нормативным N-концевой домен (1-475), каталитический C-терминал домен (остатки 476-917) и альфа-спираль соединяя две его субъединицы.[6][8][9][10] Оба терминальных домена состоят из большого субдомена и малого субдомена. Гибкая область С-концевой большой подобласти (остатки 766–810) может занимать различные позиции и предлагается взаимодействовать с основание АТФ. Более того, глюкоза и G6P связываются в непосредственной близости в N- и C-концевых доменах и стабилизируют общее конформационное состояние C-концевого домена.[8][9] Согласно одной модели, G6P действует как аллостерический ингибитор, который связывает N-концевой домен для стабилизации его закрытой конформации, который затем стабилизирует конформацию C-концевого гибкого субдомена, который блокирует АТФ. Вторая модель предполагает, что G6P действует как активный ингибитор, который стабилизирует закрытую конформацию и конкурирует с АТФ за C-концевой сайт связывания.[8] Результаты нескольких исследований показывают, что С-конец способен как к каталитическому, так и к регуляторному действию.[11] Между тем, гидрофобный N-конец сам по себе не обладает ферментативной активностью, но содержит регуляторный сайт G6P и PBD, который отвечает за стабильность белка и связывание с ним. внешняя митохондриальная мембрана (OMM).[6][12][10][13]
Функция
Как одна из двух митохондриальных изоформ гексокиназы и член семейства сахарокиназ, HK1 катализирует в ограничение скорости и первая обязательная стадия метаболизма глюкозы, которая представляет собой АТФ-зависимое фосфорилирование глюкозы до G6P.[8][7][10][14] Физиологические уровни G6P могут регулировать этот процесс, ингибируя HK1 как негативный отзыв, хотя неорганический фосфат (Пя) может ослабить ингибирование G6P.[8][12][10] Однако в отличие от HK2 и HK3, Сам HK1 напрямую не регулируется Pя, что лучше подходит для его повсеместного катаболический роль.[7] Фосфорилируя глюкозу, HK1 эффективно предотвращает выход глюкозы из клетки и, таким образом, передает глюкозу в энергетический метаболизм.[8][13][12][10] Более того, его локализация и прикрепление к OMM способствует связыванию гликолиза с митохондриальными окислительного фосфорилирования, что значительно увеличивает производство АТФ за счет прямой рециркуляции митохондриального АТФ / АДФ для удовлетворения энергетических потребностей клетки.[14][10][15] В частности, связанный с OMM HK1 связывает VDAC1 вызвать открытие митохондриальная проницаемость переходная пора и высвобождают митохондриальный АТФ, чтобы дополнительно подпитывать гликолитический процесс.[10][7]
Еще одна важная функция для связанного с OMM HK1 - это выживание клеток и защита от окислительное повреждение.[14][7] Активация Акт киназа опосредуется связыванием HK1-VDAC1 как часть опосредованного фактором роста фосфатидилинозитол 3-киназы (PI3) / выживания клеток Akt внутриклеточного сигнального пути, таким образом предотвращая цитохром с высвобождение и последующий апоптоз.[14][6][10][7] Фактически, есть доказательства того, что связывание VDAC антиапоптотическим HK1 и проапоптотическим креатинкиназа являются взаимоисключающими, указывая на то, что отсутствие HK1 позволяет креатинкиназе связывать и открывать VDAC.[7] Кроме того, HK1 продемонстрировал анти-апоптотический активность путем противодействия Bcl-2 белки, расположенные в OMM, которые затем ингибируют TNF -индуцированный апоптоз.[6][13]
в префронтальная кора, HK1 предположительно образует белковый комплекс с EAAT2, Na + / K + АТФаза, и аконитаза, какие функции удалить глутамат из перисинаптического пространства и поддерживать низкие базальные уровни в синаптическая щель.[15]
В частности, HK1 является наиболее часто экспрессируемой изоформой из четырех гексокиназ и конститутивно экспрессируется в большинстве тканей, хотя в основном она обнаруживается в мозг, почка, и красные кровяные тельца (РБК).[6][8][13][7][15][10][16] Его высокая численность в сетчатка, особенно внутренний сегмент фоторецептора, внешний плексиформный слой, внутренний ядерный слой, внутренний плексиформный слой и слой ганглиозных клеток, свидетельствует о его решающей метаболической цели.[17] Он также экспрессируется в клетках, полученных из кроветворный стволовые клетки, например, эритроциты, лейкоциты, и тромбоциты, а также из клеток-предшественников эритроидов.[6] Следует отметить, что HK1 является единственной изоформой гексокиназы, обнаруженной в клетках и тканях, функция которых в наибольшей степени зависит от метаболизма глюкозы, включая мозг, эритроциты, тромбоциты, лейкоциты и фибробласты.[18] У крыс это также преобладающая гексокиназа в тканях плода, вероятно, из-за их конститутивного использования глюкозы.[12][16]
Клиническое значение
Мутации в этом гене связаны с типом 4H Болезнь Шарко – Мари – Зуба, также известная как наследственная моторная и сенсорная нейропатия по руссовскому типу (HMSNR).[19] Из-за решающей роли HK1 в гликолизе дефицит гексокиназы был идентифицирован как причина эритроэнзимопатий, связанных с наследственная несфероцитарная гемолитическая анемия (HNSHA). Аналогичным образом, дефицит HK1 привел к мозговой белое вещество травмы, пороки развития и психомоторная отсталость, а также скрытые сахарный диабет и кастрюлямиелопатия.[6] Между тем, HK1 высоко экспрессируется в раки, и его антиапоптотические эффекты наблюдались в высокогликолитических гепатома клетки.[13][6]
Нейродегенеративные расстройства
HK1 может быть причинно связан с настроение и психотические расстройства, включая униполярная депрессия (UPD), биполярное расстройство (БЛД) и шизофрения через его роль в энергетическом обмене и выживании клеток. Например, накопление лактата в мозге пациентов с BPD и SCHZ потенциально является результатом отделения HK1 от OMM и, соответственно, гликолиза от окислительного фосфорилирования митохондрий. В случае SCHZ уменьшение присоединения HK1 к OMM в теменная кора привело к снижению способности обратного захвата глутамата и, таким образом, к выбросу глутамата из синапсы. Высвобожденный глутамат активирует внесинаптические рецепторы глутамата, что приводит к изменению структуры и функции глутаматных цепей, синаптическая пластичность, лобная корковая дисфункция и, в конечном итоге, когнитивные дефициты, характерные для SCHZ.[15] Точно так же отслоение митохондрий Hk1 было связано с гипотиреоз, что связано с аномальным развитием мозга и повышенным риском депрессия, а его прикрепление приводит к нервный рост.[14] В Болезнь Паркинсона, Отсоединение HK1 от VDAC через Паркин -опосредованный убиквитилирование и деградация нарушает MPTP на деполяризованный митохондрии, следовательно, блокируя митохондриальную локализацию Паркина и останавливая гликолиз.[7] Дальнейшие исследования необходимы для определения относительной отслойки HK1, необходимой в различных типах клеток при различных психических расстройствах. Это исследование также может способствовать разработке методов лечения, направленных на устранение причин отслойки, от генных мутаций до вмешательства со стороны таких факторов, как бета-амилоид пептид и инсулин.[14]
Пигментный ретинит
А гетерозиготный миссенс-мутация в HK1 ген (изменение в позиции 847 с глутамата на лизин) был связан с пигментный ретинит.[20][17] Поскольку это замещающая мутация расположен далеко от известных функциональных сайтов и не нарушает гликолитическую активность фермента, вероятно, что мутация действует посредством другого биологического механизма, уникального для сетчатки.[20] Примечательно, что исследования сетчатки мышей выявили взаимодействия между Hk1, митохондриальным металло-шапероном Cox11 и шаперонным белком Ranbp2, которые служат для поддержания нормального метаболизма и функции в сетчатке. Таким образом, мутация может нарушить эти взаимодействия и привести к деградации сетчатки.[17] Альтернативно, эта мутация может действовать через антиапоптотическую функцию фермента, поскольку нарушение регуляции ассоциации гексокиназы и митохондрий рецепторами инсулина может вызвать апоптоз фоторецепторов и дегенерацию сетчатки.[20][17] В этом случае методы лечения, которые сохраняют ассоциацию гексокиназа-митохондрии, могут служить потенциальным терапевтическим подходом.[17]
Взаимодействия
HK1 известен взаимодействовать с:
Интерактивная карта проезда
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи.[§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: «ГликолизГлюконеогенез_WP534».
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000156515 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000037012 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Энтрез Ген: гексокиназа 1 HK1».
- ^ а б c d е ж грамм час я j Мураками К., Канно Х, Танкабелик Дж, Фуджи Х (2002). «Экспрессия генов и биологическое значение гексокиназы в эритроидных клетках». Acta Haematologica. 108 (4): 204–9. Дои:10.1159/000065656. PMID 12432216. S2CID 23521290.
- ^ а б c d е ж грамм час я j k Окацу К., Иемура С., Кояно Ф., Го Э, Кимура М., Нацумэ Т., Танака К., Мацуда Н. (ноябрь 2012 г.). «Митохондриальная гексокиназа HKI представляет собой новый субстрат убиквитинлигазы Паркина». Сообщения о биохимических и биофизических исследованиях. 428 (1): 197–202. Дои:10.1016 / j.bbrc.2012.10.041. PMID 23068103.
- ^ а б c d е ж грамм Алешин А.Е., Цзэн Ц., Буренков Г.П., Бартуник Х.Д., Фромм Х.Д., Хонзатко РБ (январь 1998 г.). «Механизм регуляции гексокиназы: новое понимание кристаллической структуры рекомбинантной гексокиназы головного мозга человека в комплексе с глюкозой и глюкозо-6-фосфатом». Структура. 6 (1): 39–50. Дои:10.1016 / s0969-2126 (98) 00006-9. PMID 9493266.
- ^ а б Алешин А.Е., Кирби С., Лю Х, Буренков Г.П., Бартуник HD, Фромм Х.Д., Хонзатко РБ (март 2000 г.). «Кристаллические структуры мутантной мономерной гексокиназы I обнаруживают множественные сайты связывания АДФ и конформационные изменения, относящиеся к аллостерической регуляции». Журнал молекулярной биологии. 296 (4): 1001–15. Дои:10.1006 / jmbi.1999.3494. PMID 10686099.
- ^ а б c d е ж грамм час я Роби РБ, Hay N (август 2006 г.). «Митохондриальные гексокиназы, новые медиаторы антиапоптотического действия факторов роста и Akt». Онкоген. 25 (34): 4683–96. Дои:10.1038 / sj.onc.1209595. PMID 16892082.
- ^ Карденас, ML; Корниш-Боуден, А; Урета, Т. (5 марта 1998 г.). «Эволюция и регуляторная роль гексокиназ». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1401 (3): 242–64. Дои:10.1016 / s0167-4889 (97) 00150-х. PMID 9540816.
- ^ а б c d Printz RL, Osawa H, Ardehali H, Koch S, Granner DK (февраль 1997 г.). «Ген гексокиназы II: структура, регуляция и организация промотора». Сделки Биохимического Общества. 25 (1): 107–12. Дои:10.1042 / bst0250107. PMID 9056853.
- ^ а б c d е Шиндлер А., Фоли Е. (декабрь 2013 г.). «Гексокиназа 1 блокирует апоптотические сигналы в митохондриях». Сотовая связь. 25 (12): 2685–92. Дои:10.1016 / j.cellsig.2013.08.035. PMID 24018046.
- ^ а б c d е ж Регенольд В. Т., Пратт М., Неккалапу С., Шапиро П. С., Кристиан Т., Фискум Г. (январь 2012 г.). «Митохондриальная отслойка гексокиназы 1 при настроении и психотических расстройствах: последствия для энергетического метаболизма мозга и нейротрофической передачи сигналов». Журнал психиатрических исследований. 46 (1): 95–104. Дои:10.1016 / j.jpsychires.2011.09.018. PMID 22018957.
- ^ а б c d е ж грамм Шан Д., Маунт D, Мур С., Арутюнян V, Мидор-Вудрафф Дж. Х., Маккалламсмит RE (апрель 2014 г.). «Аномальное разделение гексокиназы 1 предполагает нарушение комплекса белка транспорта глутамата при шизофрении». Исследование шизофрении. 154 (1–3): 1–13. Дои:10.1016 / j.schres.2014.01.028. ЧВК 4151500. PMID 24560881.
- ^ а б Рид, S; Мастерс, C (1985). «О онтогенетических свойствах и тканевых взаимодействиях гексокиназы». Механизмы старения и развития. 31 (2): 197–212. Дои:10.1016 / с0047-6374 (85) 80030-0. PMID 4058069. S2CID 40877603.
- ^ а б c d е Wang F, Wang Y, Zhang B, Zhao L, Lyubasyuk V, Wang K, Xu M, Li Y, Wu F, Wen C, Bernstein PS, Lin D, Zhu S, Wang H, Zhang K, Chen R (ноябрь 2014 г.) ). «Миссенс-мутация в HK1 приводит к аутосомно-доминантному пигментному ретиниту». Исследовательская офтальмология и визуализация. 55 (11): 7159–64. Дои:10.1167 / iovs.14-15520. ЧВК 4224578. PMID 25316723.
- ^ Гьесинг А.П., Нильсен А.А., Брандслунд I, Кристенсен С., Сандбек А., Йоргенсен Т., Витте Д., Боннефонд А., Фрогель П., Хансен Т., Педерсен О. (25 июля 2011 г.). «Изучение генетического варианта HK1 в отношении количественных метаболических признаков и распространенности диабета 2 типа». BMC Medical Genetics. 12: 99. Дои:10.1186/1471-2350-12-99. ЧВК 3161933. PMID 21781351.
- ^ Онлайн-менделевское наследование в человеке (OMIM): 605285
- ^ а б c Салливан Л.С., Кобольдт, округ Колумбия, Боун С.Дж., Лэнг С., Блэнтон С.Х., Кадена Э., Эйвери К.Э., Льюис Р.А., Уэбб-Джонс К., Уитон Д.Х., Берч Д.Г., Кусса Р., Рен Х, Лопес И., Чакарова С., Коенекоп Р.К., Гарсия Калифорния, Фултон Р.С., Уилсон Р.К., Вайншток GM, Дайгер СП (ноябрь 2014 г.). «Доминантная мутация гексокиназы 1 (HK1) вызывает пигментный ретинит». Исследовательская офтальмология и визуализация. 55 (11): 7147–58. Дои:10.1167 / iovs.14-15419. ЧВК 4224580. PMID 25190649.
дальнейшее чтение
- Даниэле А, Альтруда Ф, Ферроне М, Силенго Л, Ромео Дж, Арчидиаконо Н, Рокки М. (1992). «Отображение гена гексокиназы 1 человека на 10q11 ---- qter». Человеческая наследственность. 42 (2): 107–10. Дои:10.1159/000154049. PMID 1572668.
- Маньяни М., Бьянки М., Касабьянка А., Стокки В., Даниэле А., Альтруда Ф., Ферроне М., Силенго Л. (июль 1992 г.). «Рекомбинантная человеческая мини-гексокиназа каталитически активна и регулируется гексозо-6-фосфатами». Биохимический журнал. 285 (1): 193–9. Дои:10.1042 / bj2850193. ЧВК 1132765. PMID 1637300.
- Маньяни М., Серафини Дж., Бьянки М., Касабьянка А., Стокки В. (январь 1991 г.). «Микрогетерогенность гексокиназы человека I типа обусловлена различными аминоконцевыми последовательностями». Журнал биологической химии. 266 (1): 502–5. PMID 1985912.
- Адамс В., Гриффин Л.Д., Гелб Б.Д., МакКейб Е.Р. (июнь 1991 г.). «Протеинкиназная активность гексокиназы головного мозга крысы». Сообщения о биохимических и биофизических исследованиях. 177 (3): 1101–6. Дои:10.1016 / 0006-291X (91) 90652-N. PMID 2059200.
- Мураками К., Блей Ф., Тилтон В., Матрос С., Пиомелли С. (февраль 1990 г.). «Изофермент гексокиназы, специфичный для красных кровяных телец человека (HKR)». Кровь. 75 (3): 770–5. Дои:10.1182 / кровь.V75.3.770.770. PMID 2297576.
- Ниши С., Сейно С., Белл Г.И. (декабрь 1988 г.). «Гексокиназа человека: последовательности амино- и карбоксиконцевых половин гомологичны». Сообщения о биохимических и биофизических исследованиях. 157 (3): 937–43. Дои:10.1016 / S0006-291X (88) 80964-1. PMID 3207429.
- Райксен Г., Аккерман Дж. У., ван ден Вал Бейк А. В., Хофстеде Д. П., Стаал Г. Э. (январь 1983 г.). «Генерализованный дефицит гексокиназы в клетках крови пациента с несфероцитарной гемолитической анемией». Кровь. 61 (1): 12–8. Дои:10.1182 / blood.V61.1.12.12. PMID 6848140.
- Бьянки М, Маньяни М (1995). «Мутации гексокиназы, вызывающие несфероцитарную гемолитическую анемию». Клетки, молекулы и болезни крови. 21 (1): 2–8. Дои:10.1006 / млрд куб.м.1995.0002. PMID 7655856.
- Blachly-Dyson E, Zambronicz EB, Yu WH, Adams V, McCabe ER, Adelman J, Colombini M, Forte M (январь 1993 г.). «Клонирование и функциональная экспрессия в дрожжах двух человеческих изоформ внешнего канала митохондриальной мембраны, потенциал-зависимого анионного канала». Журнал биологической химии. 268 (3): 1835–41. PMID 8420959.
- Алешин А.Е., Цзэн Ц., Фромм Х.Д., Хонзатко РБ (август 1996 г.). «Кристаллизация и предварительный рентгеноструктурный анализ гексокиназы головного мозга человека». Письма FEBS. 391 (1–2): 9–10. Дои:10.1016/0014-5793(96)00688-6. PMID 8706938. S2CID 44367910.
- Visconti PE, Olds-Clarke P, Moss SB, Kalab P, Travis AJ, de las Heras M, Kopf GS (январь 1996 г.). «Свойства и локализация тирозин-фосфорилированной формы гексокиназы в сперме мышей». Молекулярное воспроизводство и развитие. 43 (1): 82–93. Дои:10.1002 / (SICI) 1098-2795 (199601) 43: 1 <82 :: AID-MRD11> 3.0.CO; 2-6. PMID 8720117.
- Мори К., Накамура Н., Уэлч Дж. Э., Шиота К., Эдди Э.М. (май 1996 г.). «Яичко-специфическая экспрессия мРНК для уникальной гексокиназы человека 1 типа, лишенной порин-связывающего домена». Молекулярное воспроизводство и развитие. 44 (1): 14–22. Дои:10.1002 / (SICI) 1098-2795 (199605) 44: 1 <14 :: AID-MRD2> 3.0.CO; 2-W. PMID 8722688.
- Мураками К., Пиомелли С. (февраль 1997 г.). «Идентификация кДНК для изофермента гексокиназы, специфичного для красных кровяных телец». Кровь. 89 (3): 762–6. Дои:10.1182 / кровь.V89.3.762. PMID 9028305.
- Руццо А., Андреони Ф., Маньяни М. (январь 1998 г.). «В гене гексокиназы человека присутствует специфический для эритроида экзон». Кровь. 91 (1): 363–4. Дои:10.1182 / blood.V91.1.363. PMID 9414310.
- Трэвис А.Дж., Фостер Дж.А., Розенбаум Н.А., Висконти П.Е., Гертон Г.Л., Копф Г.С., Мосс С.Б. (февраль 1998 г.). «Нацеливание гексокиназы типа 1, специфичной для зародышевых клеток, лишенной порин-связывающего домена, на митохондрии, а также на головку и фиброзную оболочку сперматозоидов мыши». Молекулярная биология клетки. 9 (2): 263–76. Дои:10.1091 / mbc.9.2.263. ЧВК 25249. PMID 9450953.
- Алешин А.Е., Цзэн Ц., Буренков Г.П., Бартуник Х.Д., Фромм Х.Д., Хонзатко РБ (январь 1998 г.). «Механизм регуляции гексокиназы: новый взгляд на кристаллическую структуру рекомбинантной гексокиназы головного мозга человека в комплексе с глюкозой и глюкозо-6-фосфатом». Структура. 6 (1): 39–50. Дои:10.1016 / S0969-2126 (98) 00006-9. PMID 9493266.
- Руццо А., Андреони Ф., Маньяни М. (апрель 1998 г.). «Структура гена гексокиназы человека I типа и нуклеотидная последовательность 5'-фланкирующей области». Биохимический журнал. 331 (2): 607–13. Дои:10.1042 / bj3310607. ЧВК 1219395. PMID 9531504.
- Алешин А.Е., Зенг С., Бартуник Х.Д., Фромм Х.Д., Хонзатко РБ (сентябрь 1998 г.). «Регулирование гексокиназы I: кристаллическая структура рекомбинантной гексокиназы мозга человека в комплексе с глюкозой и фосфатом». Журнал молекулярной биологии. 282 (2): 345–57. Дои:10.1006 / jmbi.1998.2017. PMID 9735292.
- Мураками К., Канно Х, Мива С., Пиомелли С. (июнь 1999 г.). «Изофермент HKR человека: организация гена гексокиназы I, эритроид-специфического промотора и сайта инициации транскрипции». Молекулярная генетика и метаболизм. 67 (2): 118–30. Дои:10.1006 / мг.1999.2842. PMID 10356311.