Ингибитор металлопротеиназы - Metalloprotease inhibitor
Ингибиторы металлопротеаз сотовые ингибиторы из Матричные металлопротеиназы (ММП).[1] MMP принадлежат к семейству цинк -зависимая нейтральная эндопептидазы.[2] Эти ферменты иметь способность сломаться соединительная ткань. Экспрессия ММП повышена в различных патологический такие условия как воспалительный состояния, метаболическая болезнь костей, рак вторжение метастаз и ангиогенез.Примеры болезней пародонтит, гепатит, гломерулонефрит, атеросклероз, эмфизема, астма, аутоиммунные заболевания кожи и фотостарение кожи, ревматоидный артрит, остеоартроз, рассеянный склероз, Болезнь Альцгеймера, хронические язвы, инволюция матки, дефекты эпителия роговицы, резорбция костной ткани, прогрессирование опухоли и метастазирование.[2][3] Из-за роли ММП в патологических состояниях ингибиторы ММП могут иметь терапевтический потенциал.[3] Некоторые другие белки обладают аналогичными ингибирующими эффектами, однако ни один из них не столь эффективен (нетрины, усилитель С-концевой протеиназы проколлагена (PCPE), индуцирующий реверсию богатый цистеином белок с мотивами Kazal (RECK) и ингибитор пути тканевого фактора (TFPI-2)). У них может быть другая биологическая активность, которая еще полностью охарактеризована.[4]
Ингибиторы ММП в широком смысле можно подразделить на несинтетические (например, эндогенный ) или же синтетический.[2] Было идентифицировано несколько мощных ингибиторов ММП, включая гидроксиматы, тиолы, карбамоилфосфонаты, гидроксимочевина, гидразины, β-лактамы, квадратные кислоты и азотистые лиганды.[5]
Обычно используются три класса ингибиторы за металлопротеиназы.
- В пробирке, EDTA, 1,10-фенантролин и другие хелатирующие соединения снизить концентрацию металла до точки, при которой металл удаляется из фермент активный сайт.
- Классические ингибиторы замков и ключей, такие как фосфорамидон и бестатин связать плотно, приблизив переходное состояние гидролиза пептида, предотвращая его действие на другие субстраты.
- Ингибиторы белков, такие как α2-макроглобулин известно, что они работают с металлопротеиназами.
История
Ингибиторы ММП первого поколения основывались на структуре коллаген молекула. Эта группа ингибиторов содержит гидроксамат (-CONHOH) группа, связывающая цинк атом в активном центре фермента ММП.[6] Первыми ингибиторами ММП, испытанными на пациентах, были: Иломастат и Батимастат, ингибиторы ММП на основе гидроксаматов.[6][7] Однако ни сложный показал хорошие устные биодоступность.[6]
Пока что Периостат (активный ингредиент - доксициклин гиклат) - единственный ингибитор ММП, одобренный США. Управление по контролю за продуктами и лекарствами (FDA). Применяется для лечения пародонтита. Другие ингибиторы ММП показали серьезные побочные эффекты в течение доклинические испытания. Эти побочные эффекты вызваны недостаточным избирательность. Большинство ингибиторов ММП не способны воздействовать на определенные ММП, связанные с определенными патологическими условия. Вместо этого они подавляют несколько ММП, некоторые из которых обладают защитными функциями или не связаны с патологией.[5]
ММП считаются многообещающими мишенями для лечения рака. Доклинические исследования эффективности подавления ММП на моделях опухолей были обнадеживающими. По этим результатам были проведены клинические исследования, но они оказались неутешительными. Недавние исследования показали, что ММП могут даже иметь парадоксальный роли в прогрессировании опухоли. ММП, по-видимому, обладают способствующим развитию опухолей эффектом, а также опухоль подавляющие эффекты зависят от разных контекстов.[8]
Механизм действия

Большинство ингибиторов ММП хелатирующие агенты. Ингибитор связывается с цинком в активном центре фермента, тем самым блокируя его активность. Возможны другие механизмы ингибирования.[1]
α2-макроглобулин (α2M) является протеаза ингибитор, который ингибирует активированные ММП. α2M и MMP образуют сложный который может деактивировать MMP.[9]
MMP связаны с клетка поверхность или привязанный к внеклеточный матрикс что мешает им распространяющийся прочь и держит MMP под контролем ячейки. Один механизм подавление активности ММП заключается в удалении ферментов из их рецепторы. Золото соли привязать к тяжелому металл отдельные участки образуют цинксодержащий активный центр, который подавляет их активность. Активность ММП может быть уменьшена путем связывания с сайтом расщепления на субстрат например катехин.[1]
Два молекулярный особенности большинства ингибиторов ММП ответственны за близость. Один хелатный часть который взаимодействует с ионом цинка, а другой - гидрофобный удлинение от каталитического сайта, которое проецируется в карман S1 ’(группа P1’) металлопротеиназы. Структурное различие MMPs ’находится в основном на стороне S1’, и путем модификации группы P1 ’можно развить селективность ингибитора.[10]
Разработка лекарств
Различные потенциальные ингибиторы ММП будут объяснены в следующих разделах, включая информацию об их развитии, взаимосвязи структура-активность и фармакокинетике.
Новаторские гидроксаматные структуры
Первое поколение ингибиторов ММП основывалось на структуре молекулы коллагена. В конструкции этих ингибиторов основные белок позвоночник коллагена сохраняется, но амидная связь заменен на группу, связывающую цинк.[11] Эта группа ингибиторов содержит группу гидроксамата (-CONHOH), которая связывает атом цинка в активном центре фермента ММП, поэтому эту группу называют «ингибиторами ММП на основе гидроксамата».[6] Пример можно увидеть в Маримастат, ингибитор первого поколения, который имеет такой же формат основной и боковой цепи, что и коллаген.

Иломастат и батимастат были первыми двумя ингибиторами ММП, испытанными на пациентах. Оба они являются ингибиторами ММП на основе гидроксаматов и имеют схожую общую структуру.

Ингибиторы ММП на основе гидроксамата демонстрируют отличные противоопухолевый активность в опухолевых клетках, но клинические характеристики этих соединений неутешительны. Фактором, способствовавшим этому разочарованию, было то, что они являются ингибиторами широкого спектра действия многих подтипов MMP, которые во многих случаях могут также ингибировать членов семейства протеаз ADAM. Когда они были испытаны на пациентах, они вызвали ограничение дозы мускулистый и скелетный боль у ряда пациентов.[5][7] Только тогда, когда структуры ингибиторов ММП могут быть скорректированы для придания селективности и отмены токсичность Достигнут ли они клинического эффекта в химиотерапии рака.[7]
Ингибиторы на основе гидроксаматов нового поколения
За новаторскими ингибиторами на основе гидроксамата последовал набор молекул «нового поколения» с функциями, включая заменен арил, а сульфонамид и гидроксамат цинк-связывающая группа.

В MMI-270 также есть аминокислота заместитель типа боковой цепи на атоме углерода, который является α по отношению к гидроксамату, вместе с боковой цепью сульфонамида (который, как позже было показано, не является необходимым). Гидроксамат N-арилсульфонил-α-аминокислоты MMI-270 имитирует маримастат сукцинат мотив. Ципемастат, который был разработан как ММП-1, -3 и -9 ингибитор коллагеназы для лечение из ревматоидный - и остео -артрит, также имеет мотив сукцината маримастата. Его клинические испытания были прекращены досрочно.
MMI-166 имеет N-арилсульфонил-α-аминокарбоксилатную цинк-связывающую группу, отличную от связывающей гидроксамат-цинк группы, наблюдаемой в MMI-270 и ципемастате. Он также имеет триарильное замещение, которого не было в других структурах. ABT-770 и Приномастат также имеют арильное замещение. В ABT-770 два фенильных кольца соединены напрямую, но в Приномастате два фенильные кольца связаны кислород атом, образующий дифениловый эфир. Эти три перестановки направляют SAR от ММП-1 и к «глубоким карманам» ММП, таким как желатиназы. ABT-770 проявляет противоопухолевую активность на животных моделях, но легко метаболизируется до амин метаболит что вызывает фосфолипидоз. MMI-166 продемонстрировал противоопухолевую активность на многочисленных моделях животных, но данные о его клинической эффективности отсутствуют. С другой стороны, приномастат - один из наиболее изученных ингибиторов ММП. Он показал отличные доклинические противоопухолевые свойства у животных. эффективность, но повторяющееся ограничение для этих гидроксаматов (в частности, приномастата) - это метаболизм лекарственного средства, включая потерю гидроксаматной цинк-связывающей группы.

За этими ингибиторами последовала следующая группа ингибиторов на основе гидроксамата, которые фокусируются на подавлении метаболизма, минимизации ингибирующей активности MMP-1 и контроле селективности подтипа с помощью дизайна на основе структуры. В тетрагидропиран в RS-130830 вводится стерический блокировка, подавляющая метаболизм, которая решила бы проблему, обнаруженную в ингибиторах предыдущего поколения. Результаты его клинической оценки пока не разглашаются. 239796-97-5 улучшено ADME и селективность MMP-1 и показал отличные устный эффективность на животной модели остеоартрита. Хотя терапевтическая цель этих ингибиторов - не рак, как это было для большинства ингибиторов ММП.[7]
Ингибиторы на основе тиолов нового поколения

Ребимастат - ингибитор ММП широкого спектра действия с тиол цинк-связывающая группа. Он имеет пероральную биодоступность и является непептидным миметиком коллагена. Ребимастат обладает некоторой избирательностью, поскольку он не подавляет все операции ММП. Металлопротеиназы, выделяющие TNF-альфа, TNF-II, L-селектин, IL-1-RII и Ил-6 например, не ингибируются Ребимастатом.
На этапе I клинические испытания, признаков дозозависимого соединение токсичность и стабилизация заболевания. Артралгия был отмечен в фазе II рано рак молочной железы исследования, которые были связаны с токсичностью ингибитора ММП. Ребимастат использовался в Паклитаксел /Карбоплатин лечение в фазе III. По результатам исследования частота встречаемости неблагоприятные реакции, без пособия на выживание.

Клинические испытания для Таномастат, альфа - ((фенилтио) метил) карбоксилат, показал аналогичные результаты. Он показал хорошую устойчивость к заболеванию и переносимость в испытаниях солидных опухолей фазы I и хорошую переносимость при запущенном раке в сочетании с Этопозид. Однако его эффективность не была доказана. Таномастат показал значительную гепатотоксичность в терапии рака в сочетании с Цисплатин и этопозид, хотя при лечении Доксорубицин он показал хорошую переносимость и пониженную токсичность с 5-фторурацил и Лейковорин.
Многие соединения в тиоловых цинк-связывающих группах содержат хорошую воду. растворимость и есть воздуха стабильный в плазма и эти группы будут продолжены в разработке ингибиторов ММП.[7]
Ингибиторы на основе пиримидина

Ro 28-2653 очень селективен для ММП-2, ММП-9 и мембрана типа 1 (МТ-1 ) -ММП. Это противоопухолевое и антиангиогенное средство с пероральной биодоступностью. Подавление ТАСЕ и MMP-1 связаны с опорно-двигательный аппарат побочные эффекты наблюдаются у ингибиторов гидроксамат-металлопротеиназы, но это соединение щадит ферменты.[12] Было показано, что он уменьшает рост опухоли в носовой рак у крыс, а также предстательная железа рак клеточные культуры. Соединение оказывает умеренное влияние на мышей. жировая ткань и никаких переделок на суставах. На основании этого делается вывод, что класс ингибиторов с меньшей вероятностью спусковой крючок нервно-мышечный побочные эффекты. На активном сайте конструкции находится пиримидинетрион хелатирование и фенил и пиперидинил секции занимают связывающие карманы S1 ’и S2’ ММП-8.
Соединение 556052-30-3 похоже на Ro 28-2653, но включает 4 - ((2-метилхинолин-4-ил) метокси) фенильную боковую цепь, которая является селективной к ТАСЕ.
5- (спиропирролидин-5-ил) пиримидинетрион представляет собой соединение, названное 848773-43-3, которое является мощным ингибитором ММР-2, ММР-9 и ММР-13, не содержащим ММП-1 и ТАСЕ.
Путем замены 1,3,4-оксадиазол-2-илгетероарила на C-4 ’сегмента дифенилового эфира для достижения ММП-13 селективность по МТ-1 ММП, составила соединение 420121-84-2. В комплексе есть IC50 (половина максимальной ингибирующей концентрации) 1 нМ для ММП-13.
I125-радиоактивные пиримидинетрионы, которые имеют аналогичную структуру, были сделаны для использования при повышенном атеросклерозе MMP-9 и повышенном раке MMP-2 и MMP-9.
Этот класс ингибиторов ММП легко поддается лечению. синтезировать и есть мощный достаточно для клинической оценки.


Соединение 544678-85 представляет собой новейший ингибитор на основе пиримидина, соединение представляет собой пиримидин-4,6-дикарбоксамид, который является очень сильнодействующим и селективным по отношению к MMP-13. Соединение имеет петлю специфичности, которая внутри кармана S1 ’и его 3-метил-4-фторгруппа достаточно проксимальна к цинку, чтобы изменить водную составляющую. Эти соединения обладают хорошей биодоступностью при пероральном приеме и свойствами, которые делают их хорошими кандидатами на роль ингибитора подтипа заболеваний, связанных с MMP-13, и для дальнейшего развития.[7]
Пиримидин дикарбоксамиды являются высокоселективными ингибиторами MMP-13. В кармане S1 ’MMP-13 находится боковой карман S1’, который является уникальным для матричной металлопротеиназы. Пиримидиндикарбоксамиды связываются с этим боковым карманом, что увеличивает селективность. Роль MMP-13 раскалывающая фибриллярный коллаген на нейтральном pH и выше мРНК уровни MMP-13 обнаружены в груди карцинома суставы и остеоартроз.
Пример ингибитора пиримидиндикарбоксамида на изображении не взаимодействует с каталитическим ионом цинка, а скорее связывается с боковым карманом S1 ’.[10] Один пиридил рука расположена у входа в карман S1 ’, в то время как другая рука из пиридила проходит через карман S1’ в боковой карман.[13]
Ингибиторы на основе гидроксипирона
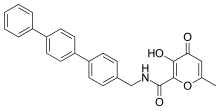
Сильные и селективные ингибиторы MMP-3 были разработаны с использованием гидроксипирона в качестве группы, связывающей цинк. Прикрепив арильную основу к позиции 2 пирон кольцо, была получена большая избирательность. На гидроксипироновом кольце доступны три позиции для присоединения скелетов: позиции 2, 5 и 6.[14]
Ингибиторы ММП на основе гидроксипирона структурно соответствуют пиримидинетрионам. Недавним ингибитором является соединение 3-гидроксипиран-4-он, номинированное 868368-30-3. это ММП-3 селективный и его 0,0-двузубый хелатирование цинка является структурной частью, которая, как предполагается, отвечает за ММП. признание.[7]
Ингибиторы на основе фосфора

Исследование ингибиторов ММП с фосфор группы на основе цинка, ориентированные на α-бифенилсульфониламинофосфонаты. Эти ингибиторы связываются через два фосфонатных атома кислорода. Были разработаны ингибиторы фосфонатов, которые проявляют селективность в отношении MMP-8 по сравнению с другими MMP. Селективные ингибиторы MMP-8 могут быть полезны при лечении острых заболеваний печени и рассеянный склероз[15] Сообщалось, что фосфиновые ингибиторы ММП нацелены на ММП-11 и ММП-13. MMP-13 играет роль в хрящ деградация при остеоартрозе. Эти фосфинатные ингибиторы ММП содержат фенильные сегменты, которые, как считается, ответственны за селективность по отношению к ММП-13. Фосфиновая группа этих ингибиторов (R1р2 (O) OH) связывается как цинковый лиганд. р1 и R2 заместители влияют на эффективность ингибирования.[7]
Были разработаны ингибиторы фосфинатов, которые показали высокую селективность в отношении ММП-11. Производные на основе фенильных колец показали лучшую селективность. MMP-11 может быть полезной мишенью для опухолеобразование при раке груди.

Ингибиторы на основе фосфора с карбамоил фосфонатные цинк-связывающие группы не связываются через два кислорода фосфоната. Карбамоилфосфонатные группы связывания цинка связывают Zn2+ через кислород фосфоната и кислород альфа-карбонил к фосфонату. Это связывание образует 5-членное хелатное кольцо, которое похоже на связывание гидроксамовой кислоты.
В амидная связь карбамоилфосфоната обеспечивают водородная связь донор для белок взаимодействий и амидная группа имеет электрон способность жертвовать, которая дает сильные Zn2+ карбамоилфосфонатные группы, связывающие цинк, имеют отрицательный обвинять что препятствует проникновению этих ингибиторов в клетки и ограничивает их внеклеточный Космос. Это предотвращение проникновения клеток способствует низкой токсичности этих ингибиторов. Ингибиторы с карбамоилфосфонатной цинксвязывающей группой являются селективными для ММП-2. ММП-2 может быть полезным цель для инвазии опухоли и ангиогенез. Был разработан ингибитор карбамоилфосфоната, который воздействует на ММП-2 и ММП-9, не затрагивая другие ММП. Это соединение показало ингибирующую активность в отношении инвазии клеток и опухолей. колонизация. В in vivo исследований, этот ингибитор показал эффективность при пероральном дозирование и администрация в брюшная полость (внутрибрюшинно). Он показывает медленно поглощение, стремительный устранение и низкий оральный биодоступность. Длительное всасывание способствует устойчивой эффективности. Ингибиторы с карбамоилфосфонатными цинк-связывающими группами являются водорастворимыми при физиологический pH.[15]
Ингибиторы на основе тетрациклина

Тетрациклины - это антибиотики которые также проявляют ингибирующую активность ММП. Они хелатируют Zn2+ ion, тем самым подавляя активность ММП. Считается, что тетрациклины также влияют на экспрессию ММП и протеолитическую активность.[16]
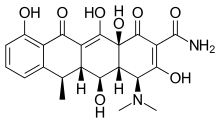
Доксициклин полусинтетический тетрациклин, который был изучен на стоматологический и медицинские приложения. Его влияние на такие заболевания, как пародонтит и рак исследован.[2] Доксициклин почти полностью абсорбируется, его биодоступность в среднем составляет около 95%, а при одновременном приеме с пищей снижается на 20%. Его объем распространения 50–80 л (0,7 л / кг). Связывание с белками составляет 82–93%. это выделенный в моче и в кале. Доксициклин доступен в пероральном и внутривенный форма.[17] Доксициклин проявлял ингибирующую активность в отношении ММП-2 и ММП-9.[2] Экспрессия и активность MMP-2 и MMP-9 часто повышаются при раке человека. Повышенная экспрессия и активность коррелируют с поздней стадией опухоли, увеличением метастазов и прогноз.[8]
Химически модифицированный тетрациклины (CMT) были разработаны для изучения их ингибирующего потенциала. Большинство исследований тетрациклинов и CMT показали, что они могут ингибировать активность ММП.

Было продемонстрировано, что один CMT, называемый COL-3 или метастат, является мощным ингибитором MMP. COL-3 имеет тетрациклиновый каркас, который не замещен в положениях C4 – C9.[16]
Преимущества CMT перед общепринятый тетрациклины заключаются в том, что хроническое употребление не приводит к желудочно-кишечный токсичность и более высокие уровни в плазме могут быть достигнуты при более длительном сокращении периода приема частота.
В фармакокинетика COL-3 был изучен на крысах. COL-3 медленно всасывается из желудочно-кишечного тракта. 3% выводятся через мочеиспускательный канал 55–66% выводится с калом. В препарат, средство, медикамент очень липофильный и может пересечь гематоэнцефалический барьер в более высоких дозах. COL-3 накапливается в более высокой концентрации в сердце ткань и яичко.В клинических испытаниях было показано, что связывание с белками плазмы высокое (~ 94,5%). Большинство COL-3 связывается с сывороточный альбумин.[2]
Эндогенные ингибиторы
Активность ММП регулируется на различных уровнях, например, с помощью эндогенный такие ингибиторы, как α2-макроглобулин, и тканевые ингибиторы металлопротеиназ (ТИМП).[18]
α2-макроглобулин регулирует широкий спектр протеазы, пока TIMPs являются более специфическими эндогенными ингибиторами ММП. α2-макроглобулин обильный белок плазмы, который действует в тканевых жидкостях.[8] Плазма гликопротеин состоит из четырех субъединиц.[19] α2-макроглобулин не ингибирует активацию ММП или самих ММП.[8] Он захватывает протеиназы, такие как ММП, и образует сложный с ними.[19] Комплекс эндоцитозированный и очищен белок, связанный с рецепторами липопротеинов низкой плотности.[8]
В люди, Найдено 4 разных ТИМП. Они есть секретный белки низко-молекулярный вес. TIMP связывают нековалентно на активный сайт ММП.[18] Считается, что изменения уровней ТИМП играют роль в патологических состояниях, связанных с несбалансированной активностью ММП.[19] ТИМП состоят из 184–194 аминокислот. Эти ингибиторы подразделяются на два домена. N-концевой и C-терминал.[19] N-концевые области четырех TIMP имеют общую структуру. Все они содержат двенадцать цистеин остатки, образующие шесть дисульфидные связи. Эти связи имеют решающее значение для конформации N-конца и его активности по ингибированию MMP. C-терминалы TIMP отличаются друг от друга.[8] N-концевая субъединица способна ингибировать ММП. Форма молекулы ТИМП соответствует активному центру ММП. TIMP связывается с каталитический расщепление ММП аналогично субстрату. ТИМП ингибируют все ММП, кроме ТИМП-1 который не ингибирует МТ-1-ММП.[19]
Есть некоторые различия в тормозных предпочтениях ТИМП. Например, ТИМП-1 способствует ингибированию ММП-9. Другие примеры: ТИМП-2 и ТИМП-4 которые являются более сильными ингибиторами ММП-2, чем ингибиторы ММП-9.[8]
TIMP потенциально могут быть полезны против таких болезней, как сердечно-сосудистые заболевания и рак. Применение TIMP в качестве терапевтического инструмента через генная терапия или прямое применение белка все еще находится на ранних стадиях разработки. Предпочтительно ингибировать определенные MPP, которые играют роль в патологических состояниях. Поскольку ТИМП ингибируют несколько ММП, желательно разработать сконструированные ТИМП с измененной специфичностью.[19]
Текущее состояние
Основная цель разработки ингибиторов ММП - селективность. Ожидается, что нацеливание на определенные MMP повысит эффективность и предотвратит побочные эффекты как скелетно-мышечный синдром (MSS).[15] Трехмерные структуры ингибиторов ММП дают представление о структурных отношениях селективности. Скрининг с высокой пропускной способностью может также увеличить шансы обнаружения ингибиторов с высокой селективностью.[13]
Смотрите также
- Матричная металлопротеиназа
- Ингибиторы ММП
- Коллаген
- Рак
- Пародонтит
- Артрит
- Ревматоидный артрит
- Остеоартроз
- Тетрациклин
- Периостат
Рекомендации
- ^ а б c Фредерик, В. (1999). «Ингибирование матричной металлопротеиназы: от юрского периода до третьего тысячелетия». Ann N Y Acad Sci. 878 (1): 388–403. Bibcode:1999НЯСА.878..388Вт. Дои:10.1111 / j.1749-6632.1999.tb07697.x. PMID 10415743.
- ^ а б c d е ж Acharya, M. R .; Venitz, J .; Figg, W. D .; Спарребум, А. (2004). «Химически модифицированные тетрациклины как ингибиторы матриксных металлопротеиназ». Обновления лекарственной устойчивости. 7 (3): 195–208. Дои:10.1016 / j.drup.2004.04.002. PMID 15296861.
- ^ а б Уиттакер, Марк; Эйскоу, Эндрю (2001). «Матричные металлопротеиназы и их ингибиторы - текущее состояние и будущие задачи». Сотовые передачи. 17 (1): 3–14.
- ^ Бейкер, Эндрю; Дилан Р. Эдвардс; Джиллиан Мерфи (октябрь 2002 г.). «Ингибиторы металлопротеиназ: биологическое действие и терапевтические возможности». J Cell Sci. 115 (19): 3719–3727. Дои:10.1242 / jcs.00063. PMID 12235282.
- ^ а б c Durrant, J.D .; де Оливейра, К. А. Ф .; Маккаммон, Дж. А. (2011). «Ингибиторы металлопротеиназ 2 и 3 на основе пирона могут работать как конформационно-селективные ингибиторы». Химическая биология и дизайн лекарств. 78 (2): 191–198. Дои:10.1111 / j.1747-0285.2011.01148.x. ЧВК 3135671. PMID 21609408.
- ^ а б c d Браун, П. Д. (1997). «Ингибиторы матриксных металлопротеиназ в лечении рака». Медицинская онкология. 14 (1): 1–10. Дои:10.1007 / BF02990939. PMID 9232605.
- ^ а б c d е ж грамм час Фишер, Дж. Ф .; Mobashery, С. (2006). «Последние достижения в разработке ингибиторов ММП». Раковые метастазы Rev. 25 (1): 115–136. Дои:10.1007 / s10555-006-7894-9. PMID 16680577.
- ^ а б c d е ж грамм Hua, H .; Li, M .; Луо, Т; Инь, Й .; Цзян, Y (2011). «Матричные металлопротеиназы в опухолевом генезе: развивающаяся парадигма». Клеточные и молекулярные науки о жизни. 68 (23): 3853–3868. Дои:10.1007 / s00018-011-0763-х. PMID 21744247.
- ^ Chen, J .; Чу ý.; Cao, J .; Wang, W .; Liu, J .; Ван, Дж. (2011). «Влияние токсина Т-2 и селена на экспрессию матриксных металлопротеиназ в хондроцитах (MMP-1, MMP-13), α2-макроглобулина (α2M) и TIMP». Токсикология in vitro. 25 (2): 492–499. Дои:10.1016 / j.tiv.2010.12.001. PMID 21144892.
- ^ а б Engel, C.K .; Pirard, B .; Schimanski, S .; Kirsch, R .; Habermann, J .; Klingler, O .; Вендт, К. У. (2005). «Структурная основа высокоселективного ингибирования MMP-13». Химия и биология. 12 (2): 181–189. Дои:10.1016 / j.chembiol.2004.11.014. PMID 15734645.
- ^ Whittaker, M .; Floyd, C.D .; Brown, P .; Геринг, А. Дж. Х. (1999). «Дизайн и терапевтическое применение ингибиторов матриксных металлопротеиназ». Chem. Rev. 99 (9): 2735–2776. Дои:10.1021 / cr9804543. PMID 11749499.
- ^ Maquoi, E .; Sounni, N.E .; Devy, L .; Olivier, F .; Frankenne, F .; Krell, H.W .; Ноэль, А. (2004). «Противоинвазивная, противоопухолевая и антиангиогенная эффективность производного пиримидин-2,4,6-триона, перорально активного и селективного ингибитора матриксных металлопротеиназ». Clin Cancer Res. 10 (12): 4038–4047. Дои:10.1158 / 1078-0432.ccr-04-0125. PMID 15217936.
- ^ а б Пирар, Б. (2007). «Понимание структурных детерминант селективного ингибирования матриксных металлопротеиназ». Открытие наркотиков сегодня. 12 (15–16): 640–646. Дои:10.1016 / j.drudis.2007.06.003. PMID 17706545.
- ^ Ян, Я.-Л .; Миллер, М. Т .; Cao, Y .; Коэн, С. М. (2009). «Синтез ингибиторов матричной металлопротеиназы на основе гидроксипирона и гидрокситиопирона: разработка взаимосвязи структура – активность». Письма по биоорганической и медицинской химии. 19 (7): 1970–1976. Дои:10.1016 / j.bmcl.2009.02.044. ЧВК 2833267. PMID 19261472.
- ^ а б c Jacobsen, J. A .; Major Jourden, J. L .; Миллер, М. Т .; Коэн, С. М. (2010). «Связывать цинк или не связывать цинк: исследование инновационных подходов к улучшенному ингибированию металлопротеиназы». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1803 (1): 72–94. Дои:10.1016 / j.bbamcr.2009.08.006. PMID 19712708.
- ^ а б Закери, Б .; Райт, Г. Д. (2008). «Химическая биология антибиотиков тетрациклинового ряда». Биохимия и клеточная биология. 86 (2): 124–136. Дои:10.1139 / o08-002. PMID 18443626.
- ^ Agwuh, K. N .; Макгоуэн, А. (2006). «Фармакокинетика и фармакодинамика тетрациклинов, включая глицилциклины». Журнал антимикробной химиотерапии. 58 (2): 256–265. Дои:10.1093 / jac / dkl224. PMID 16816396.
- ^ а б Рундхауг, Дж. Э. (2003). «Матричные металлопротеиназы, ангиогенез и рак». Clin Cancer Res. 9 (2): 551–554. PMID 12576417.
- ^ а б c d е ж Nagase, H .; Visse, R .; Мерфи, Г. (2006). «Структура и функция матричных металлопротеиназ и ТИМП». Сердечно-сосудистые исследования. 69 (3): 562–573. Дои:10.1016 / j.cardiores.2005.12.002. PMID 16405877.
