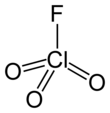
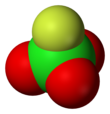
Перхлорил фторид - Perchloryl fluoride
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Перхлорил фторид | |||
| Другие имена Оксифторид хлора, перхлорфторид, оксид фтора хлора, триоксихлорфторид, фторид хлорной кислоты | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.660 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| |||
| |||
| Характеристики | |||
| ClO3F | |||
| Молярная масса | 102,4496 г / моль | ||
| Внешность | Бесцветный газ | ||
| Запах | сладкий запах | ||
| Плотность | 1,434 г / см3 | ||
| Температура плавления | -147,8 ° С (-234,0 ° F, 125,3 К) | ||
| Точка кипения | -46,7 ° С (-52,1 ° F, 226,5 К) | ||
| 0,06 г / 100 мл (20 ° C) | |||
| Давление газа | 10,5 атм (20 ° C)[1] | ||
| Вязкость | 3,91 х 10−3 Па · с (@ точка плавления) | ||
| Структура | |||
| Тетраэдр[2]:373 | |||
| Термохимия | |||
Стандартный моляр энтропия (S | 278,97 Дж / (моль * К) | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -21,42 кДж / моль [3]:380 | ||
| Опасности | |||
| Главный опасности | Едкий, окисляющий, токсичный | ||
| NFPA 704 (огненный алмаз) | |||
| 3 частей на миллион | |||
| Смертельная доза или концентрация (LD, LC): | |||
LC50 (средняя концентрация ) | 385 частей на миллион (крыса, 4 часа) 451 частей на миллион (собака, 4 часа)[4] | ||
LCLo (самый низкий опубликованный ) | 2000 частей на миллион (крыса, 40 мин) 451 частей на миллион (собака, 4 часа)[4] | ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 3 частей на миллион (13,5 мг / м3)[1] | ||
REL (Рекомендуемые) | TWA 3 частей на миллион (14 мг / м3) ST 6 частей на миллион (28 мг / м3)[1] | ||
IDLH (Непосредственная опасность) | 100 частей на миллион[1] | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Перхлорил фторид[5] реактивный газ с химическая формула ClO
3F. Имеет характерный сладкий запах[6] что напоминает бензин и керосин. Он токсичен и является мощным окисляющий и фторирующий агент. Это фторид кислоты из хлорная кислота.
Несмотря на небольшую энтальпию образования (ΔЧАСж° = −5,2 ккал / моль), он кинетически устойчив, разлагается только при 400 ° C.[2]:380 Он довольно реактивен по отношению к восстановителям и анионам, однако атом хлора действует как электрофил.[2]:382 Взрыво реагирует с восстановителями, такими как металл. амиды, металлы, гидриды, так далее.[6] Его гидролиз в воде происходит очень медленно, в отличие от гидролиза хлорфторид.
Синтез и химия
Перхлорилфторид получают в основном фторированием перхлораты. Пентафторид сурьмы является широко используемым фторирующим агентом:[2]:372–373
- ClO−
4 + 3 ВЧ + 2 SbF
5 → ClO
3F + ЧАС
3О+
+ 2 SbF−
6
ClO
3F реагирует с спирты производить алкил перхлораты - взрывчатые вещества, чрезвычайно чувствительные к ударам.[7] В присутствии кислоты Льюиса его можно использовать для введения –ClO
3 группировать в ароматические кольца через электрофильное ароматическое замещение.[8]
Приложения
Перхлорилфторид используется в органической химии в качестве мягкого фторирующего агента.[2]:383 Это был первый промышленно значимый электрофильный фторирующий агент, используемый с 1960-х годов для производства фторированных стероиды.[7] В присутствии трихлорида алюминия он также используется в качестве реагента для электрофильного перхлорилирования ароматических соединений.[9]
Фторид перхлорил исследовался как высокоэффективный жидкое ракетное топливо окислитель.[10] По сравнению с пентафторид хлора и пентафторид брома, он значительно ниже удельный импульс, но не вызывает коррозии резервуаров. Не требует криогенного хранения. Химик ракетного топлива Джон Друри Кларк сообщил в своей книге Зажигание! [11] что перхлорилфторид полностью смешивается с галогеновыми окислителями, такими как трифторид хлора и пентафторид хлора, и такая смесь обеспечивает необходимый кислород для надлежащего сжигания углеродсодержащего топлива.
Его также можно использовать в фотометрия пламени как источник возбуждения.[12]
Безопасность
Фторид перхлорил токсичен, с TLV из 3 промилле.[13] Это сильное раздражающее средство для легких и глаз, способное вызвать ожоги открытых участков кожи. Его IDLH уровень 100 ppm.[14] Симптомы воздействия включают головокружение, головные боли, обморок, и цианоз. Воздействие токсичных уровней вызывает тяжелое воспаление дыхательных путей и отек легких.[10]
Рекомендации
- ^ а б c d Карманный справочник NIOSH по химической опасности. "#0490". Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б c d е Гарри Юлий Эмелеус; А.Г. Шарп (1976). Успехи неорганической химии и радиохимии, Том 18. Академическая пресса. ISBN 0-12-023618-4.
- ^ «Перхлорилфторид». Интернет-книга NIST по химии, SRD 69. 2018.
- ^ а б «Перхлорилфторид». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ Лаборатория химических наук и технологий. «Перхлорилфторид». Национальный институт стандартов и технологий. Получено 2009-11-28.
- ^ а б Джаред Ледгард (2007). Подготовительное руководство по взрывчатым веществам (3-е изд.). Lulu.com. п. 77. ISBN 978-0-615-14290-6.
- ^ а б Пер Кирш (2004). Современная фторорганическая химия: синтез, реакционная способность, применение. Wiley-VCH. п. 74. ISBN 3-527-30691-9.
- ^ Питер Бернар Давид Де ла Маре (1976). Электрофильное галогенирование: пути реакций, включающие атаку электрофильных галогенов на непредельные соединения. КУБОК Архив. п. 63. ISBN 0-521-29014-7.
- ^ Inman, C.E .; Oesterling, R.E .; Tyczkowski, E. A. (1958-10-01). «Реакции перхлорилфторида с органическими соединениями. I. Перхлорилирование ароматических соединений1». Журнал Американского химического общества. 80 (19): 5286–5288. Дои:10.1021 / ja01552a069. ISSN 0002-7863.
- ^ а б Джон Берк Салливан; Гэри Р. Кригер (2001). Клиническое состояние окружающей среды и токсическое воздействие (2-е изд.). Липпинкотт Уильямс и Уилкинс. п. 969. ISBN 0-683-08027-X.
- ^ https://library.sciencemadness.org/library/books/ignition.pdf
- ^ Schmauch, G.E .; Серфасс, Э. Дж. (1958). «Использование перхлорилфторида в пламенной фотометрии». Прикладная спектроскопия. 12 (3): 98–102. Bibcode:1958ApSpe..12 ... 98S. Дои:10.1366/000370258774615483.
- ^ Национальный институт охраны труда и здоровья. "Карманный справочник NIOSH по химической опасности". Центры по контролю и профилактике заболеваний. Получено 2013-10-31.
- ^ Национальный институт охраны труда и здоровья. «Документация по концентрациям, непосредственно опасным для жизни или здоровья (IDLH)». Центры по контролю и профилактике заболеваний. Получено 2013-10-31.