SCARB2 - SCARB2
Лизосомный интегральный мембранный белок 2 (LIMP-2) это белок что у людей кодируется SCARB2 ген.[5] LIMP-2 выражается в мозг, сердце, печень, легкое и почка, в основном в мембране лизосома органеллы; однако в сердечная мышца, LIMP-2 также экспрессируется вставные диски. ЛИМП-2 в мембране белок в лизосомы который функционирует, чтобы регулировать лизосомный /эндосомный транспорт. Было показано, что мутации в LIMP-2 вызывают Болезнь Гоше, миоклоническая эпилепсия, и действие миоклонуса почечная недостаточность синдром. Аномальные уровни LIMP-2 были также обнаружены у пациентов с гипертрофическая кардиомиопатия.
Структура
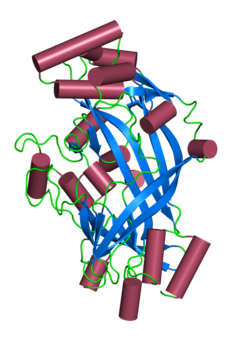
Человеческий LIMP-2 имеет теоретическую молекулярную массу 54,3 кДа и составляет 478 аминокислоты в длину.[6]
Хотя LIMP-2 был первоначально открыт в 1985 году Lewis et al. из печени крысы лизосомы,[7] LIMP-2 был клонирован в 1992 году двумя группами, одна из которых изолировала LIMP-2 от человека. метастатический панкреатический островок опухолевые клетки и одна крыса печень лизосомный мембраны.[8][9] LIMP-2 был выделен как белок с приблизительной молекулярной массой 85 кДа, синтезированный из предшественника формы примерно 77 кДа. Расхождение по массе между теоретическим (54,3 кДа) и наблюдаемым (85 кДа) связано с наличием 10 высоких манноза -тип N-связанный олигосахарид цепей в человеческой форме этого белка, по сравнению с 11 у мышей и крыс.[10] LIMP-2 имеет две гидрофобные области, одна около N-конец и один рядом с C-конец, а также короткое изолейцин /лейцин -богатые цитоплазматический хвост состоит из 20 аминокислоты что служит лизосомный последовательность нацеливания.[11][12] ЛИМП-2 выражается в мозг, сердце, печень, легкое и почка.[10]
Функция
Белок, кодируемый этим геном, представляет собой гликопротеин типа III, который локализуется в основном в ограничивающих мембранах лизосом и эндосом. Исследования аналогичного белка на мышах и крысах показали, что этот белок может участвовать в мембранном транспорте и реорганизации эндосомального / лизосомного компартмента.[13] В клетках печени крысы LIMP-2 проявлял период полураспада для интернализации и лизосомный транспортировка 32 мин и 2,0 часа соответственно, что напоминало хорошо известные лизосомный белки, лампа-1 и лампа-2 хотя и разные аминокислота последовательности в их цитоплазматический хвосты.[14]
LIMP2 недавно был определен как новый компонент вставные диски в сердечная мышца. Вставные диски состоят из щелевые соединения, прилипает к стыкам и десмосомы, и имеют решающее значение для механического и электрического соединения соседних кардиомиоциты. Открытие LIMP-2 как компонента этого комплекса произошло в результате генетического скрининга гомозигот, гипертоник трансгенный крыса модель ренин сверхэкспрессия, при которой популяция этих крыс быстро развивается сердечная недостаточность а другой остается получателем компенсации.[15] Из 143 дифференциально регулируемых генов было выявлено, что LIMP-2 имеет значительную активацию в сердечная недостаточность склонная крыса сердечная мышца биопсии, что также подтвердилось у человека сердечная недостаточность. Дальнейший анализ с использованием мыши с нокаутом LIMP-2 показал, что животные, лишенные LIMP-2, не могут летать в нормальном режиме. гипертрофический ответ после Ангиотензин II лечения, однако у них развились интерстициальные фиброз и дилатационная кардиомиопатия координировать с нарушенным вставной диск структура. Биохимические и иммуногистохимический анализы обнаружили, что ЛИМП-2 взаимодействует с участием N-кадгерин в вставные диски, функция вне лизосомный мембраны. Разборка ЛИМП-2 с РНК-интерференция уменьшил связывание N-кадгерин к фосфорилированный форма бета-катенин, а сверхэкспрессия LIMP-2 имела обратный эффект.[16]
LIMP-2 играет и другие роли в других органах. Характеристика трубчатая протеинурия у мышей с нокаутом LIMP-2 было показано, что это связано с неспособностью лизосомный /эндосомный слияния, таким образом, белки, реабсорбированные в проксимальном канальце почек, не подвергаются протеолизу должным образом, вызывая протеинурия.[17] Сообщалось также, что дефицит LIMP-2 у мышей нарушает процессы транспорта через клеточную мембрану и вызывает обструкцию тазового перехода, глухоту и периферическую невропатию.[18]
Клиническое значение
У пациентов с гипертрофическая кардиомиопатия из-за стеноз аорты, SCARB2 мРНК значительно активирована, что позволяет предположить, что LIMP-2 может действовать как гипертрофический маркер.[16]
Мутации в SCARB2 было показано, что они вызывают миоклонию почечная недостаточность синдром, редкий синдром, характеризующийся прогрессирующим неврологическим заболеванием и связанный с протеинурия, почечная недостаточность, и Фокальный сегментарный гломерулосклероз.[19][20][21]
Мутации в SCARB2 также было показано, что они вызывают Болезнь Гоше и миоклоническая эпилепсия,[22] поскольку LIMP-2 важен для правильной сортировки и таргетинга глюкоцереброзидаза фермент (фермент с дефицитом Болезнь Гоше ) к лизосомы.
SCARB2 является рецептором двух вирусов, вызывающих болезнь рук, ног и рта у детей, Энтеровирус 71 и Coxsackievirus A16.[23]
Взаимодействия
LIMP-2 показал себя взаимодействовать с участием:
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000138760 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000029426 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ген Entrez: рецептор скавенджера SCARB2 класса B, член 2».
- ^ «Белковая последовательность человеческого SCARB2 (Uniprot ID: Q14108)». Атлас кардиоорганических белков (COPaKB). Получено 14 июля 2015.
- ^ Льюис В., Грин С.А., Марш М., Вихко П., Хелениус А., Меллман И. (июнь 1985 г.). «Гликопротеины лизосомальной мембраны». Журнал клеточной биологии. 100 (6): 1839–47. Дои:10.1083 / jcb.100.6.1839. ЧВК 2113609. PMID 3922993.
- ^ Fujita H, Takata Y, Kono A, Tanaka Y, Takahashi T., Himeno M, Kato K (апрель 1992 г.). «Выделение и секвенирование клона кДНК, кодирующего лизосомный сиалогликопротеин человека массой 85 кДа (hLGP85) в клетках метастатической опухоли островков поджелудочной железы человека». Сообщения о биохимических и биофизических исследованиях. 184 (2): 604–11. Дои:10.1016 / 0006-291Х (92) 90632-У. PMID 1374238.
- ^ Акасаки К., Киношита Х., Фукудзава М., Маэда М., Ямагути Ю., Фуруно К., Цудзи Х. (январь 1992 г.). «Выделение и характеристика нового мембранного гликопротеина с молекулярной массой 85000 из лизосом печени крысы». Химико-фармацевтический бюллетень. 40 (1): 170–3. Дои:10.1248 / cpb.40.170. PMID 1576668.
- ^ а б Табучи Н., Акасаки К., Сасаки Т., Канда Н., Цудзи Н. (октябрь 1997 г.). «Идентификация и характеристика основного гликопротеина лизосомальной мембраны, LGP85 / LIMP II в печени мышей». Журнал биохимии. 122 (4): 756–63. Дои:10.1093 / oxfordjournals.jbchem.a021820. PMID 9399579.
- ^ Огата С., Фукуда М. (февраль 1994 г.). «Лизосомное нацеливание на мембранный гликопротеин Limp II требует нового мотива Leu-Ile в конкретном положении в его цитоплазматическом хвосте». Журнал биологической химии. 269 (7): 5210–7. PMID 8106503.
- ^ Сандовал И. В., Арредондо Дж. Дж., Алькальде Дж., Гонсалес Норьега А., Вандекеркхов Дж., Хименес М. А., Рико М. (март 1994 г.). «Остатки Leu (Ile) 475-Ile (Leu, Val, Ala) 476, содержащиеся в удлиненном карбоксильном цитоплазматическом хвосте, имеют решающее значение для нацеливания резидентного белка лизосомальной мембраны LIMP II на лизосомы». Журнал биологической химии. 269 (9): 6622–31. PMID 7509809.
- ^ Гонсалес А., Валейрас М., Сидранский Е., Тайеби Н. (февраль 2014 г.). «Интегральный лизосомный мембранный белок-2: новый игрок в патологии, связанной с лизосомами». Молекулярная генетика и метаболизм. 111 (2): 84–91. Дои:10.1016 / j.ymgme.2013.12.005. ЧВК 3924958. PMID 24389070.
- ^ Акасаки К., Мичихара А., Фукудзава М., Киношита Х., Цудзи Х. (сентябрь 1994 г.). «Цикл гликопротеина лизосомной мембраны 85 кДа между поверхностью клетки и лизосомами в культивируемых гепатоцитах крысы». Журнал биохимии. 116 (3): 670–6. PMID 7852289.
- ^ Schroen B, Heymans S, Sharma U, Blankesteijn WM, Pokharel S, Cleutjens JP, Porter JG, Evelo CT, Duisters R, van Leeuwen RE, Janssen BJ, Debets JJ, Smits JF, Daemen MJ, Crijns HJ, Bornstein P, Pinto YM (сентябрь 2004 г.). «Тромбоспондин-2 необходим для целостности матрикса миокарда: повышенная экспрессия указывает на склонность к сердечной гипертрофии». Циркуляционные исследования. 95 (5): 515–22. Дои:10.1161 / 01.RES.0000141019.20332.3e. PMID 15284191.
- ^ а б c Schroen B, Leenders JJ, van Erk A, Bertrand AT, van Loon M, van Leeuwen RE, Kubben N, Duisters RF, Schellings MW, Janssen BJ, Debets JJ, Schwake M, Høydal MA, Heymans S, Saftig P, Pinto YM (Май 2007 г.). «Интегральный белок лизосомной мембраны 2 является новым компонентом интеркалированного диска сердца и жизненно важен для вызванной нагрузкой гипертрофии сердечных миоцитов». Журнал экспериментальной медицины. 204 (5): 1227–35. Дои:10.1084 / jem.20070145. ЧВК 2118572. PMID 17485520.
- ^ Десмонд MJ, Ли Д., Фрейзер С.А., Катерелос М., Глейх К., Мартинелло П., Ли Ю.К., Томас М.К., Мичелуччи Р., Коул А.Дж., Сафтиг П., Швак М., Стэплтон Д., Беркович С.Ф., Power DA (июнь 2011 г.) «Тубулярная протеинурия у мышей и людей, лишенных внутреннего лизосомного белка SCARB2 / Limp-2». Американский журнал физиологии. Почечная физиология. 300 (6): F1437–47. Дои:10.1152 / айпренал.00015.2011. PMID 21429972. S2CID 25993341.
- ^ Gamp AC, Tanaka Y, Lüllmann-Rauch R, Wittke D, D'Hooge R, De Deyn PP, Moser T., Maier H, Hartmann D, Reiss K, Illert AL, von Figura K, Saftig P (март 2003 г.). «Дефицит LIMP-2 / LGP85 вызывает обструкцию тазового перехода мочеточника, глухоту и периферическую невропатию у мышей». Молекулярная генетика человека. 12 (6): 631–46. Дои:10.1093 / hmg / ddg062. PMID 12620969.
- ^ Балрейра А., Гаспар П., Кайола Д., Чавес Дж., Бейран И., Лима Дж. Л., Азеведо Дж. Э., Миранда М.С. (июль 2008 г.). «Нонсенс-мутация в гене LIMP-2, связанная с прогрессирующей миоклонической эпилепсией и нефротическим синдромом». Молекулярная генетика человека. 17 (14): 2238–43. Дои:10.1093 / hmg / ddn124. PMID 18424452.
- ^ Беркович С.Ф., Диббенс Л.М., Ошлак А., Сильвер Д.Д., Катерелос М., Вирс Д.Ф., Люллманн-Раух Р., Бланц Дж., Чжан К.В., Станкович Дж., Калнинс Р.М., Даулинг Д.П., Андерманн Е., Андерманн Ф., Фалдини Е. Р., Вадламуди Л., Макдонелл Р.А., Ходжсон Б.Л., Бейли М.А., Савиг Дж., Малли Дж. К., Смит Г.К., Пауэр Д.А., Сафтиг П., Бахло М. (март 2008 г.). «Открытие генов на основе массива с тремя неродственными субъектами показывает, что дефицит SCARB2 / LIMP-2 вызывает миоклоническую эпилепсию и гломерулосклероз». Американский журнал генетики человека. 82 (3): 673–84. Дои:10.1016 / j.ajhg.2007.12.019. ЧВК 2427287. PMID 18308289.
- ^ Hopfner F, Schormair B, Knauf F, Berthele A, Tölle TR, Baron R, Maier C, Treede RD, Binder A, Sommer C, Maihöfner C, Kunz W, Zimprich F, Heemann U, Pfeufer A, Näbauer M, Kääb S , Новак Б., Гигер С., Лихтнер П., Тренквальдер С., Оексле К., Винкельманн Дж. (27 октября 2011 г.). «Новая мутация SCARB2 в действии синдрома миоклонус-почечной недостаточности и оценка мутаций SCARB2 в отдельных функциях AMRF». BMC Neurology. 11: 134. Дои:10.1186/1471-2377-11-134. ЧВК 3222607. PMID 22032306.
- ^ Велаяти А., ДеПаоло Дж., Гупта Н., Чой Дж. Х., Моавен Н., Вестбрук В., Гокер-Альпан О., Голдин Е., Стаблфилд Б. К., Колодный Е., Тайеби Н., Сидранский Е. (ноябрь 2011 г.). «Мутация в SCARB2 является модификатором болезни Гоше». Человеческая мутация. 32 (11): 1232–8. Дои:10.1002 / humu.21566. ЧВК 3196787. PMID 21796727.
- ^ Ямаёси С., Ямасита Ю., Ли Дж., Ханагата Н., Минова Т., Такемура Т., Койке С. (июль 2009 г.). «Рецептор скавенджера B2 представляет собой клеточный рецептор энтеровируса 71». Природа Медицина. 15 (7): 798–801. Дои:10.1038 / нм.1992. PMID 19543282. S2CID 9192537.
дальнейшее чтение
- Эскелинен Э.Л., Танака Й., Сафтиг П. (март 2003 г.). «На кислотном краю: новые функции белков лизосомальных мембран». Тенденции в клеточной биологии. 13 (3): 137–45. Дои:10.1016 / S0962-8924 (03) 00005-9. PMID 12628346.
- Сандовал IV, Арредондо Дж., Алькальде Дж., Гонсалес Норьега А., Вандекеркхове Дж., Хименес М. А., Рико М. (март 1994 г.). «Остатки Leu (Ile) 475-Ile (Leu, Val, Ala) 476, содержащиеся в удлиненном карбоксильном цитоплазматическом хвосте, имеют решающее значение для нацеливания резидентного белка лизосомальной мембраны LIMP II на лизосомы». Журнал биологической химии. 269 (9): 6622–31. PMID 7509809.
- Кальво Д., Допазо Дж., Вега МА (январь 1995 г.). «Семейство генов CD36, CLA-1 (CD36L1) и LIMPII (CD36L2): клеточное распределение, хромосомное положение и генетическая эволюция». Геномика. 25 (1): 100–6. Дои:10.1016/0888-7543(95)80114-2. PMID 7539776.
- Кромби Р., Сильверштейн Р. (февраль 1998 г.). «Лизосомный интегральный мембранный белок II связывает тромбоспондин-1. Гомология структурно-функциональных функций с молекулой клеточной адгезии CD36 определяет консервативный мотив распознавания». Журнал биологической химии. 273 (9): 4855–63. Дои:10.1074 / jbc.273.9.4855. PMID 9478926.
- Харрис Р.А., Ян А., Стейн Р.К., Люси К., Брустен Л., Херат А., Парек Р., Уотерфилд, доктор медицины, О'Хара М.Дж., Невилл М.А., Пейдж М.Дж., Звелебил М.Дж. (февраль 2002 г.). «Кластерный анализ обширной базы данных карт экспрессии белка клеточной линии рака груди человека». Протеомика. 2 (2): 212–23. Дои:10.1002 / 1615-9861 (200202) 2: 2 <212 :: AID-PROT212> 3.0.CO; 2-H. PMID 11840567.
- Wistow G, Bernstein SL, Wyatt MK, Fariss RN, Behal A, Touchman JW, Bouffard G, Smith D, Peterson K (июнь 2002 г.). «Анализ экспрессирующей последовательности меток человеческого RPE / сосудистой оболочки для проекта NEIBank: более 6000 неизбыточных транскриптов, новые гены и варианты сплайсинга». Молекулярное зрение. 8: 205–20. PMID 12107410.
- Куронита Т., Эскелинен Э.Л., Фуджита Х., Сафтиг П., Химено М., Танака Ю. (ноябрь 2002 г.). «Роль лизосомального мембранного белка LGP85 в биогенезе и поддержании эндосомальной и лизосомальной морфологии». Журнал клеточной науки. 115 (Pt 21): 4117–31. Дои:10.1242 / jcs.00075. PMID 12356916.
- Родионов Д.Г., Хенинг С., Силье А., Конгсвик Т.Л., фон Фигура К., Бакке О. (декабрь 2002 г.). «Структурные требования для взаимодействия между сигналами сортировки лейцина и клатрин-связанным адаптерным белковым комплексом AP3». Журнал биологической химии. 277 (49): 47436–43. Дои:10.1074 / jbc.M207149200. PMID 12370188.
- Gamp AC, Tanaka Y, Lüllmann-Rauch R, Wittke D, D'Hooge R, De Deyn PP, Moser T., Maier H, Hartmann D, Reiss K, Illert AL, von Figura K, Saftig P (март 2003 г.). «Дефицит LIMP-2 / LGP85 вызывает обструкцию тазового перехода мочеточника, глухоту и периферическую невропатию у мышей». Молекулярная генетика человека. 12 (6): 631–46. Дои:10.1093 / hmg / ddg062. PMID 12620969.
- Чжан Х., Ли XJ, Мартин Д.Б., Эберсолд Р. (июнь 2003 г.). «Идентификация и количественное определение N-связанных гликопротеинов с использованием химии гидразидов, метки стабильных изотопов и масс-спектрометрии». Природа Биотехнологии. 21 (6): 660–6. Дои:10.1038 / nbt827. PMID 12754519. S2CID 581283.
- СП Мулкахи, Ридделл Д.Р., Оуэн Дж.С. (февраль 2004 г.). «Человеческий рецептор-скавенджер класса B типа II (SR-BII) и отток клеточного холестерина». Биохимический журнал. 377 (Пт 3): 741–7. Дои:10.1042 / BJ20030307. ЧВК 1223905. PMID 14570588.
- Eckhardt ER, Cai L, Shetty S, Zhao Z, Szanto A, Webb NR, Van der Westhuyzen DR (февраль 2006 г.). «Эндоцитоз липопротеинов высокой плотности под действием скавенджер-рецептора SR-BII является клатрин-зависимым и требует карбоксиконцевого дилейцинового мотива». Журнал биологической химии. 281 (7): 4348–53. Дои:10.1074 / jbc.M513154200. PMID 16368683.
- Гупта С.Н., Клостер М.М., Родионов Д.Г., Бакке О. (июнь 2006 г.). «Перенаправление инвариантной цепи на прямой путь сортировки путем введения AP3-связывающего мотива из LIMP II». Европейский журнал клеточной биологии. 85 (6): 457–67. Дои:10.1016 / j.ejcb.2006.02.001. PMID 16542748.
- Церенцодол Н, Гордиенко Н.В., Паскуаль И., Ли Дж. У., Флислер С. Дж., Родригес И. Р. (2006). «Интраретинальный транспорт липидов зависит от липопротеиноподобных частиц высокой плотности и рецепторов-поглотителей класса B». Молекулярное зрение. 12: 1319–33. PMID 17110915.
- Grove J, Huby T, Stamataki Z, Vanwolleghem T., Meuleman P, Farquhar M, Schwarz A, Moreau M, Owen JS, Leroux-Roels G, Balfe P, McKeating JA (апрель 2007 г.). «Уровни экспрессии рецептора скавенджера BI и BII модулируют инфекционность вируса гепатита С». Журнал вирусологии. 81 (7): 3162–9. Дои:10.1128 / JVI.02356-06. ЧВК 1866051. PMID 17215280.