Однодоменное антитело - Single-domain antibody

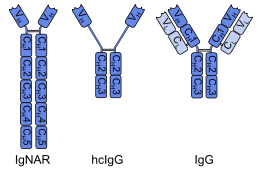
А однодоменное антитело (sdAb), также известный как нанотело, является антитело фрагмент, состоящий из одного мономерный вариабельный домен антитела. Как и целое антитело, оно способно избирательно связываться с определенными антиген. С молекулярной массой всего 12–15 кДа, однодоменные антитела намного меньше обычных антител (150–160 кДа), которые состоят из двух тяжелые белковые цепи и два легкие цепи, и даже меньше, чем Fab фрагменты (~ 50 кДа, одна легкая цепь и половина тяжелой цепи) и одноцепочечные вариабельные фрагменты (~ 25 кДа, два вариабельных домена, один из легкой и один из тяжелой цепи).[1]
Первые однодоменные антитела были созданы из антитела тяжелой цепи нашел в верблюды; они называются VЧАСH фрагменты. Хрящевые рыбы также имеют антитела тяжелой цепи (IgNAR, «рецептор нового антигена иммуноглобулина»), из которых однодоменные антитела называются VНАР фрагменты может быть получен.[2] Альтернативный подход - разделить димерные вариабельные домены из общих иммуноглобулин G (IgG) человека или мышей в мономеры. Хотя большинство исследований однодоменных антител в настоящее время основано на вариабельных доменах тяжелых цепей, также было показано, что нанотела, полученные из легких цепей, специфически связываются с мишенями. эпитопы.[3]
Было показано, что однодоменные антитела верблюдовых так же специфичны, как и обычные антитела, а в некоторых случаях они более устойчивы. Кроме того, они легко выделяются с использованием той же процедуры фагового пэннинга, что и для традиционных антител, что позволяет культивировать их in vitro в больших концентрациях. Благодаря меньшему размеру и одному домену эти антитела легче превращаются в бактериальные клетки для массового производства, что делает их идеальными для исследовательских целей.[4]
Однодоменные антитела исследуются для множества фармацевтических применений и имеют потенциал для использования при лечении острый коронарный синдром, рак и Болезнь Альцгеймера.[5][6]
Характеристики
Однодоменное антитело представляет собой пептид цепочка около 110 аминокислоты длинный, содержащий один вариабельный домен (VЧАС) антитела тяжелой цепи или обычного IgG. Эти пептиды имеют такое же сродство к антигенам, как и целые антитела, но более термостойкие и стабильные по отношению к моющие средства и высокие концентрации мочевина. Антитела верблюдовых и рыб меньше липофильный и больше растворимый в воде из-за их определяющая комплементарность область 3 (CDR3), который образует расширенную петлю (окрашенную в оранжевый цвет на ленточной диаграмме выше), покрывающую липофильный сайт, который обычно связывается с легкой цепью.[7][8] В отличие от обычных антител, два из шести однодоменных антител выжили при температуре 90 ° C (194 ° F), не теряя своей способности связывать антигены в исследовании 1999 года.[9] Устойчивость к Желудочный сок и протеазы зависит от аминокислотной последовательности. Было показано, что некоторые виды активны в кишечник после перорального применения,[10][11] но их низкий поглощение из кишечника препятствует развитию системно активных однодоменных антител, вводимых перорально.

Сравнительно низкий молекулярная масса приводит к лучшей проницаемости в тканях и короткой плазме период полураспада поскольку они устранены почечно.[1] В отличие от целых антител они не проявляют система комплемента запущен цитотоксичность потому что им не хватает Fc регион. SdAb верблюдовых и рыб способны связываться со скрытыми антигенами, недоступными для целых антител, например, с активными сайтами ферменты.[12] Было показано, что это свойство является результатом их расширенной петли CDR3, которая способна проникать в такие скрытые участки.[8][13][12]
Производство
От антител тяжелых цепей
Однодоменное антитело можно получить иммунизацией дромадеры, верблюды, ламы, альпаки или акулы с желаемым антигеном и последующее выделение мРНК кодирование антител тяжелой цепи. Используя метод конструирования библиотеки, основанный на сборке и самолигировании ПЦР-удлинения (EASeL), Митчелл Хо и Мартин Флайник установили большой фаг, отображаемый VНАР библиотека антител размером 1,2 × 1010 от наивных акул-нянек.[14] Такие методы проверки, как фаговый дисплей и рибосомный дисплей помогают идентифицировать клоны, связывающие антиген.[15][14]
От обычных антител
В качестве альтернативы однодоменные антитела могут быть получены из обычных мышиный,[16] кролик[17] или человеческий IgG с четырьмя цепями.[18] Процесс аналогичен, включает библиотеки генов от иммунизированных или наивных доноров и методы отображения для идентификации наиболее специфических антигенов. Проблема с этим подходом заключается в том, что связывающая область обычного IgG состоит из двух доменов (VЧАС и VL), которые стремятся димеризовать или агрегировать из-за их липофильности. Мономеризация обычно осуществляется путем замены липофильных аминокислот гидрофильными, но часто приводит к потере сродства к антигену.[19] Если аффинность может быть сохранена, однодоменные антитела могут также продуцироваться в Кишечная палочка, С. cerevisiae или другие организмы.
Из человеческих однодоменных антител
Люди иногда продуцируют однодоменные антитела путем случайного создания стоп-кодона в легкой цепи. Митчелл Хо и Димитер Димитров из Национального института рака создали человеческие однодоменные антитела, нацеленные на различные опухолевые антигены, включая мезотелин,[20] GPC2[21] и GPC3[22][23] из сконструированной библиотеки фагового дисплея VH-домена человека.[24] Человеческие однодоменные антитела были использованы для создания иммунотоксинов (HN3-PE38, HN3-mPE24, HN3-T20). [23][25][26] и химерные антигенные рецепторы (CAR) Т-клетки[21] для лечения рака. Блокирование Wnt-связывающего домена на GPC3 человеческим однодоменным антителом HN3 ингибирует активацию Wnt в клетках рака печени.[27]
Возможные приложения
Однодоменные антитела позволяют использовать их в широком спектре биотехнических и терапевтических целей благодаря их небольшому размеру, простоте получения и высокой аффинности.[28][29]
Биотехнологические и диагностические
Слияние флуоресцентного белка с нанотелом приводит к так называемой хромотело. Хромотела можно использовать для распознавания и отслеживания мишеней в различных отделах живых клеток. Таким образом, они могут расширить возможности микроскопии живых клеток и сделать возможными новые функциональные исследования.[30] Муфта анти-GFP Нанотело в моновалентной матрице, называемое GFP-нанолапкой, позволяет изолировать слитые с GFP белки и их взаимодействующие партнеры для дальнейших биохимических анализов.[31] Локализация одиночной молекулы с помощью методов визуализации сверхвысокого разрешения требует специальной доставки флуорофоры в непосредственной близости с целевым белком. Из-за их большого размера использование антител, связанных с органическими красителями, часто может приводить к ложному сигналу из-за расстояния между флуорофором и целевым белком. Слияние органических красителей с нанотелами против GFP, нацеленными на GFP-меченые белки, обеспечивает нанометровое пространственное разрешение и минимальную ошибку связывания из-за небольшого размера и высокой аффинности.[32] Деление размера нанотел также дает преимущества корреляционная световая электронная микроскопия изучение. Без какого-либо агента, повышающего проницаемость, цитоплазма химически фиксированных клеток легко доступна для нанотел, меченных флуорофором. Их небольшой размер также позволяет им проникать глубже в объемные образцы, чем обычные антитела. Высокое качество ультраструктуры сохраняется в ткани, которая отображается с помощью флуоресцентного микроскопа, а затем электронного микроскопа. Это особенно полезно для нейробиологических исследований, которые требуют как молекулярной маркировки, так и электронной микроскопии.[33]
В диагностике биосенсор Приложения нанотела могут быть перспективно использованы в качестве инструмента. Благодаря своему небольшому размеру они могут более плотно соединяться с поверхностями биосенсоров. Помимо преимущества в нацеливании на менее доступные эпитопы, их конформационная стабильность также приводит к более высокой устойчивости к условиям регенерации поверхности. После иммобилизации однодоменных антител на сенсорных поверхностях, воспринимающих человека простатоспецифический антиген (hPSA) были протестированы. Нанотела превзошли классические антитела в обнаружении клинически значимых концентраций hPSA.[34]
Чтобы увеличить кристаллизация вероятность целевой молекулы, нанотела могут быть использованы в качестве кристаллизации шапероны. В качестве вспомогательных белков они могут уменьшать конформационную гетерогенность путем связывания и стабилизации только подмножества конформационных состояний. Они также могут маскировать поверхности, мешающие кристаллизации, расширяя области, которые образуют кристаллические контакты.[35][29]
Лечебный

Однодоменные антитела были протестированы как новый терапевтический инструмент против множества мишеней. У мышей, инфицированных вирус гриппа A подтипа H5N1, нанотела, направленные против гемаглютинин подавленная репликация вируса H5N1 in vivo и снижение заболеваемости и смертности.[36] Нанотела, нацеленные на связывающий домен клеточного рецептора факторы вирулентности токсин А и токсин В Clostridium difficile было показано, что нейтрализует цитопатические эффекты в фибробласты in vitro.[37] Конъюгаты нанотел, распознающие антигенпрезентирующие клетки, успешно используются для обнаружения опухолей[38] или направленная доставка антигена для создания сильного иммунного ответа.[39]
Перорально доступные однодоменные антитела против Кишечная палочка-индуцированная диарея у поросят были разработаны и успешно протестированы.[11] Другие болезни желудочно-кишечный тракт, такие как воспалительное заболевание кишечника и рак толстой кишки, также являются возможными мишенями для перорально доступных однодоменных антител.[40]
Стабильные к моющим средствам виды, нацеленные на поверхностный белок Меха Malassezia были разработаны для использования вперхоть шампуни.[7]
Как подход к фототермическая терапия нанотела, связывающиеся с HER2 Антиген, который сверхэкспрессируется в клетках рака груди и яичников, был конъюгирован с разветвленными наночастицами золота (см. рисунок). Опухолевые клетки разрушали фототермически с помощью лазера в тестовой среде.[41]
Каплацизумаб, нацеливание однодоменных антител фактор фон Виллебранда в клинические испытания для предотвращения тромбоз у пациентов с острым коронарным синдромом.[42] А Фаза II исследование, изучающее ALX-0081 в группе высокого риска чрезкожное коронарное вмешательство стартовал в сентябре 2009 года.[43]
Ablynx ожидает, что их нанотела могут пересечь гематоэнцефалический барьер и проникать в большие солидные опухоли легче, чем цельные антитела, что позволило бы разработать лекарства против рак мозга.[40]
Недавно было идентифицировано нанотело, которое прочно связывается с доменом RBD белка шипа бета-коронавирусов (включая CoV-19) и блокирует взаимодействия шипа с клеточным рецептором ACE2. [44]
О применении различных однодоменных антител (нанотел) для профилактики и лечения инфекции, вызываемой различными высокопатогенными коронавирусами человека (CoV), сообщалось снова и снова. Недавно были освещены перспективы, эффективность и проблемы применения нанотел для связывания и нейтрализации SARS-CoV-2 и ему подобных. [45]
Рекомендации
- ^ а б Хармсен М.М., Де Хаард Х.Дж. (ноябрь 2007 г.). «Свойства, производство и применение фрагментов однодоменных антител верблюдовых». Прикладная микробиология и биотехнология. 77 (1): 13–22. Дои:10.1007 / s00253-007-1142-2. ЧВК 2039825. PMID 17704915.
- ^ Английский H, Hong J, Ho M (январь 2020 г.). «Последовательности однодоменных антител NAR, фаговые библиотеки и потенциальные клинические применения». Антитела терапия. 3 (1): 1–9. Дои:10.1093 / abt / tbaa001. ЧВК 7034638. PMID 32118195.
- ^ Мёллер А., Пион Э., Нараян В., Болл К.Л. (декабрь 2010 г.). «Внутриклеточная активация регуляторного фактора интерферона-1 нанотелами в многофункциональный (Mf1) домен». Журнал биологической химии. 285 (49): 38348–61. Дои:10.1074 / jbc.M110.149476. ЧВК 2992268. PMID 20817723.
- ^ Ганнам А., Кумари С., Мюлдерманс С., Аббади А.К. (март 2015 г.). «Нанотела верблюдов с высоким сродством к вирусу крапчатости бобов: возможное многообещающее средство иммуномодуляции устойчивости растений к вирусам». Молекулярная биология растений. 87 (4–5): 355–69. Дои:10.1007 / s11103-015-0282-5. PMID 25648551.
- ^ «Нанотела открывают новую эру в лечении рака». Медицинские новости. 12 мая 2004 г.
- ^ "Трубопровод". Ablynx. Получено 20 января 2010.
- ^ а б Долк Э., ван дер Ваарт М., Лютье Хульсик Д., Вринд Г., де Хаард Х., Спинелли С. и др. (Январь 2005 г.). «Выделение фрагментов антител ламы для предотвращения перхоти с помощью фагового дисплея в шампуне». Прикладная и экологическая микробиология. 71 (1): 442–50. Дои:10.1128 / AEM.71.1.442-450.2005. ЧВК 544197. PMID 15640220.
- ^ а б Стэнфилд Р.Л., Дули Х., Флайник М.Ф., Уилсон И.А. (сентябрь 2004 г.). «Кристаллическая структура V-области однодоменного антитела акулы в комплексе с лизоцимом». Наука. 305 (5691): 1770–3. Bibcode:2004Научный ... 305.1770S. Дои:10.1126 / science.1101148. PMID 15319492.
- ^ ван дер Линден Р. Х., Френкен Л. Г., де Геус Б., Хармсен М. М., Руулс Р. К., Сток В. и др. (Апрель 1999 г.). «Сравнение физико-химических свойств фрагментов антител VHH ламы и моноклональных антител мыши». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 1431 (1): 37–46. Дои:10.1016 / S0167-4838 (99) 00030-8. PMID 10209277.
- ^ Harmsen MM, van Solt CB, Hoogendoorn A, van Zijderveld FG, Niewold TA, van der Meulen J (ноябрь 2005 г.). «Фрагменты однодоменных антител ламы, специфичные к фимбриям Escherichia coli F4, эффективно ингибируют бактериальную адгезию in vitro, но плохо защищают от диареи». Ветеринарная микробиология. 111 (1–2): 89–98. Дои:10.1016 / j.vetmic.2005.09.005. PMID 16221532.
- ^ а б Harmsen MM, van Solt CB, van Zijderveld-van Bemmel AM, Niewold TA, van Zijderveld FG (сентябрь 2006 г.). «Выбор и оптимизация протеолитически стабильных фрагментов однодоменных антител ламы для пероральной иммунотерапии». Прикладная микробиология и биотехнология. 72 (3): 544–51. Дои:10.1007 / s00253-005-0300-7. PMID 16450109.
- ^ а б c Хо М (июнь 2018). "Первая редакционная статья: В поисках волшебных пуль". Антитела терапия. 1 (1): 1–5. Дои:10.1093 / abt / tby001. ЧВК 6086361. PMID 30101214.
- ^ Desmyter A, Transue TR, Ghahroudi MA, Thi MH, Poortmans F, Hamers R и др. (Сентябрь 1996 г.). «Кристаллическая структура фрагмента однодоменного VH антитела верблюда в комплексе с лизоцимом». Структурная биология природы. 3 (9): 803–11. Дои:10.1038 / nsb0996-803. PMID 8784355.
- ^ а б Feng M, Bian H, Wu X, Fu T, Fu Y, Hong J и др. (Январь 2019). «Библиотека однодоменных антител NAR от шести наивных акул-нянек». Антитела терапия. 2 (1): 1–11. Дои:10.1093 / abt / tby011. ЧВК 6312525. PMID 30627698.
- ^ Арбаби Гахруди М., Десмитер А., Винс Л., Хамерс Р., Мюлдерманс С. (сентябрь 1997 г.). «Выбор и идентификация однодоменных фрагментов антител из антител к тяжелой цепи верблюда». Письма FEBS. 414 (3): 521–6. Дои:10.1016 / S0014-5793 (97) 01062-4. PMID 9323027.
- ^ Ward ES, Güssow D, Griffiths AD, Jones PT, Winter G (октябрь 1989 г.). «Связывающая активность репертуара отдельных вариабельных доменов иммуноглобулинов, секретируемых Escherichia coli». Природа. 341 (6242): 544–6. Bibcode:1989Натура.341..544Вт. Дои:10.1038 / 341544a0. PMID 2677748.
- ^ Фэн Р., Ван Р., Хун Дж., Дауэр К.М., Круа Б.С., Хо М. (январь 2020 г.). «Выделение кроличьих однодоменных антител к B7-H3 с помощью белковой иммунизации и фагового дисплея». Антитела терапия. 3 (1): 10–17. Дои:10.1093 / abt / tbaa002. ЧВК 7052794. PMID 32166218.
- ^ Холт Л.Дж., Херринг С., Джесперс Л.С., Woolven BP, Томлинсон И.М. (ноябрь 2003 г.). «Доменные антитела: белки для терапии». Тенденции в биотехнологии. 21 (11): 484–90. Дои:10.1016 / j.tibtech.2003.08.007. PMID 14573361.
- ^ Borrebaeck CA, Ohlin M (декабрь 2002 г.). «Эволюция антител за пределами природы». Природа Биотехнологии. 20 (12): 1189–90. Дои:10.1038 / nbt1202-1189. PMID 12454662.
- ^ Тан З., Фенг М., Гао В., Фунг Й., Чен В., Чаудхари А. и др. (Апрель 2013). «Человеческое однодоменное антитело проявляет сильную противоопухолевую активность за счет нацеливания на эпитоп в мезотелине вблизи поверхности раковой клетки». Молекулярная терапия рака. 12 (4): 416–26. Дои:10.1158 / 1535-7163.MCT-12-0731. ЧВК 3624043. PMID 23371858.
- ^ а б Ли Н, Фу Х, Хьюитт С.М., Димитров Д.С., Хо М. (август 2017 г.). «Терапевтическое нацеливание на глипикан-2 через химерные антигенные рецепторы на основе однодоменных антител и иммунотоксины в нейробластоме». Труды Национальной академии наук Соединенных Штатов Америки. 114 (32): E6623 – E6631. Дои:10.1073 / pnas.1706055114. ЧВК 5559039. PMID 28739923.
- ^ Фэн М., Гао В., Ван Р., Чен В., Ман Ю. Г., Фигг В. Д. и др. (Март 2013 г.). «Терапевтическое воздействие на глипикан-3 через конформационно-специфическое однодоменное антитело при гепатоцеллюлярной карциноме». Труды Национальной академии наук Соединенных Штатов Америки. 110 (12): E1083-91. Bibcode:2013PNAS..110E1083F. Дои:10.1073 / pnas.1217868110. ЧВК 3607002. PMID 23471984.
- ^ а б Гао В., Тан З., Чжан Ю.Ф., Фэн М., Цянь М., Димитров Д.С., Хо М. (март 2015 г.). «Иммунотоксин, нацеленный на глипикан-3, регрессирует рак печени посредством двойного ингибирования передачи сигналов Wnt и синтеза белка». Nature Communications. 6: 6536. Bibcode:2015 НатКо ... 6,6536 г. Дои:10.1038 / ncomms7536. ЧВК 4357278. PMID 25758784.
- ^ Чен В., Чжу З., Фэн И, Сяо Х, Димитров Д.С. (октябрь 2008 г.). «Создание большой библиотеки доменов человеческого антитела, отображаемой на фаге, с каркасом на основе недавно идентифицированного высокорастворимого стабильного вариабельного домена тяжелой цепи». Журнал молекулярной биологии. 382 (3): 779–89. Дои:10.1016 / j.jmb.2008.07.054. ЧВК 2551765. PMID 18687338.
- ^ Ван С., Гао В., Фэн М., Пастан И., Хо М. (май 2017 г.). «Создание иммунотоксина HN3-mPE24, нацеленного на глипикан-3 для лечения рака печени». Oncotarget. 8 (20): 32450–32460. Дои:10.18632 / oncotarget.10592. ЧВК 5464801. PMID 27419635.
- ^ Fleming BD, Urban DJ, Hall M, Longerich T, Greten T, Pastan I, Ho M (сентябрь 2019 г.). «Сконструированный иммунотоксин против GPC3, HN3-ABD-T20, вызывает регрессию в ксенотрансплантатах рака печени мышей за счет длительного удержания сыворотки». Гепатология. 71 (5): 1696–1711. Дои:10.1002 / hep.30949. ЧВК 7069773. PMID 31520528.
- ^ Ли Н, Вэй Л., Лю Х, Бай Х, Йе И, Ли Д. и др. (Октябрь 2019 г.). "Frizzled-like богатый цистеином домен в Glypican-3 опосредует связывание Wnt и регулирует рост опухоли гепатоцеллюлярной карциномы у мышей". Гепатология. 70 (4): 1231–1245. Дои:10.1002 / hep.30646. ЧВК 6783318. PMID 30963603.
- ^ Muyldermans S (2013). «Нанотела: природные однодоменные антитела». Ежегодный обзор биохимии. 82: 775–97. Дои:10.1146 / annurev-biochem-063011-092449. PMID 23495938.
- ^ а б Гулати С., Джин Х., Масухо И., Орбан Т., Цай Й., Простите Э. и др. (Май 2018). «Нацеливание на передачу сигналов рецептора, связанного с G-белком, на уровне G-белка с помощью селективного ингибитора нанотел». Nature Communications. 9 (1): 1996. Bibcode:2018НатКо ... 9.1996G. Дои:10.1038 / s41467-018-04432-0. ЧВК 5959942. PMID 29777099.
- ^ Rothbauer U, Zolghadr K, Tillib S, Nowak D, Schermelleh L, Gahl A и др. (Ноябрь 2006 г.). «Нацеливание и отслеживание антигенов в живых клетках с помощью флуоресцентных нанотел». Природные методы. 3 (11): 887–9. Дои:10.1038 / nmeth953. PMID 17060912.
- ^ Rothbauer U, Zolghadr K, Muyldermans S, Schepers A, Cardoso MC, Leonhardt H (февраль 2008 г.). «Универсальная наноловушка для биохимических и функциональных исследований с флуоресцентными гибридными белками». Молекулярная и клеточная протеомика. 7 (2): 282–9. Дои:10.1074 / mcp.M700342-MCP200. PMID 17951627.
- ^ Рис Дж., Каплан С., Платонова Э., Эглиди Х., Эверс Х. (июнь 2012 г.). «Простой и универсальный метод микроскопии сверхвысокого разрешения на основе GFP с использованием нанотел». Природные методы. 9 (6): 582–4. Дои:10.1038 / nmeth.1991. PMID 22543348.
- ^ Fang T, Lu X, Berger D, Gmeiner C, Cho J, Schalek R, et al. (Декабрь 2018 г.). «Иммуноокрашивание нанотел для коррелированной световой и электронной микроскопии с сохранением ультраструктуры». Природные методы. 15 (12): 1029–1032. Дои:10.1038 / с41592-018-0177-х. ЧВК 6405223. PMID 30397326.
- ^ Saerens D, Frederix F, Reekmans G, Conrath K, Jans K, Brys L, et al. (Декабрь 2005 г.). «Разработка однодоменных антител верблюда и химия иммобилизации для определения специфического антигена простаты человека». Аналитическая химия. 77 (23): 7547–55. Дои:10.1021 / ac051092j. PMID 16316161.
- ^ Koide S (август 2009 г.). «Инженерия рекомбинантных кристаллизационных шаперонов». Текущее мнение в структурной биологии. 19 (4): 449–57. Дои:10.1016 / j.sbi.2009.04.008. ЧВК 2736338. PMID 19477632.
- ^ Ибаньес Л.И., Де Филетт М., Хултберг А., Веррипс Т., Темпертон Н., Вайс Р.А. и др. (Апрель 2011 г.). «Нанотела с нейтрализующей активностью in vitro защищают мышей от инфекции вирусом гриппа H5N1». Журнал инфекционных болезней. 203 (8): 1063–72. Дои:10.1093 / infdis / jiq168. PMID 21450996.
- ^ Hussack G, Arbabi-Ghahroudi M, van Faassen H, Songer JG, Ng KK, MacKenzie R, Tanha J (март 2011 г.). «Нейтрализация токсина A Clostridium difficile с помощью однодоменных антител, направленных на связывающий домен клеточного рецептора». Журнал биологической химии. 286 (11): 8961–76. Дои:10.1074 / jbc.M110.198754. ЧВК 3058971. PMID 21216961.
- ^ Fang T, Duarte JN, Ling J, Li Z, Guzman JS, Ploegh HL (февраль 2016 г.). «Структурно определенные конъюгаты нанотело-лекарственное средство αMHC-II: терапевтическая и визуализирующая система для В-клеточной лимфомы». Angewandte Chemie. 55 (7): 2416–20. Дои:10.1002 / anie.201509432. ЧВК 4820396. PMID 26840214.
- ^ Fang T, Van Elssen CH, Duarte JN, Guzman JS, Chahal JS, Ling J, Ploegh HL (август 2017 г.). «Нацеленная доставка антигена с помощью VHH MHC класса II вызывает сфокусированный иммунитет против αMUC1 (Tn)». Химическая наука. 8 (8): 5591–5597. Дои:10.1039 / c7sc00446j. ЧВК 5618788. PMID 28970938.
- ^ а б «Нанотела». Nanobody.org. 2006 г.
- ^ Ван де Брук Б., Девугдт Н., Д'Холландер А., Гийс Х.Л., Янс К., Лагае Л. и др. (Июнь 2011 г.). «Специфическое нацеливание на клетки с наночастицами, конъюгированными с разветвленными наночастицами золота для фототермической терапии». САУ Нано. 5 (6): 4319–28. Дои:10.1021 / nn1023363. PMID 21609027.
- ^ «Ablynx объявляет о промежуточных результатах первого исследования фазы I нанотел, ALX-0081 (ANTI-VWF)». Bio-Medicine.org. 2 июля 2007 г.
- ^ Номер клинического исследования NCT01020383 для «Сравнительного исследования ALX-0081 по сравнению с ингибитором GPIIb / IIIa у пациентов с высоким риском чрескожного коронарного вмешательства (ЧКВ)» в ClinicalTrials.gov
- ^ Рэпп, Маклеллан. «Структурная основа для мощной нейтрализации бетакоронавирусов однодоменными антителами верблюдовых». Клетка. Дои:10.1016 / j.cell.2020.04.031.
- ^ Конвар, Роктотпал (23 июня 2020 г.). «Нанотела: перспективы расширения гаммы нейтрализующих антител против нового коронавируса SARS-CoV-2». Границы иммунологии. Дои:10.3389 / fimmu.2020.01531.

