Синтаза тетрагидроканнабиноловой кислоты - Tetrahydrocannabinolic acid synthase
| Синтаза тетрагидроканнибиноловой кислоты | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 3VTE | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.21.3.7 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Синтаза тетрагидроканнабиноловой кислоты (THCA) (полное имя Δ1-тетрагидроканнабиноловая кислота синтаза) является фермент ответственный за катализирующий формирование THCA из каннабигероловая кислота (CBGA). THCA - это прямой предшественник из тетрагидроканнабинол (THC), главный психоактивный компонент каннабис, который производится из различных штаммов Каннабис сатива. Таким образом, THCA-синтаза считается ключевым ферментом, контролирующим психоактивность каннабиса.[1] Полиморфизм THCA-синтазы приводит к различным уровням THC в растениях каннабиса, что приводит к "наркотического типа" и «волокнистый» C. sativa разновидности.[2][3]
Структура
Синтаза THCA - это 60 кДа (~ 500 аминокислот) мономерный фермент с изоэлектрическая точка в 6.4.[4] Пост-трансляционный N-связанное гликозилирование увеличивает общую массу примерно до 74 кДа. В третичная структура делится на две области (области I и II), с флавинадениндинуклеотид (FAD) расположен между двумя доменами. Домен I состоит из восьми альфа спирали и восемь бета-лист и ковалентно связан с FAD. Домен II состоит из пяти альфа-спиралей, окруженных восемью бета-листами. Ферменты, имеющие сходные аминокислотные последовательности, включают: флавопротеины фермент берберинового мостика (BBE), глюкоолигосахаридоксидаза (GOOX) и аклациномицин оксидоредуктаза (AknOx).[1]
Фрагмент FAD является местом ферментативной активности и ковалентно связан с His114 и Cys176. FAD также связан водородные связи с соседними аминокислотными основными цепями и боковыми цепями. Совместная кристаллизация THCA-синтазы с субстратом или продуктом еще не завершена.[1]
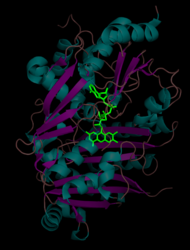
Кофактор FAD (выделен зеленым) расположен между доменом I и доменом II THCA-синтазы. Альфа-спирали имеют голубой цвет, а бета-листы - пурпурный.
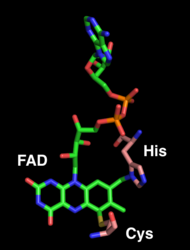
FAD (зеленый) ковалентно связан с гистидином 114 и цистеином 176 (розовый).
Механизм реакции

THCA-синтаза, а флавопротеин, использует флавинадениндинуклеотид (FAD) кофактор к катализировать то окислительный циклизация из монотерпен часть каннабигероловой кислоты (CBGA). Подобные реакции циклизации происходят при биосинтезе монотерпена из геранилпирофосфат, но не окислительны.[5] THCA-синтаза не проявляет каталитической активности против каннабигерол, в котором отсутствует карбоксил группу по сравнению с CBGA, предполагая, что карбоксильная группа CBGA необходима для протекания реакции.[1]
Общая химическая реакция: CBGA + O2 THCA + H2О2

Гидрид переносится из CBGA для уменьшения FAD, согласованного депротонирование из гидроксил группу остатком тирозина. Затем монотерпеновый фрагмент в CBGA помещается для завершения циклизации в THCA. Окисление восстановленного ФАД O2 производит перекись водорода (H2О2).[6][1]

Биологическая функция
THCA-синтаза экспрессируется в железистой трихомы из Каннабис сатива. Синтаза THCA может способствовать самооборона из Каннабис растения, производящие THCA и пероксид водорода, которые оба цитотоксический. Поскольку эти продукты токсичны для растений, THCA-синтаза секретируется в полость хранения трихома.[7] THCA также действует как фактор, вызывающий некроз, открывая митохондриальная проницаемость переходные поры, подавляя жизнеспособность митохондрий и приводя к старению тканей листа.[8]
Неферментативный декарбоксилирование THCA при хранении или в курительных формах THC, основной психоактивный компонент каннабиса.[9] Дальнейшая деградация под воздействием температуры, автоокисления и света приводит к образованию каннабинола.[10] THC и другие каннабиноиды хорошо известно, что они уменьшают тошноту и рвоту и стимулируют чувство голода, особенно у пациентов, проходящих химиотерапия рака.[11]
Ферменты, подобные THCA-синтазе, катализируют образование других каннабиноидов. Например, синтаза каннабидиоловой кислоты (CBDA) представляет собой флавопротеин, который катализирует аналогичную окислительную циклизацию CPGA в CBDA, доминирующий каннабиноидный компонент волокнистый C. sativa. CBDA подвергается аналогичному декарбоксилированию с образованием каннабидиол.[12]
Значимость
Спрос на ТГК фармацевтического качества и другие каннабиноиды высок из-за интереса к их потенциальное терапевтическое использование, но заблокирован правовыми нормами C. sativa выращивание во многих странах.[13] Прямой химический синтез ТГК сложно из-за высокой стоимости и низкой урожайности.[14] Таким образом, было изучено использование THCA-синтазы для производства THC, поскольку CBGA легко синтезировать, а THCA легко декарбоксилатируется с образованием THC.[10] Биосинтез THCA путем экспрессии THCA-синтазы в организмах предпринимались с ограниченным успехом у бактерий, насекомых и растений табака. Производство THCA в миллиграммах было продемонстрировано в Pichia pastoris дрожжевые клетки в двух независимых исследованиях.[15][13]
Рекомендации
- ^ а б c d е Сояма Ю., Тамада Т., Курихара К., Такеучи А., Таура Ф, Араи С., Блабер М., Сояма И., Моримото С., Куроки Р. (октябрь 2012 г.). «Структура и функция ∆1-тетрагидроканнабиноловой кислоты (THCA) синтазы, фермента, контролирующего психоактивность Cannabis sativa». Журнал молекулярной биологии. 423 (1): 96–105. Дои:10.1016 / j.jmb.2012.06.030. PMID 22766313.
- ^ Staginnus C, Zörntlein S, de Meijer E (июль 2014 г.). «Маркер ПЦР, связанный с полиморфизмом THCA-синтазы, является надежным инструментом для распознавания потенциально богатых ТГК растений Cannabis sativa L». Журнал судебной медицины. 59 (4): 919–26. Дои:10.1111/1556-4029.12448. PMID 24579739.
- ^ Коджома М., Секи Х., Йошида С., Муранака Т. (июнь 2006 г.). «Полиморфизмы ДНК в гене синтазы тетрагидроканнабиноловой кислоты (THCA) в« лекарственном виде »и« волокнистом типе »Cannabis sativa L». Международная криминалистическая экспертиза. 159 (2–3): 132–40. Дои:10.1016 / j.forsciint.2005.07.005. PMID 16143478.
- ^ Таура Ф, Моримото С., Шояма Й., Мечоулам Р. (1995). "Первое прямое свидетельство механизма Δ1биосинтез -тетрагидроканнабиноловой кислоты ». Варенье. Chem. Soc. 117 (38): 9766–9767. Дои:10.1021 / ja00143a024.
- ^ Сирикантарамас С., Моримото С., Сояма Ю., Исикава Ю., Вада Ю., Сояма Ю., Таура Ф. (сентябрь 2004 г.). «Ген, контролирующий психоактивность марихуаны: молекулярное клонирование и гетерологичная экспрессия дельта-1-тетрагидроканнабиноловой кислоты синтазы из Cannabis sativa L». Журнал биологической химии. 279 (38): 39767–74. Дои:10.1074 / jbc.M403693200. PMID 15190053.
- ^ Сояма Ю., Такеучи А., Таура Ф, Тамада Т., Адачи М., Куроки Р., Сояма Ю., Моримото С. (август 2005 г.). «Кристаллизация дельта-1-тетрагидроканнабиноловой кислоты (THCA) синтазы из Cannabis sativa». Acta Crystallographica Раздел F. 61 (Pt 8): 799–801. Дои:10.1107 / S1744309105023365. ЧВК 1952348. PMID 16511162.
- ^ Сирикантарамас С., Таура Ф., Танака Ю., Исикава Ю., Моримото С., Шояма И. (сентябрь 2005 г.). «Синтаза тетрагидроканнабиноловой кислоты, фермент, контролирующий психоактивность марихуаны, секретируется в полость хранения железистых трихом». Физиология растений и клеток. 46 (9): 1578–82. Дои:10.1093 / pcp / pci166. PMID 16024552.
- ^ Моримото С., Танака Ю., Сасаки К., Танака Х., Фукамизу Т., Сояма Ю., Сояма Ю., Таура Ф. (июль 2007 г.). «Идентификация и характеристика каннабиноидов, которые вызывают гибель клеток из-за перехода митохондриальной проницаемости в клетках листьев конопли». Журнал биологической химии. 282 (28): 20739–51. Дои:10.1074 / jbc.M700133200. PMID 17513301.
- ^ Ямаути Т., Шояма Й, Арамаки Х, Адзума Т., Нисиока I. (июль 1967). «Тетрагидроканнабиноловая кислота, подлинное вещество тетрагидроканнабинола». Химико-фармацевтический бюллетень. 15 (7): 1075–6. Дои:10.1248 / cpb.15.1075. PMID 5583149.
- ^ а б Морено-Санз Г. (2016-06-01). «9-Тетрагидроканнабиноловая кислота А». Каннабис и исследования каннабиноидов. 1 (1): 124–130. Дои:10.1089 / кан.2016.0008. ЧВК 5549534. PMID 28861488.
- ^ Гусман М. (октябрь 2003 г.). «Каннабиноиды: потенциальные противораковые агенты». Обзоры природы. Рак. 3 (10): 745–55. Дои:10.1038 / nrc1188. PMID 14570037.
- ^ Таура Ф., Сирикантарамас С., Шояма Й., Йошикай К., Шояма Й., Моримото С. (июнь 2007 г.). «Синтаза каннабидиоловой кислоты, фермент, определяющий хемотип в клетчатке Cannabis sativa». Письма FEBS. 581 (16): 2929–34. Дои:10.1016 / j.febslet.2007.05.043. PMID 17544411.
- ^ а б Zirpel B, Stehle F, Kayser O (сентябрь 2015 г.). «Производство Δ9-тетрагидроканнабиноловой кислоты из каннабигероловой кислоты целыми клетками Pichia (Komagataella) pastoris, экспрессирующими синтазу Δ9-тетрагидроканнабиноловой кислоты из Cannabis sativa L». Письма о биотехнологии. 37 (9): 1869–75. Дои:10.1007 / s10529-015-1853-х. PMID 25994576.
- ^ Трост Б.М., Догра К. (март 2007 г.). «Синтез (-) - Delta9-транс-тетрагидроканнабинола: стереоконтроль через реакцию асимметричного аллильного алкилирования, катализируемую Mo». Органические буквы. 9 (5): 861–3. Дои:10.1021 / ol063022k. ЧВК 2597621. PMID 17266321.
- ^ Ланге К., Шмид А., Юлсинг М.К. (октябрь 2015 г.). «Производство Δ (9) -тетрагидроканнабиноловой кислоты синтазы в Pichia pastoris обеспечивает химический синтез каннабиноидов». Журнал биотехнологии. 211: 68–76. Дои:10.1016 / j.jbiotec.2015.06.425. PMID 26197418.



