Трис (триметилсилил) амин - Tris(trimethylsilyl)amine - Wikipedia
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.014.951 |
| Номер ЕС |
|
PubChem CID | |
| |
| |
| Характеристики | |
| C9ЧАС27NSi3 | |
| Молярная масса | 233,57 г / моль |
| Внешность | Восковое твердое вещество |
| Температура плавления | 67–69ºC |
| Точка кипения | 215 ° C (85 ° C при 13 мм рт. Ст.) |
| Растворимость | Неполярные органические растворители |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
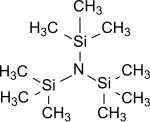
Трис (триметилсилил) амин представляет собой простейший трис (триалкилсилил) амин, имеющий общую формулу (R3Si)3N, в котором все три атома водорода аммиак заменены на триметилсилильные группы (-Si (CH3)3).[1] Трис (триметилсилил) амин в течение многих лет находился в центре научного интереса как стабильный промежуточный продукт в химических соединениях. азотфиксация (т. е. преобразование атмосферного азот N2 в органические субстраты под нормальные условия ).[2][3][4]
Производство
Ранние попытки получить трис (триметилсилил) амин из аммиака и триметилхлорсилан (TMS-Cl) оказались безуспешными даже при температуре 500 ° C и в присутствии основания пиридин.[5][6] Реакция аммиака и триметилхлорсилана останавливается на стадии дважды силилированного продукта бис (диметилсилил) амина (обычно обозначаемого как гексаметилдисилазан, HMDS).

Трис (триметилсилил) амин получают реакцией натриевой соли гексаметилдисилазана - из гексаметилдисилазана и амид натрия[7] или из гексаметилдисилазана, натрий и стирол[1] - с триметилхлорсиланом в 80% урожай.[8]
Литиевая соль гексаметилдисилазана - из гексаметилдисилазана и бутиллитий[9] или из гексаметилдисилазана и фениллитий[8] - реагирует с триметилхлорсиланом только с выходами 50-60% до трис (триметилсилил) амина.
Реакция нитрида лития с триметилхлорсиланом может быть проведена в однореакторном режиме в ТГФ с выходом 72%.[10]
Характеристики
Трис (триметилсилил) амин - бесцветный кристаллический[11][12] или восковой[7] твердое вещество, устойчивое к воде и щелочам.[13] Хотя спирты или кислоты расщепляют Si-N-связь с образованием аммиака.[7]
Приложения
Трис (триметилсилил) амин как синтетический строительный блок
Из трихлорид сурьмы и трис (триметилсилил) амин, нитридоантимон кластер кубанового типа практически количественно может образовываться при –60 ° C.[14]
Кетоны могут быть трифторметилированный в присутствии п4-т-Bu и нонаметилтрисилазан в мягких условиях с выходами до 84% с инертным фтороформ (HCF3, ГФУ-23).[15]
В мономер трихлор (триметилсилил) -фосфоранимин Cl3P = NSiMe3 образуется из трис (триметилсилил) амина и пентахлорид фосфора в гексан при 0 ° C,

который может быть полимеризован до линейного полидихлорфосфазены с определенными молекулярными массами и полидисперсность.[16]
Циклический тример (NPCl2)3 гексахлорциклотрифосфан преимущественно образуется из трис (триметилсилил) амина и пентахлорида фосфора в кипящем дихлорметане (около 40 ° C) среди других олигомеров, который дает при нагревании выше 250 ° C полидихлорфосфазены с высокой молекулярной массой и с низкой определенностью.
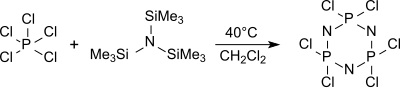
Трифторид азота NF3 (который используется, в частности, для плазменного травления кремниевых пластин), может быть получен из трис (триметилсилил) амина и фтор при –40 ° C в ацетонитрил, подавление образования азота и тетрафторгидразина, которые образуются как нежелательные побочные продукты во время стандартного синтеза трифторида азота из аммиака или фторид аммония.[17]

Промежуточное соединение трис (триметилсилил) амина при химической фиксации азота
Техническая фиксация азота стала возможной благодаря процессу Габера-Боша, в котором азот превращается в аммиак путем восстановления. протонирование в присутствии железных катализаторов при высоких давление (> 150 бар ) и температуры (> 400 ° C). При химической фиксации азота (т.е. превращении атмосферного азота в нормальных условиях в реактивные исходные материалы для химического синтеза, обычно также аммиак) трис (триметилсилил) амин играет важную роль в так называемом восстановительном процессе. силилирование, так как гидролизуется водой до аммиака.
Еще в 1895 г. было замечено, что металлический литий реагирует с азотом с образованием нитрид лития при комнатной температуре.[18] В 1972 г. К. Шиина обнаружил, что литий (как донор электронов ) образуется с триметилсилилхлоридом при потемнении трис (триметилсилил) амина в присутствии хлорид хрома (III) в качестве катализатора при комнатной температуре с азотом, используемым для инертизации.[2]
Совсем недавно для восстановительного силилирования N2, натрий был использован вместо лития в качестве донора электронов и молибден[19] и соединения железа[3] (Такие как пентакарбонильное железо или же ферроцены[20]) в качестве катализаторов до 34 эквивалентов N (Me3Si)3 может быть получено из расчета на один атом железа в катализаторе.
С комплексом молибден-ферроцен в качестве катализатора номер оборота может быть достигнуто до 226.[21]
Каталитическая производительность разработанных катализаторов химической фиксации азота, несмотря на интенсивные исследования, составляет[22] все еще на порядок меньше, чем, например, современные катализаторы полимеризации металлоценового типа или ферменты.
Рекомендации
- ^ а б J. Goubeau, J. Jiminéz-Barberá (1960), «Трис- (триметилсилил) -амин», ZAAC (на немецком), 303 (5–6), стр. 217–226, Дои:10.1002 / zaac.19603030502
- ^ а б К. Шиина (1972), «Восстановительное силилирование молекулярного азота путем фиксации на трис (триметилсилил) амин», Варенье. Chem. Soc., 94 (26), стр. 9266–9267, Дои:10.1021 / ja00781a068
- ^ а б K.C. MacLeod, P.L. Холланд (2013), "Последние разработки в области гомогенного восстановления диазота молибденом и железом", Химия природы, 5, стр. 559–565, Дои:10.1038 / nchem.1620, ЧВК 3868624, PMID 23787744
- ^ W.I. Dzik (2016), «Силилирование диазота, катализируемое водородом азота (трифенилфосфин) кобальтом (I)», Неорганика, 4 (3), стр. 21, Дои:10.3390 / неорганика 4030021
- ^ Р.О. Зауэр (1944), "Производные метилхлорсиланов. I. Триметилсиланол и его простые эфиры", Варенье. Chem. Soc., 66 (10), с. 1707–1710, Дои:10.1021 / ja01238a030
- ^ Р.О. Зауэр, Р. Х. Гасек (1946), "Производные метилхлорсиланов. IV. Амины", Варенье. Chem. Soc., 68 (2), стр. 241–244, Дои:10.1021 / ja01206a028
- ^ а б c К. Р. Крюгер, Х. Нидерпрум, М. Шмидт, О. Шерер (1966), Х. Ф. Хольцлоу (ред.), Бис (триметилсилил) амид натрия и трис (триметилсилил) амин в неорганических синтезах, 8, Хобокен, штат Нью-Джерси, США: John Wiley & Sons, Inc., стр. 15–19, Дои:10.1002 / 9780470132395.ch5, ISBN 9780470131671CS1 maint: несколько имен: список авторов (связь)
- ^ а б U. Wannagat, H. Niederprüm (1961), "Beiträge zur Chemie der Silicium-Stickstoff-Verbindungen, XIII. Silylsubstituierte Alkaliamide", Chem. Бер. (на немецком), 94 (6), стр. 1540–1547, Дои:10.1002 / cber.19610940618
- ^ E.H. Амоноо-Нейзер, Р.А. Шоу, Д.О. Сковлин, Б. Смит, Дж. Розенталь, W.L. Веселый (1966), Х.Ф. Хольцлоу (редактор), Бис (триметилсилил) амид лития и трис (триметилсилил) амин в неорганических синтезах, 8, Хобокен, Нью-Джерси, США: John Wiley & Sons, Inc., стр. 19–22, Дои:10.1002 / 9780470132395.ch5, ISBN 9780470131671CS1 maint: несколько имен: список авторов (связь)
- ^ W.L. Лен (1964), "Получение трис (триметилсилил) - и трис (триметилстаннил) аминов", Варенье. Chem. Soc., 86 (2), стр. 305, г. Дои:10.1021 / ja01056a057
- ^ Сигма-Олдрич Ко., продукт не. {{{я бы}}}.
- ^ Nonamethyltrisilazane в AlfaAesar, по состоянию на 28 декабря 2016 г. (PDF ) (Требуется JavaScript).
- ^ U. Wannagat, H. Niederprüm (1961), "dreifach silylierte Amine", ZAAC (на немецком), 308 (1–6), стр. 337–351, Дои:10.1002 / zaac.19613080135
- ^ М. Риль, Ф. Веллер, Дж. Пеблер, К. Дехнике (1994), "[SbN (SbCl)3(NSbCl2) (NSiMe3)3· SbCl3], ein ungewöhnlicher Nitridoantimonkomplex mit Heterocubanstruktur ", Энгью. Chem. (на немецком), 106 (5), стр. 599–600, Дои:10.1002 / ange.19941060519CS1 maint: несколько имен: список авторов (связь)
- ^ С. Окусу, К. Хирано, Э. Токунага, Н. Шибата (2015), «Катализируемое органо-катализируемое трифторметилирование кетонов и сульфонилфторидов фтороформом в сверхосновной системе», ХимияOpen, 4, стр. 581–585, Дои:10.1002 / открыто.201500160, ЧВК 4608523, PMID 26491635CS1 maint: несколько имен: список авторов (связь)
- ^ США 5698664, «Синтез полифосфазенов с контролируемой молекулярной массой и полидисперсностью»
- ^ США 8163262, «Способ получения фторида азота из триметилсилиламинов».
- ^ Х. Десландр (1895), «Абсорбция азотного лития во фроиде», Comptes rendus, 121, стр. 886–887
- ^ Q. Liao, N. Saffon-Merceron, N. Mézailles (2015), "N2 восстановление в силиламин в центре тридентатного фосфина / Мо: катализ и изучение механизмов ", ACS Catal., 5 (11), стр. 6902–6906, Дои:10.1021 / acscatal.5b01626CS1 maint: несколько имен: список авторов (связь)
- ^ М. Юки, Х. Танака, К. Сасаки, Ю. Мияке, К. Йошизава, Ю. Нисибаяси (2012), «Катализируемое железом превращение молекулярного диазота в силиламин в условиях окружающей среды», Nature Communications, 3, п. 1254, г. Дои:10.1038 / ncomms2264CS1 maint: несколько имен: список авторов (связь)
- ^ Х. Танака; и другие. (2011), «Катализируемое молибденом превращение молекулярного диазота в силиламин: экспериментальное и DFT исследование замечательной роли ферроценлдифосфиновых лигандов», Варенье. Chem. Soc., 133 (10), стр. 3498–3506, Дои:10.1021 / ja109181n
- ^ Y. Nishibayashi (2015), "Недавний прогресс в катализируемом переходными металлами восстановлении молекулярного диазота в условиях окружающей среды", Неорг. Chem., 54 (19), стр. 9234–9247, Дои:10.1021 / acs.inorgchem.5b00881

![{ displaystyle { begin {matrix} {} { ce {[(CH3) 3Si] 2NH -> [+ { ce {NaNH2}}] [- { ce {NH3}}] NaN [Si ( CH3) 3] 2 -> [+ { ce {ClSi (CH3) 3}}] [- { ce {NaCl}}] N [Si (CH3) 3] 3}} {} end {матрица }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/78549476135b927dc95d6c81bc50de9b89e0b7ae)

![{ displaystyle { ce {{N2} + {6e ^ {-}} -> [{ ce {Catalyst:}} { ce {Mo}}, { ce {Fe}}, { ce {Co}}]}} { begin {case} { ce {-> [{ ce {H +}}]}} & { ce {2NH3}} {} { ce {- > [{ ce {R3Si-X}}] [- , { ce {X -}}]}} & { ce {2N (SiR3) 3}} end {case}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7aa5ae0b13d71a31c97f22297303dee5ed50221a)
![{ displaystyle { ce {N2 + 6Me3SiCl + 6}} , { color {NavyBlue} { ce {Li}}} { ce {-> [{ ce {CrCl3}}] 2N (SiMe3) 3 + 6}} , { color {NavyBlue} { ce {Li}}} { ce {Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7e5556a07b9c108214c4261b7694524d5af5665)
![{ displaystyle { ce {N2 + 6Me3SiCl + 6}} , { color {Red} { ce {Na}}} { ce {-> [{ ce {Fe-катализатор}}] 2N ( SiMe3) 3 + 6}} , { color {Red} { ce {Na}}} { ce {Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ecf55c39b3edb4a67900c2fb80e508b6a1b31d91)
![{ displaystyle { color {Red} { ce {N2}}} + { color {NavyBlue} { ce {Me3Si}}} { ce {{Cl} + Na -> [{ ce {Mo / Fe-катализатор}}.] [{ Ce {RT}} atop (1 { ce {atm}})]}} { color {Red} { ce {N}}} { color { NavyBlue} { ce {(Me3Si) 3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e5a412bc2fab4fa67528a1779b7c318068be6f7)