Грудной имплант - Breast implant
| Грудной имплант | |
|---|---|
Видео врача, размечающего грудную клетку для установки имплантатов. | |
| Специальность | Пластическая хирургия |
А грудной имплант это протез используется для изменения размера, формы и контура человека грудь. В реконструктивной пластическая хирургия, грудные имплантаты могут быть установлены для восстановления естественного вида груди после мастэктомия или исправить врожденные дефекты и уродства грудной стенки. Они также используются в косметических целях, чтобы увеличить грудь за счет операция по увеличению груди.
Осложнения имплантатов могут включать: боль в груди, изменения кожи, инфекция, разрыв и скопление жидкости вокруг груди.[1]
Существует четыре основных типа грудных имплантатов, которые определяются наполнителем: физиологический раствор, силиконовый гель, структурированный и композитный наполнитель. Имплантат с солевым раствором эластомер силикон скорлупа наполнена стерильным физиологический раствор во время операции; силиконовый имплантат имеет силиконовую оболочку из эластомера, предварительно заполненную вязкой силикон гель; в структурированных имплантатах используются вложенные силиконовые оболочки из эластомера и два просвета, заполненных физиологическим раствором; а имплантаты альтернативного состава содержали разные наполнители, такие как соевое масло или же полипропиленовая струна. Композитные имплантаты, как правило, больше не рекомендуются для использования, и, фактически, их использование запрещено в США и Европе из-за связанных с этим рисков для здоровья и осложнений.
В хирургической практике при реконструкции груди расширитель тканей Устройство представляет собой временный протез груди, используемый для формирования и установки кармана для будущего постоянного имплантата груди. Для коррекции дефектов и деформаций мужской груди грудной имплантат представляет собой протез груди, используемый для реконструкции и эстетического ремонта грудной стенки мужчины (см .: гинекомастия и мастопексия ).
Использует
А маммопластика Процедура установки устройств грудного имплантата преследует три (3) цели:
- первичная реконструкция: замещение тканей груди, поврежденных травмой (тупой, проникающий, взрыв ), болезнь (рак молочной железы ) и неудачное анатомическое развитие (бугристая деформация груди ).
- Ревизия и реконструкция: пересмотреть (исправить) результат предыдущей операции по реконструкции груди.
- первичное увеличение: до эстетического увеличение размер, форма и ощущение груди.
В операционная комната (ИЛИ) время публикации–мастэктомия реконструкция груди, и из Увеличение груди Операция определяется используемой процедурой, типом разрезов, грудным имплантатом (типом и материалами) и грудным участком кармана имплантата.
Недавние исследования показали, что маммограммы не должны выполняться с большей частотой, чем при обычных процедурах, у пациентов, перенесших операцию на груди, включая имплантат груди, увеличение груди, мастопексию и уменьшение груди.[2]
Психология
В Увеличение груди пациентом обычно является молодая женщина, профиль личности которой указывает на психологический стресс, связанный с ее внешним видом и телом. самооценка, а также история претерпевания критики (насмешек) по поводу эстетика ее личности.[3] Исследования Проблемы с изображением тела у пациентов с увеличенной грудью (2003) и Дисморфическое расстройство тела и косметическая хирургия (2006) сообщили, что женщина, перенесшая Увеличение груди операция также перенесла психотерапия, пострадал низко самооценка, представил частые случаи психологическая депрессия, попытался самоубийство, и пострадал дисморфия тела, тип психического заболевания.
Послеоперационные опросы пациентов о психическом здоровье и качестве жизни сообщили об улучшении физического здоровья, внешнего вида, социальной жизни, уверенности в себе, самооценки и удовлетворительного сексуальное функционирование. Кроме того, женщины сообщили о долгосрочном удовлетворении результатами их имплантации груди; некоторые, несмотря на наличие медицинских осложнений, потребовавших хирургического вмешательства, корректирующего или эстетического. Аналогичным образом, в Дании 8% Увеличение груди пациенты имели дооперационный анамнез госпитализации в психиатрическую больницу.[4][5][6][7][8][9][10][11][12]
В 2008 г. длительное обучение Повышенная смертность от самоубийств и других внешних причин смерти среди женщин с косметическими имплантатами груди (2007), сообщили, что женщины, которые искали грудные имплантаты, почти в 3 раза чаще самоубийство как и женщины, которые не искали грудные имплантаты. По сравнению со стандартным уровнем самоубийств среди женщин из общей массы, уровень самоубийств среди женщин с увеличенной грудью оставался неизменным до 10 лет после имплантации, однако он увеличился в 4,5 раза через 11 лет, и поэтому оставалась до 19-летней отметки, когда через 20 лет после имплантации она увеличилась в 6 раз. Более того, помимо риска самоубийства, женщины с грудными имплантатами также сталкивались с утроенным риском смерти от алкоголизм и злоупотребление рецептурными и развлекательными наркотиками.[13][14] Хотя семь исследований статистически связали увеличение груди женщины с повышенным уровнем самоубийств, исследование показывает, что операция по увеличению груди не увеличивает уровень смертности; и что, в первую очередь, это психопатологически склонная женщина, которая с большей вероятностью перенесет Увеличение груди процедура.[15][16][17][18][19][20]
Изучение Влияние маммопластики по увеличению груди на самооценку и сексуальность: количественный анализ (2007), сообщили, что женщины приписывают улучшение самооценка, самооценка, и улучшенное, удовлетворительное сексуальное функционирование после увеличения груди; в когорте в возрасте 21–57 лет среднее послеоперационное повышение самооценки колебалось от 20,7 до 24,9 балла по 30-балльной шкале. Шкала самооценки Розенберга, данные которого подтверждают рост женского либидо относительно ее дооперационного уровня либидо.[21] Поэтому, прежде чем соглашаться на операцию, пластический хирург оценивает и учитывает состояние женщины. душевное здоровье чтобы определить, могут ли грудные имплантаты положительно повлиять на ее самооценку и сексуальное функционирование.
Осложнения
В пластическая хирургия установка устройств грудного имплантата, либо для реконструкция груди или для эстетическая цель, представляет те же риски для здоровья, что и хирургия, например, неблагоприятная реакция на анестезия, гематома (послеоперационное кровотечение), поздняя гематома (послеоперационное кровотечение через 6 месяцев и более),[22] серома (скопление жидкости), разрыв в месте разреза (раневая инфекция). Осложнения, характерные для увеличения груди, включают боль в груди, изменение чувствительности, нарушение функции грудного вскармливания, видимые морщины, асимметрию, истончение ткани груди и симмастия, «хлебная буханка» бюста, прерывающая естественную плоскость между грудями. Специальные методы лечения осложнений, связанных с постоянными грудными имплантатами:капсульная контрактура и разрыв капсулы - периодические МРТ наблюдение и медицинские осмотры. Более того, осложнения и повторные операции, связанные с операцией по имплантации, и расширители тканей (подставки для имплантатов во время операции) могут вызвать неблагоприятные рубцевание примерно у 6–7% пациентов.[23][24][25] Статистически, 20% женщин, перенесших косметическую имплантацию, и 50% женщин, перенесших реконструктивную имплантацию груди, нуждались в эксплантации через 10 лет.[26]
Безопасность
В начале 1990-х годов национальные министерства здравоохранения перечисленных стран провели обзор соответствующих исследований причинно-следственных связей между силиконовыми гелевыми имплантатами груди и системными и аутоиммунными заболеваниями. Общий вывод состоит в том, что нет никаких доказательств, устанавливающих причинную связь между имплантацией силиконовых грудных имплантатов и любым типом заболевания. Датское исследование Долгосрочное состояние здоровья датских женщин с силиконовыми имплантатами груди (2004) сообщили, что женщины, которым имплантаты груди в среднем 19 лет, не чаще сообщали о чрезмерном количестве ревматическая болезнь симптомы, чем у женщин контрольной группы.[27] Последующее исследование Смертность среди пациентов с увеличивающей маммопластикой: обновленная информация (2006) сообщили об уменьшении стандартизованный коэффициент смертности и повышенный риск рак легких смерть среди пациентов с имплантатами груди, чем среди пациентов, перенесших другие виды пластических операций; различия в уровне смертности объяснялись курение табака.[28] Изучение Смертность среди канадских женщин с косметическими имплантатами груди (2006), около 25 000 женщин с грудными имплантатами, сообщили о том, что уровень заболеваемости раком груди среди них на 43 процента ниже, чем среди населения в целом, и риск рака ниже среднего.[29]
| Год | Страна | Группа системного обзора | Выводы |
|---|---|---|---|
| 1991–93 | объединенное Королевство | Независимая консультативная группа экспертов (IEAG) | Не было доказательств повышенного риска заболевания соединительной ткани у пациентов, перенесших установку грудного имплантата силикон-гелем, а также причин для изменения практики или политики в отношении грудных имплантатов в Великобритании. |
| 1996 | Соединенные Штаты | Институт медицины США (IOM)[30] | «Недостаточно доказательств связи имплантатов груди, заполненных силиконовым гелем или физиологическим раствором, с определенным заболеванием соединительной ткани». |
| 1996 | Франция | Национальное агентство по развитию медицины (ANDEM) [Национальное агентство медицинского развития и оценки][31] | Французский оригинал: "Nous n'avons pas observé de connectivité ni d'autre patologie auto -immuneceptible d'être directement or indirectement индуцирует наличие имплантата маммайр в особом силиконовом геле ...." Английский перевод: «Мы не наблюдали заболеваний соединительной ткани, которые прямо или косвенно связаны с наличием грудного имплантата, в частности силиконового геля…» |
| 1997 | Австралия | Комитет по оценке терапевтических устройств (TDEC) | «Современная высококачественная литература предполагает, что нет никакой связи между грудными имплантатами и синдромами, подобными заболеваниям соединительной ткани (атипичные заболевания соединительной ткани)».[32] |
| 1998 | Германия | Федеральный институт медицины и медицинских изделий | Сообщается, что «силиконовые грудные имплантаты не вызывают аутоиммунных заболеваний или ревматических заболеваний и не оказывают неблагоприятного воздействия на беременность, способность кормить грудью или здоровье детей, находящихся на грудном вскармливании. Нет никаких научных доказательств существования аллергии на силикон. , отравление силиконом, атипичные силиконовые заболевания или новое силиконовое заболевание ».[33] |
| 2000 | Соединенные Штаты | Федеральный суд назначил пересмотр[34] | «Нет доказательств связи между ... имплантатами груди, наполненными силиконовым гелем, и любыми отдельными CTD, всеми определенными CTD вместе взятыми, или другими аутоиммунными или ревматическими состояниями». |
| 2000 | Евросоюз | Европейский комитет по обеспечению качества и медицинскому оборудованию в пластической хирургии (EQUAM) | "Дополнительные медицинские исследования не продемонстрировали какой-либо связи между грудными имплантатами, наполненными силиконовым гелем, и традиционными аутоиммунными заболеваниями или заболеваниями соединительной ткани, рак, ни какое-либо другое злокачественное заболевание. . . . EQUAM по-прежнему считает, что нет никаких научных доказательств существования аллергии на силикон, силиконовой интоксикации, атипичного заболевания или «нового силиконового заболевания» ».[35] |
| 2001 | объединенное Королевство | Британская группа независимого обзора (UK-IRG) | «Нет никаких доказательств связи с аномальным иммунным ответом или типичными или атипичными заболеваниями или синдромами соединительной ткани».[36] |
| 2001 | Соединенные Штаты | Обзор Национальной научной комиссии, назначенный судом[37] | Группа оценила установленные и недифференцированные заболевания соединительной ткани (CTD) и пришла к выводу, что между имплантатами груди и этими CTD нет причинных доказательств. |
| 2003 | Испания | Оценка вариантов науки и технологий (STOA) | В отчете STOA Комитету по петициям Европейского парламента сообщается, что текущие научные данные не демонстрируют убедительных причинно-следственных доказательств, связывающих SBI [силиконовые грудные имплантаты] с тяжелыми заболеваниями, например рак молочной железы, заболевания соединительной ткани.[38] |
| 2009 | Евросоюз | Панель Международного комитета по обеспечению качества, медицинских технологий и устройств в пластической хирургии (IQUAM) | Консенсусное заявление конференции Transatlantic Innovations (апрель 2009 г.) показало, что дополнительные медицинские исследования не продемонстрировали связи между имплантатами груди, наполненными силиконовым гелем, и карциномой, а также каким-либо метаболическим, иммунным или аллергическим расстройством.[39] |
Разрыв имплантата
Поскольку грудной имплантат - это Медицинское изделие III класса из-за ограниченного срока службы основными факторами скорости разрушения являются его возраст и конструкция; тем не менее, устройство грудного имплантата может десятилетиями сохранять свою механическую целостность в теле женщины.[40] Когда грудной имплантат с физиологическим раствором разрывается, протекает и опорожняется, он быстро сдувается и, таким образом, может быть легко эксплантирован (удален хирургическим путем). Последующий отчет, Имплантаты груди Natrelle, заполненные физиологическим раствором: проспективное 10-летнее исследование (2009) указали на частоту разрыва-дефляции 3–5% через 3 года после имплантации и 7–10% на частоту разрыва-дефляции через 10 лет после имплантации.[41]

Когда силиконовый грудной имплант разрывается, он обычно не сдувается, но гель-наполнитель вытекает из него, который может мигрировать в карман имплантата; следовательно, внутрикапсульный разрыв (утечка внутри капсулы) может стать экстракапсулярным разрывом (утечка вне капсулы), и каждый случай разрешается путем эксплантации. Хотя просочившийся силиконовый гель-наполнитель может мигрировать из тканей грудной клетки в другие части тела женщины, большинство клинических случаев осложнения ограничены грудь и подмышка области, обычно проявляющиеся как гранулемы (воспалительные узелки) и подмышечные лимфаденопатия (увеличено лимфатические узлы в области подмышек).[42][43][44]
Предполагаемые механизмы разрыва грудного имплантата:
- повреждение при имплантации
- повреждение во время (других) хирургических процедур
- химическая деградация оболочки грудного имплантата
- травма (тупая травма, проникающая травма, взрывная травма )
- механическое давление традиционных маммографический обследование груди [45]
Разрыв силиконового имплантата можно оценить с помощью магнитно-резонансной томографии; из долгосрочного МРТ данные по однопросветным имплантатам груди, европейская литература о силиконовых гелевых имплантатах второго поколения (дизайн 1970-х годов), сообщают о частоте бесшумных разрывов устройств на уровне 8-15% через 10 лет после имплантации (15-30% от пациенты).[46][47][48][49]
Изучение Безопасность и эффективность имплантатов Mentor's MemoryGel через 6 лет (2009), которое было отраслевым исследованием основного исследования FDA США. клинические испытания для начальной Увеличение груди хирургические пациенты сообщили о низком уровне разрыва устройств - 1,1% через 6 лет после имплантации.[50] Первая серия МРТ оценки силиконовых грудных имплантатов с толстым наполнителем-гелем показали, что частота разрывов устройства составляет 1 процент или меньше при среднем 6-летнем возрасте устройства.[51] Статистически ручное обследование (пальпация) женщины не позволяет точно определить, разорвался ли грудной имплантат. Изучение, Диагностика разрыва силиконового грудного имплантата: клинические результаты по сравнению с результатами магнитно-резонансной томографии (2005) сообщили, что у бессимптомных пациентов только 30 процентов разорванных грудных имплантатов точно пальпируются и обнаруживаются опытным пластическим хирургом, тогда как МРТ-исследования точно выявляют 86 процентов разрывов грудных имплантатов.[52] Поэтому FDA США рекомендовало плановые МРТ-обследования, такие как скрининг на беззвучный разрыв, начиная с 3-летней отметки после имплантации, а затем каждые два года.[23] Тем не менее, за пределами США, медицинские учреждения других стран не одобрили рутинный скрининг МРТ, а вместо этого предложили, чтобы такой радиологический обследование предназначено для двух целей: (i) для женщины с подозрением на разрыв грудного имплантата; и (ii) для подтверждения маммографический и ультразвуковой исследования, указывающие на наличие разрыва грудного имплантата.[53]
Более того, Влияние систематических ошибок дизайна исследования на диагностическую точность магнитно-резонансной томографии для выявления разрывов силиконовых грудных имплантатов: метаанализ (2011) сообщили, что скрининговые МРТ молочных желез у бессимптомных женщин могут переоценить частоту разрыва грудных имплантатов.[54] При этом Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США подчеркнуло, что «грудные имплантаты не являются устройствами на всю жизнь. Чем дольше женщина пользуется грудными имплантатами, заполненными силиконовым гелем, тем выше вероятность возникновения осложнений ».[55]
Капсульная контрактура
Человеческого тела иммунная реакция к хирургически установленному инородному объекту - грудному имплантату, сердечному кардиостимулятор, ортопедический протез - инкапсулировать его с помощью рубцовая ткань капсулы из плотно сплетенных коллаген волокна, чтобы поддерживать целостность тела, изолируя посторонний предмет, и таким образом переносить его присутствие. Капсульная контрактура - что следует отличать от нормальной капсульной ткани - возникает, когда капсула из коллагеновых волокон утолщается и сжимает грудной имплантат; это больно осложнение это может исказить грудной имплант, грудь или и то, и другое.

Причина капсульной контрактуры неизвестна, но общие факторы заболеваемости включают бактериальное заражение, разрыв корпуса устройства, утечку наполнителя и гематома. Хирургические процедуры имплантации, которые снизили частоту капсулярной контрактуры, включают подмышечную имплантацию, использование грудных имплантатов с текстурированной поверхностью (с полиуретановым покрытием);[56][57][58] ограниченное предоперационное обращение с имплантатами, ограниченный контакт с кожей грудной клетки кармана имплантата перед установкой грудного имплантата и орошение области реципиента растворами тройных антибиотиков.[59][60]
Для коррекции капсульной контрактуры может потребоваться открытая капсулотомия (хирургическое высвобождение) капсулы из коллагеновых волокон или удаление и возможная замена грудного имплантата. Кроме того, при лечении капсулярной контрактуры закрытая капсулотомия (разрыв с помощью внешних манипуляций) когда-то была обычным приемом для лечения твердых капсул, но сейчас это не рекомендуется, поскольку она может привести к разрыву грудного имплантата. Безоперационные методы лечения капсул из коллагеновых волокон включают массаж, наружный ультразвуковой терапия ингибиторы лейкотриенового пути Такие как зафирлукаст (Accolate) или монтелукаст (Singulair) и импульсная терапия электромагнитным полем (PEMFT).[61][62][63][64]
Ремонтно-ревизионные операции
Когда пациентка недовольна результатом увеличивающей маммопластики; или при возникновении технических или медицинских осложнений; или из-за ограниченного срока службы грудных имплантатов вполне вероятно, что ей может потребоваться замена грудных имплантатов. Общие показания к ревизионной операции включают серьезные и незначительные медицинские осложнения, капсульная контрактура, разрыв оболочки и сдувание устройства.[45] Частота ревизий была выше у пациентов с реконструкцией груди из-за постмастэктомических изменений мягких тканей и кожной оболочки груди, а также анатомический границы груди, особенно у женщин, получавших адъювантное наружное радиационная терапия.[45] Более того, помимо реконструкции груди, рак молочной железы Пациенты обычно проходят ревизионную операцию комплекса соск-ареола (NAC) и процедуры симметрии на противоположной груди, чтобы создать бюст естественного внешнего вида, размера, формы и ощущения. Тщательное соответствие типа и размера грудных имплантатов характеристикам мягких тканей груди пациента снижает частоту повторных операций. Соответствующее сопоставление тканей, выбор имплантата и надлежащая техника имплантации, частота повторных операций составила 3 процента через 7 лет, по сравнению с 20 процентами повторных операций через 3 года, как сообщает Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.[65][66]
Системное заболевание

С начала 1990-х годов в ряде независимых системных всеобъемлющих обзоров были изучены исследования, касающиеся связи между силиконовыми гелевыми имплантатами груди и заявлений о системных заболеваниях. Консенсус этих обзоров (изложенных ниже под заголовком «Безопасность грудных имплантатов») заключается в том, что не было доказательств причинно-следственной связи между имплантацией солевых или силиконовых грудных имплантатов и системным заболеванием.После исследования этой проблемы FDA США согласилось и с тех пор подтвердил, что «масса эпидемиологических данных, опубликованных в литературе, не поддерживает связь между фибромиалгией и грудными имплантатами». Комплексный системный обзор Lipworth (2011 г.) [67] заключает, что «любые утверждения, которые остаются относительно связи между косметическими грудными имплантатами и CTD, не подтверждаются научной литературой».
Платиновая токсичность
Платина представляет собой катализатор, используемый при изготовлении силиконовых полимерных оболочек имплантатов и других силиконовых устройств, используемых в медицине. В литературе указывается, что небольшое количество платины вымывается (вытекает) из этих имплантатов и присутствует в окружающих тканях. FDA проанализировало имеющиеся в медицинской литературе исследования платины и грудных имплантатов в 2002 году и пришло к выводу, что данных, свидетельствующих о токсичности платины у пациентов с имплантатами, мало.[68] FDA пересмотрело это исследование и дополнительную литературу несколько лет спустя, подтвердив предыдущие выводы о том, что платиновые катализаторы, используемые в имплантатах, вероятно, не ионизированы и, следовательно, не представляют опасности для женщин.[69]
Анапластическая крупноклеточная лимфома
FDA установило, что грудные имплантаты могут быть связаны с редкой формой рака, называемой анапластическая крупноклеточная лимфома, который, как полагают, связан с хроническим бактериальным воспалением.[70] Подобные явления ALCL наблюдались и с другими типами медицинских имплантатов, включая порты сосудистого доступа, ортопедические имплантаты бедра и имплантаты челюсти (ВНЧС). В 2015 году пластические хирурги опубликовали статью с обзором 37 статей в литературе о 79 пациентах и собрали еще 94 незарегистрированных случая, в результате чего у 173 женщин с имплантатами груди развился ALCL груди. Они пришли к выводу, что «связанная с грудным имплантатом ALCL - это новое проявление лимфомы, специфичной для сайта и материала, которая возникает в определенном месте рубца, имеет широкий спектр разнообразных характеристик и предполагает многофакторную причину». Они заявили, что «не было предпочтения ни физиологическому раствору, ни силиконовому наполнителю, ни косметическим или реконструктивным показаниям». Если история имплантата была известна, пациент получил по крайней мере одно устройство с текстурированной поверхностью. В 2016 году Всемирная организация здравоохранения (ВОЗ) официально признанный BIA-ALCL.[71]
По состоянию на 1 февраля 2017 года FDA получило в общей сложности 359 отчетов о медицинских устройствах, связанных с грудным имплантатом ALCL (BIALCL), включая 9 смертельных случаев.[72] Причинно-следственная связь между грудными имплантатами и ALCL была окончательно установлена в декабре 2013 года, когда исследователи из MD Anderson Cancer Center опубликовали исследование 60 женщин с грудными имплантатами, которым был поставлен диагноз ALCL в груди. Поскольку считалось, что ALCL диагностируется только у 1 женщины из полумиллиона, 60 женщин были намного большим числом, чем можно было ожидать. Исследователи отметили, что BIA-ALCL может быть фатальным.[73] Если у женщин с имплантатами наблюдается отсроченный отек или сбор жидкости, следует провести цитологические исследования и тест на маркер. CD30 предлагаются. Американское общество пластической хирургии (ASPS) заявляет: «CD30 - это основной диагностический тест, который должен выполняться на серомной жидкости как обычная патология или ОН окрашивание часто может не поставить диагноз ». [74] Диагностика и лечение связанного с грудным имплантатом ALCL теперь следует стандартизированным рекомендациям, установленным Национальной комплексной онкологической сетью.[75]
Текущий риск BIA-ALCL на протяжении всей жизни в США неизвестен, но оценки колеблются от одной из 70000 до одной из 500000 женщин с грудными имплантатами, согласно данным Онкологический центр доктора медицины Андерсона.[76] Некоторые географические районы демонстрируют переменные риски. Например, в обновленном сообщении Управления терапевтических товаров Австралии и Новой Зеландии за декабрь 2016 г. сообщается о риске от 1: 1000 до 1: 10 000 для текстурированных имплантатов. "[74] На сегодняшний день (2017 г.) не было зарегистрировано случая BIAL, когда пациенту была имплантирована только имплантация груди с гладкой оболочкой или расширитель текстурированной ткани, который был заменен на гладкий имплантат. Небольшое количество случаев, зарегистрированных в азиатских популяциях, повысило вероятность того, что к этому явлению может быть определенная генетическая предрасположенность; в качестве альтернативы, он может отражать различия в способах выявления и регистрации случаев.
ASPS и Фонд пластической хирургии (PSF) заключили партнерские отношения с FDA для изучения этого состояния и при этом создали Реестр пациентов и результаты для имплантатов груди и анапластической этиологии и эпидемиологии крупноклеточной лимфомы (ПРОФИЛЬ). FDA США настоятельно рекомендует всем врачам сообщать о случаях заболевания в PROFILE, чтобы лучше понять роль грудных имплантатов в ALCL и управлении этим заболеванием.[77]
Хирургические процедуры
Типы разрезов
Установка грудного имплантата выполняется с помощью пяти (5) хирургических разрезов:
- Инфрамаммарная артерия: разрез на инфрамаммарная складка (естественная складка под грудью), обеспечивающая максимальный доступ для точного рассечения тканей и установки грудных имплантатов. Это предпочтительный хирургический метод установки силикон-гелевых имплантатов, поскольку он лучше обнажает ткани молочной железы –грудная мышца интерфейс; тем не менее, имплантация IMF может привести к более толстому, чуть более заметному хирургическому вмешательству. шрамы.
- Периареолярный разрез: пограничный разрез по периферии ареола, который обеспечивает оптимальный подход, когда требуется корректировка позиции МВФ или когда мастопексия (подтяжка груди) входит в процедуру первичной маммопластики. При периареолярной установке разрез делается примерно на медиальной половине (нижней половине) окружности ареолы. Имплантаты из силиконового геля могут быть трудными для установки через периареолярный разрез из-за короткой пятисантиметровой длины (~ 5,0 см) необходимого разреза для доступа. С эстетической точки зрения, поскольку рубцы находятся на границе (периферии) ареолы, они обычно менее заметны, чем рубцы после IMF-разрезов у женщин со светлыми пигментными ареолами; по сравнению со шрамами от кожных разрезов модифицированный эпителий ареол менее подвержены (выпуклым) гипертрофическим рубцам.
- Трансаксиллярный: разрез на подмышечная впадина (подмышка), из которой проходят диссекционные туннели кнутри, чтобы установить имплантаты, тупо или эндоскоп (видеокамера с подсветкой), не оставляя видимых рубцов на самой груди; тем не менее, более вероятно возникновение нижней асимметрии положения имплантата и устройства.Следовательно, хирургическая ревизия чрескожно установленных грудных имплантатов обычно требует либо разреза IMF, либо периареолярного разреза.
- Трансупупочный: трансупупочное увеличение груди (ТУБА ) является менее распространенной техникой установки имплантата и устройства, при которой разрез делается в области пупка (пупок ), и туннели рассечения проходят вверх, к бюсту. Подход TUBA позволяет устанавливать грудные имплантаты, не оставляя видимых рубцов на самой груди; но делает соответствующее вскрытие и установку устройства технически более трудным. Процедура TUBA выполняется прямо - без визуальной помощи эндоскопа - и не подходит для установки (предварительно заполненных) силиконовых гелевых имплантатов из-за большого потенциала повреждения эластомер силикон оболочка грудного имплантата во время его ручной установки через короткий (~ 2,0 см) разрез в пупке, а также потому, что предварительно заполненные силиконовые гелевые имплантаты несжимаемы и не могут быть вставлены через такой маленький разрез.[78]
- Трансабдоминальный: как и в процедуре TUBA, при трансабдоминопластике увеличения груди (TABA) грудные имплантаты туннелируют вверх от разреза брюшной полости в тупо рассеченные карманы имплантата, в то время как пациенту одновременно выполняется абдоминопластика.[79]
Размещение кармана имплантата
Пятерка хирургический подходы к установке грудного имплантата в карман имплантата часто описываются в анатомический отношение к большая грудная мышца.
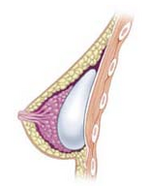
- Поджелезистая: грудной имплант устанавливается в ретромаммарное пространство, между ткани молочной железы (молочная железа) и большая грудная мышца (основная мышца груди), которая максимально приближается к плоскости нормальной ткани груди и дает наиболее эстетичные результаты. Тем не менее, у женщин с тонкими грудными мягкими тканями в субжелезистом положении чаще видны морщины и рябь на нижележащем имплантате. Более того, капсульная контрактура уровень заболеваемости несколько выше при субгландулярной имплантации.
- Субфасциальный: грудной имплант устанавливается под фасция из большая грудная мышца; субфасциальная позиция - это вариант субгландулярной позиции грудного имплантата.[80] Обсуждаются технические преимущества техники подфасциального имплантата; хирурги-сторонники сообщают, что слой фасциальная ткань обеспечивает большее покрытие имплантата и лучше удерживает свои позиции.[81]
- Субпекторальный (двойная плоскость): грудной имплант устанавливается под большая грудная мышца после того, как хирург освободит нижние мышечные прикрепления, с частичным рассечением субгландулярной плоскости или без нее. В результате верхний полюс имплантата частично находится под большой грудной мышцей, а нижний полюс имплантата находится в субжелезистой плоскости. Этот метод имплантации обеспечивает максимальное покрытие верхнего полюса имплантата, в то же время позволяя расширить нижний полюс имплантата; однако «анимационная деформация», движение имплантатов в субпекторальной плоскости может быть у некоторых пациентов чрезмерным.[82]
- Подмышечный: грудной имплант устанавливается под большая грудная мышца, не освобождая нижнее начало собственно мышцы. Полная мускулатура имплантата может быть достигнута за счет расслабления боковых мышц грудной стенки - либо зубчатая мышца или малая грудная мышца, или оба - и наложение швов его или их к большой грудной мышце. В реконструкция груди хирургия, подмышечная имплантация обеспечивает максимальный охват грудных имплантатов. Этот метод редко используется в косметической хирургии из-за высокого риска деформаций анимации.
- Предпекторный или подкожный: при реконструкции груди после мастэктомии с сохранением кожи или кожи и сосков имплантат устанавливается над грудью. большая грудная мышца мышцу, не рассекая ее, так что имплант заполняет непосредственно объем удаленной молочной железы. Чтобы избежать капсулярной контрактуры, имплантат часто покрывают спереди или полностью сеткой. биоматериал, биологический или синтетический.
Послеоперационное восстановление
В хирургический шрамы из Увеличение груди маммопластика развиваются примерно через 6 недель после операции и исчезают в течение месяцев. В зависимости от повседневной физической активности, требующейся от женщины, пациентка после операции по увеличению груди обычно возвращается к нормальной жизни через 1 неделю после операции. Более того, женщины, чьи грудные имплантаты были размещены под грудными мышцами (подмышечная установка), обычно имеют более длительное, немного более болезненное выздоровление из-за заживления разрезов на грудных мышцах. Обычно она не занимается спортом и не занимается интенсивными физическими нагрузками в течение примерно 6 недель. Во время первоначального послеоперационного восстановления женщине рекомендуется регулярно упражнять (сгибать и двигать) руку, чтобы облегчить боль и дискомфорт; если необходимо, обезболивающее постоянные катетеры для лекарств могут облегчить боль[83][84] Кроме того, значительно улучшилось выздоровление пациентов благодаря усовершенствованным методам имплантации грудных устройств (подмышечным, подкожным), которые позволяют 95 процентам женщин вернуться к нормальной жизни через 24 часа после процедуры без перевязок, дренажа жидкости, обезболивающих, катетеров. , бюстгальтеры медицинской поддержки или наркотический болеутоляющее средство.[85][86][87][88]
Типы

Сегодня существует три типа грудных имплантатов, обычно используемых для маммопластика, реконструкция груди, и Увеличение груди процедуры:[89]
- солевой имплант, заполненный стерильным физиологический раствор.
- силиконовый имплант, заполненный вязкой силикон гель.
- структурированные имплантаты с использованием вложенных силиконовых оболочек из эластомера и двух просветов, заполненных физиологическим раствором.
Четвертый тип имплантата, композитный (или альтернативный композитный) имплантат, в основном снят с производства. Эти типы содержат наполнители, такие как соевое масло и полипропиленовая нить. Другие материалы, снятые с производства, включают бычий хрящ, териленовую шерсть, измельченный каучук, силиконовый каучук и тефлон-силиконовые протезы.[90]
Солевые имплантаты
Имплантат груди с солевым раствором - заполненный физиологический раствор (биологическая концентрация соленой воды 0,90% ж / в из NaCl, ок. 300 мОсм /L.)— был впервые произведен компанией Laboratoires Arion во Франции и был представлен для использования в качестве протезного медицинский прибор в 1964 году. Современные модели солевых имплантатов груди производятся с более толстыми, при комнатной температуре вулканизированный (RTV) снаряды из силикон эластомер. Изучение Дефляция предварительно заполненных физиологическим раствором грудных имплантатов in vitro (2006) сообщили, что скорость дефляции (утечки наполнителя) из предварительно заполненного физиологического раствора грудного имплантата сделала его протезом второго выбора для корректирующей хирургии груди.[91] Тем не менее, в 1990-е годы грудной имплантат был протез наиболее распространенное устройство, используемое для операций по увеличению груди в Соединенных Штатах, из-за ограничения FDA США на имплантацию имплантатов груди с силиконовым наполнителем вне клинических исследований. Имплантаты груди из солевого раствора не пользуются большой популярностью в остальном мире, занимая ничтожную долю рынка.
Технической целью технологии имплантации солевого раствора была физически менее инвазивная хирургическая техника для установки пустого устройства грудного имплантата через меньший хирургический разрез.[92] В хирургической практике, после установки пустых грудных имплантатов в карманы имплантатов, пластический хирург затем заполнял каждое устройство физиологический раствор и, поскольку необходимые вставные разрезы короткие и маленькие, образующиеся в результате разрезы будут меньше и короче, чем хирургические рубцы, обычные для длинных разрезов, необходимых для вставки предварительно заполненных силиконовых гелевых имплантатов.
По сравнению с результатами, достигнутыми с помощью имплантата груди с силиконовым гелем, имплантат с солевым раствором может дать приемлемые результаты: увеличенный размер груди, более гладкий контур полушария и реалистичная текстура; тем не менее, существует вероятность возникновения косметических проблем, таких как волнистость и морщинистость кожи оболочки груди, ускоренное растяжение нижнего полюса груди и технические проблемы, такие как присутствие имплантата, заметного для глаза и на ощупь. . Возникновение таких косметических проблем более вероятно у женщин с очень небольшим грудь ткани, и в случае женщины, которая требует постмастэктомия реконструкция груди; таким образом, силиконовый гелевый имплант является технически лучшим протез устройство для увеличения груди, и для реконструкция груди. В случае женщины с большим количеством ткани груди, для которой рекомендуется хирургическое вмешательство под мышечную имплантацию, имплантаты груди с солевым раствором могут дать эстетический результат, аналогичный тому, который дают силиконовые имплантаты груди, хотя и с большей пальпируемостью имплантата.[93]
Силиконовые гелевые имплантаты
Как медицинский прибор технологии, существует пять поколений силиконовых грудных имплантатов, каждое из которых определяется общими методами изготовления моделей.[нужна цитата ]
Современный протез груди был изобретен в 1961 г. пластические хирурги Томас Кронин и Фрэнк Джероу, и произведены Корпорация Dow Corning; Со временем первая увеличивающая маммопластика была проведена в 1962 году.
Первое поколение
Имплант Cronin-Gerow, модель протеза 1963 года, представлял собой силиконовый каучуковый мешок-конверт в форме капли, заполненный вязким силиконовым гелем. Чтобы уменьшить вращение установленного грудного имплантата на грудной стенке, протез образца 1963 года был прикреплен к карману имплантата с помощью фиксатора-заплатки, сделанного из материала дакрон (Полиэтилентерефталат ), который был прикреплен к задней части оболочки грудного имплантата.[94]
Второе поколение
В 1970-х годах производители представили второе поколение протезов грудных имплантатов, которые отличались функциональными и эстетическими усовершенствованиями технологии:
- Первыми технологическими разработками стали более тонкая оболочка устройства и гель-наполнитель из силикона с низкой когезией, которые улучшили функциональность и правдоподобность (размер, внешний вид и текстуру) силиконового гелевого грудного имплантата. Тем не менее, в клинической практике грудные имплантаты второго поколения оказались хрупкими и чаще страдали от разрывов оболочки и утечки наполнителя («кровотечение из силиконового геля») через неповрежденную оболочку устройства. Как следствие, повышенная частота медицинских осложнений (например, капсульная контрактура ) выпавший дефектный продукт, коллективные иски правительством США против корпорации Dow Corning и других производителей протезов груди.
- вторая технологическая разработка была полиуретановая пена покрытие для оболочки грудного имплантата; покрытие уменьшило частоту капсульная контрактура, вызывая воспалительная реакция что препятствовало образованию капсулы из фиброзной коллаген ткань вокруг грудного имплантата. Тем не менее, несмотря на эту профилактическую меру, медицинское использование грудных имплантатов с полиуретановым покрытием было на короткое время прекращено из-за потенциального риска для здоровья, который представляет 2,4-толуендиамин (TDA), a канцерогенный побочный продукт химического разрушения пенополиуретанового покрытия грудного имплантата.[95]
- Изучив медицинские данные, США Управление по контролю за продуктами и лекарствами пришли к выводу, что TDA-индуцированный рак молочной железы представляет собой бесконечно малый риск для здоровья женщин с грудными имплантатами и не оправдывает юридического требования, чтобы врачи объясняли этот вопрос своим пациентам. В конце концов, грудные имплантаты с полиуретановым покрытием остаются в практике пластической хирургии в Европе и Южной Америке; и ни один производитель не запрашивал разрешение FDA на продажу таких грудных имплантатов в медицинских целях в США.[96]
- Третьей технологической разработкой стало устройство имплантата груди с двойным просветом, протез с двойной полостью, состоящий из силиконового имплантата груди, заключенного в имплантат груди с солевым раствором. Двоякая техническая цель заключалась в следующем: (i) косметические преимущества силиконового геля (внутренний просвет), заключенного в физиологический раствор (внешний просвет); (ii) устройство грудного имплантата, объем которого регулируется после операции. Тем не менее, более сложная конструкция двухпросветного грудного имплантата страдала от отказов устройства больше, чем у однопросветных грудных имплантатов. Современные версии устройств грудных имплантатов второго поколения (представленные в 1984 году) - это модели грудных имплантатов «Расширяемый Беккер», которые в основном используются для реконструкция груди.
Третье и четвертое поколения
В 1980-х годах модели третьего и четвертого поколений устройств для грудных имплантатов были последовательным развитием производственных технологий, таких как эластомер покрытые оболочки, уменьшающие просачивание геля (утечка наполнителя), и более толстый (повышенная когезия) гель наполнителя. Социологически затем производители протезов груди разработали и изготовили анатомические модели (натуральная грудь) и модели формы (круглые, сужающиеся), которые реалистично соответствовали типу груди и телосложения женщины. Конические модели грудных имплантатов имеют однородную текстурированную поверхность, что снижает вращение протеза внутри кармана имплантата; круглые модели грудных имплантатов доступны с гладкой и текстурированной поверхностью.
Пятое поколение
С середины 1990-х годов пятое поколение грудных имплантатов с силиконовым гелем изготавливается из высокопрочного, высококогезивного силиконового геля, который в основном исключает случаи утечки наполнителя («просачивание силиконового геля») и миграции силиконового наполнителя. из кармана имплантата в другое место на теле женщины. Эти имплантаты обычно называют «имплантатами груди мармеладного медведя» из-за их твердой, эластичной консистенции, которая похожа на мармеладные конфеты. Исследования Опыт применения анатомических мягких когезионных силиконовых гелевых протезов в косметической и реконструктивной хирургии грудных имплантатов (2004) и Когезивные силиконовые гелевые имплантаты груди в эстетической и реконструктивной хирургии груди (2005) сообщили о низкой заболеваемости капсульная контрактура и разрыв устройства-оболочки; и более высокие показатели улучшенной медицинской безопасности и технической эффективности, чем у устройств грудных имплантатов раннего поколения.[97][98][99]
Структурированные имплантаты
Структурированные имплантаты были одобрены FDA и Министерством здравоохранения Канады в 2014 году в качестве третьей формы грудных имплантатов.[100] Структурированные имплантаты включают технологию имплантации как солевого раствора, так и силиконового геля. Наполнитель представляет собой физиологический раствор в случае разрыва и имеет естественное ощущение, как имплантаты из силиконового геля.[101] В имплантате используется внутренняя структура, которая состоит из ряда вложенных оболочек, поддерживающих верхний полюс, причем два просвета заполнены только физиологическим раствором. Имплант вставляется пустым, а затем один раз заполняется на место, что требует меньшего разреза, чем предварительно заполненные имплантаты.[100] Если один из просветов структурированного имплантата разрывается, он протекает и опорожняется. Другой просвет остается нетронутым, а имплант сдувается лишь частично, что упрощает удаление и замену эксплантата.[100]
Кормление грудью
Наличие грудных имплантатов в настоящее время не является противопоказанием для грудного вскармливания, и USFDA не признает никаких доказательств того, что эта практика может представлять проблемы для здоровья грудного ребенка.
Женщины с грудными имплантатами могут иметь функциональные проблемы с грудным вскармливанием; Маммопластика с периареолярными разрезами особенно часто вызывает затруднения при кормлении грудью. Операция также может повредить молочные протоки и нервы в области сосков и ареол.[102][103][104]
Функциональные трудности грудного вскармливания возникают, если хирург перерезает молочные протоки или основные нервы, иннервирующие грудь, или если молочные железы были повреждены иным образом. Повреждение молочного протока и нервов чаще возникает, если надрезы разрезают ткань возле соска. Молочные железы чаще всего поражаются подкожными имплантатами (под железой) и грудными имплантатами большого размера, которые защемляют молочные протоки и препятствуют оттоку молока. Грудные имплантаты малого размера и подмышечная имплантация вызывают меньше проблем с функцией груди; однако невозможно предсказать, сможет ли женщина, перенесшая увеличение груди, успешно кормить грудью, поскольку некоторые женщины могут кормить грудью после периареолярных разрезов и подкожного введения, а некоторые не могут кормить грудью после увеличения с помощью субмышечных и других типов хирургические разрезы.[104]
Маммография

Наличие радиологически непрозрачные грудные имплантаты (физиологический раствор или силикон) могут повлиять на рентгенологическую чувствительность маммограф, то есть изображение может не отображать присутствующие опухоли. В этом случае маммограмма в представлении Эклунда необходима для подтверждения наличия или отсутствия раковой опухоли, при этом грудной имплант вручную перемещается к грудной стенке, а грудь вытягивается вперед, чтобы маммограф мог визуализировать больший объем. внутренних тканей; тем не менее, примерно одна треть ткани груди остается неадекватно визуализированной, что приводит к увеличению числа маммограмм с ложноотрицательными результатами.[105][106]
В рак молочной железы исследования Рак увеличенной груди: диагностика и прогноз (1993) и Рак груди после увеличивающей маммопластики (2001) женщин с протезами грудных имплантатов не сообщили о значительных различиях в стадиях заболевания на момент постановки диагноза рака; прогнозы аналогичны для обеих групп женщин, при этом пациенты с расширенными группами имеют более низкий риск последующего рецидива рака или смерти.[107][108] И наоборот, использование имплантатов для реконструкция груди после рак молочной железы мастэктомия по-видимому, не оказывает отрицательного влияния на частоту случаев смерти от рака.[109] То, что у пациентов с имплантатами груди чаще диагностируют пальпируемые, но не более крупные, опухоли, указывает на то, что опухоли такого же размера легче пальпируются у пациентов с увеличенной грудной клеткой, что может компенсировать ухудшение изображения на маммограмме.[110] Легкая пальпация опухоли (опухолей) рака молочной железы является следствием истончения ткани молочной железы в результате сдавливания, врожденного в меньшей груди. априори (потому что они имеют меньшие объемы ткани), и что имплант служит рентгеноконтрастным основанием, по которому можно дифференцировать злокачественную опухоль.[111]
Грудной имплантат не имеет клинического значения лампэктомия операция по сохранению груди для женщин, у которых после процедуры имплантации развился рак груди, при этом грудной имплант не мешает лечению внешним лучевым излучением (XRT); кроме того, частота фиброза ткани молочной железы после лечения является обычным явлением, и, как следствие, повышенная частота капсульного контрактура.[112] Существуют предварительные данные о том, что у женщин, перенесших увеличение груди, прогноз рака груди хуже.[113] Использование имплантатов для реконструкция груди после рак молочной железы мастэктомия похоже, не оказывает отрицательного воздействия на смерть от рака.[109][114]
История

19 век
С конца девятнадцатого века грудные имплантаты использовались для хирургическим путем увеличить размер (объем), изменить форму (контур) и усилить ощущение (такт) женской груди. В 1895 году хирург Винченц Черни осуществил самую раннюю установку грудного имплантата, когда использовал аутологичный жировая ткань, собранный с доброкачественного поясничный липома, чтобы исправить асимметрию груди, из которой он удалил опухоль.[115] В 1889 году хирург Роберт Герсуни экспериментировал с парафин инъекции, с катастрофическими последствиями, возникающими из-за распада парафина на более мелкие тела после процедуры.[116]
20 век
С первой половины двадцатого века врачи использовали другие вещества в качестве наполнителей грудных имплантатов -слоновая кость, стеклянные шарики, молотые резинка, бык хрящ, Терилен шерсть, гуттаперча, Дикора, полиэтилен чипсы, Ивалон (поливиниловый спирт - губка из формальдегидного полимера), полиэтиленовый мешок с ивалоном, пенополиэфирная губка (Эфирон), ленты из полиэтиленовой ленты (Полистан), намотанные в клубок, полиэстер (губка из пенополиуритана) Протезы из эластичной резины и тефлон-силикон.[117]
В середине двадцатого века Мортон И. Берсон в 1945 году и Жак Малиниак в 1950 году выполняли увеличение груди с помощью лоскута, вращая ткань грудной стенки пациента в грудь, чтобы увеличить ее объем. Кроме того, на протяжении 1950-х и 1960-х годов пластические хирурги использовали синтетические наполнители, в том числе силикон инъекции, полученные около 50 000 женщин, из которых развился силикон. гранулемы и уплотнение груди, которое требовало лечения мастэктомия.[118] В 1961 году американские пластические хирурги Томас Кронин и Фрэнк Героу, а также Корпорация Dow Corning разработала первый силиконовый протез груди, заполненный силиконовым гелем; в свое время первая увеличивающая маммопластика была выполнена в 1962 году с использованием имплантата Cronin-Gerow, модель протеза 1963 года. В 1964 году французская компания Laboratoires Arion разработала и изготовила физиологический имплантат груди, заполненный физиологический раствор, а затем представили для использования в качестве медицинский прибор в 1964 г.[91]
Одобрение FDA
В 1988 году, через 26 лет после появления в 1962 году грудных имплантатов, заполненных силиконовым гелем, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) исследовало отказы грудных имплантатов и последующие осложнения, и переклассифицировали устройства грудных имплантатов как медицинские устройства класса III и потребовали от производителей документальных данных, подтверждающих безопасность и эффективность их устройств грудных имплантатов.[119] В 1992 году FDA наложило мораторий на силиконовые грудные имплантаты в США, потому что не было «адекватной информации, чтобы продемонстрировать, что грудные имплантаты безопасны и эффективны». Тем не менее, медицинский доступ к устройствам для имплантатов груди с силиконовым гелем продолжался для клинических исследований после мастэктомии. реконструкция груди, коррекция врожденных деформаций и замена сломанных силиконово-гелевых имплантатов. FDA потребовало от производителей данных клинических испытаний и разрешило им предоставлять грудные имплантаты Увеличение груди пациентов для статистических исследований, требуемых Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.[119] В середине 1992 года FDA одобрило дополнительный протокол исследования имплантатов, заполненных силиконовым гелем, для пациентов с реконструкцией груди и для пациентов, перенесших повторную операцию. Также в 1992 г. Корпорация Dow Corning, производитель силиконовых изделий и грудных имплантатов, объявил о прекращении производства пяти имплантатов класса силиконы, но продолжит производство 45 других силиконовых материалов медицинского назначения - три года спустя, в 1995 году, корпорация Dow Corning прекратила производство банкрот когда он столкнулся с крупными коллективными исками о различных заболеваниях.[119]
- В 1997 г. Министерство здравоохранения и социальных служб США (HHS) назначил Институт медицины (IOM) Национальная академия наук США (NAS) для изучения потенциальных рисков оперативного и послеоперационного осложнения от установки силиконовых грудных имплантатов. В обзоре IOM безопасности и эффективности грудных имплантатов, наполненных силиконовым гелем, сообщается, что «данные свидетельствуют о заболеваниях или состояниях, таких как соединительная ткань болезни, рак, неврологические заболевания или другие системные жалобы или состояния не чаще встречаются у женщин с грудными имплантатами, чем у женщин без имплантатов »последующие исследования и системный обзор не обнаружили причинной связи между силиконовыми грудными имплантатами и заболеванием.[119]

- В 1998 году FDA США одобрило протоколы дополнительных исследований имплантатов, заполненных силиконовым гелем, только для пациентов с реконструкцией груди и для пациентов, перенесших повторную операцию; а также одобрил исследование Dow Corning Corporation по исключению исследовательских устройств (IDE) для силиконовых гелевых имплантатов груди для ограниченного числа пациентов, перенесших операцию увеличения, реконструкции и повторной хирургии груди.[119]
- В 1999 г. Институт медицины опубликовал Безопасность силиконовых имплантатов груди (1999) исследование, в котором не сообщалось об отсутствии доказательств того, что устройства грудных имплантатов, заполненные физиологическим раствором и силиконовым гелем, вызывают системные проблемы со здоровьем; что их использование не создает новых рисков для здоровья или безопасности; и что местные осложнения являются «основной проблемой безопасности при использовании силиконовых грудных имплантатов» при различении рутинных и местных медицинских осложнений и системных проблем со здоровьем ».[119][120][121]
- В 2000 году FDA одобрило заявки на предварительную проверку грудных имплантатов (PMA), содержащих солевой раствор, содержащие данные о типе и частоте местных медицинских осложнений, с которыми сталкиваются пациенты, перенесшие операции на груди.[122] "Несмотря на осложнения, с которыми сталкиваются некоторые женщины, большинство из них все еще находятся в Корпорация Инамед и Mentor Corporation исследования, проведенные через три года, показали, что они довольны своими имплантатами ».[119] Предварительные разрешения на увеличение груди были предоставлены женщинам в возрасте от 18 лет и женщинам, которым требовалось реконструкция груди.[123][124]
- В 2006 году для Inamed Corporation и Mentor Corporation Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США сняло ограничения на использование силиконовых гелевых грудных имплантатов для реконструкции груди и увеличивающей маммопластики. Тем не менее, утверждение было условным после принятия мониторинга FDA, завершения 10-летних исследований женщин, у которых уже были грудные имплантаты, и завершения второго 10-летнего исследования безопасности грудных имплантатов. у 40 000 других женщин.[125] FDA предупредило общественность, что грудные имплантаты несут медицинский риск, и рекомендовало женщинам, которые Увеличение груди должен периодически проходить МРТ обследования для выявления признаков разрыва оболочки или утечки наполнителя, либо обоих условий; и распорядился предоставить пациентам, перенесшим операции на груди, подробные информационные буклеты, объясняющие медицинские риски использования силиконовых гелевых имплантатов груди.[119]
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США установило возрастные рамки для женщин, которым требуются грудные имплантаты; для реконструкции груди имплантаты, заполненные силиконовым гелем, и имплантаты, заполненные физиологическим раствором, были одобрены для женщин всех возрастов; для увеличения груди разрешены имплантаты с солевым раствором для женщин в возрасте 18 лет и старше; силиконовые имплантаты одобрены для женщин от 22 лет и старше.[126] Поскольку каждое устройство грудного имплантата сопряжено с различными медицинскими рисками, минимальный возраст пациента для имплантатов груди с солевым раствором отличается от минимального возраста пациента для силиконовых имплантатов груди - из-за утечки наполнителя и риска бесшумного разрыва оболочки; таким образом, периодические МРТ скрининговые осмотры являются рекомендуемым послеоперационным, последующим лечением для пациента.[126] В других странах, в Европе и Океании, политика национальных министерств здравоохранения по имплантации грудных имплантатов не одобряет периодическое обследование МРТ бессимптомных пациентов, а предлагает собственно пальпацию - с или без ультразвуковой скрининг - достаточный для большинства пациентов послеоперационный период лечения.
Смотрите также
- Грудь
- Увеличение груди (Увеличивающая маммопластика)
- Добавки для увеличения груди
- Реконструкция груди
- Пластика уменьшения груди
- Маммопластика
- Мастопексия (подтяжка груди)
- Поли имплантат Prothèse
- Грудные имплантаты из полипропилена
- Трансупупочное увеличение груди (ТУБА)
Рекомендации
- ^ «Риски и осложнения имплантатов груди». FDA. 21 октября 2019 г.. Получено 30 октября 2019.
- ^ Американское общество пластических хирургов (24 апреля 2014 г.), «Пять вещей, которые должны задать вопросы врачам и пациентам», Мудрый выбор: инициатива Фонд ABIM, Американское общество пластических хирургов, архив из оригинал 19 июля 2014 г., получено 25 июля 2014
- ^ Бринтон Л.А., Браун С.Л., Колтон Т., Бурич М.К., Любин Дж. (2000). «Характеристики группы женщин с имплантатами груди по сравнению с женщинами, которым требуются другие виды пластической хирургии». Пластическая и реконструктивная хирургия. 105 (3): 919–927. Дои:10.1097/00006534-200003000-00014. PMID 10724251. S2CID 32599107.
- ^ Jacobsen PH, Hölmich LR, McLaughlin JK, Johansen C, Olsen JH, Kjøller K, Friis S (2004). «Смертность и самоубийства среди датских женщин с косметическими грудными имплантатами». Arch. Междунар. Med. 164 (22): 2450–5. Дои:10.1001 / archinte.164.22.2450. PMID 15596635.
- ^ Молодой В.Л., Немечек Дж. Р., Немечек Д.А. (1994). «Эффективность увеличения груди: увеличение размера груди, удовлетворенность пациентов и психологические эффекты». Пластическая и реконструктивная хирургия. 94 (Декабрь): 958–969. Дои:10.1097/00006534-199412000-00009. PMID 7972484. S2CID 753343.
- ^ Креран CE, Франклин М.Э., Сарвер ДБ (2006). «Дисморфическое расстройство тела и косметическая хирургия». Пластическая и реконструктивная хирургия. 118 (Июль): 167e – 180e. Дои:10.1097 / 01.prs.0000242500.28431.24. PMID 17102719. S2CID 8925060.
- ^ Сарвер Д. Б., ЛаРосса Д., Бартлетт С. П., Низкий DW, Баки Л. П., Уитакер Л. А. (2003). «Проблемы изображения тела у пациентов с увеличением груди». Пластическая и реконструктивная хирургия. 112 (Июль): 83–90. Дои:10.1097 / 01.PRS.0000066005.07796.51. PMID 12832880. S2CID 45574374.
- ^ Chahraoui K, Danino A, Frachebois C, Clerc AS, Malka G (2006). «Эстетическая хирургия и качество жизни до и через четыре месяца после операции». Журнал долгосрочных эффектов медицинских имплантатов. 51 (3): 207–210. Дои:10.1016 / j.anplas.2005.07.010. PMID 16181718.
- ^ Cash TF, Duel LA, Perkins LL (2002). «Психосоциальные результаты женщин при увеличении груди с помощью имплантатов, заполненных силиконовым гелем: 2-летнее проспективное исследование». Пластическая и реконструктивная хирургия. 109 (Май): 2112–2121. Дои:10.1097/00006534-200205000-00049. PMID 11994621.
- ^ Фигероа-Хаас CL (2007). «Влияние маммопластики по увеличению груди на самооценку и сексуальность: количественный анализ». Сестринское дело в пластической хирургии. 27 (Март): 16–36. Дои:10.1097 / 01.PSN.0000264159.30505.c9. PMID 17356451. S2CID 23169107.
- ^ «Важная информация для женщин об увеличении груди с помощью имплантатов Inamed, заполненных силиконовым гелем» (PDF). 2006. Архивировано с оригинал (PDF) на 2007-01-03. Цитировать журнал требует
| журнал =(помощь) - ^ Гендель Н., Кордрей Т., Гутьеррес Дж, Дженсен Дж. А. (2006). «Долгосрочное исследование результатов, осложнений и удовлетворенности пациентов грудными имплантатами». Пластическая и реконструктивная хирургия. 117 (Март): 757–767. Дои:10.1097 / 01.prs.0000201457.00772.1d. PMID 16525261. S2CID 15228702.
- ^ «Имплантаты груди связаны с самоубийством в исследовании». Рейтер. 2007-08-08. В архиве из оригинала 21.12.2008.
- ^ Мэннинг А. (2007-08-06). «Грудные имплантаты связаны с более высоким уровнем самоубийств». USA Today. В архиве из оригинала от 18.03.2011. Получено 2010-04-26.
- ^ Бринтон Л.А., Любин Дж. Х., Бурич М. С., Колтон Т., Браун С. Л., Гувер Р. Н. (2001). «Риск рака в других местах, кроме груди, после увеличивающей маммопластики». Энн Эпидемиол. 11 (4): 248–56. Дои:10.1016 / с1047-2797 (00) 00223-4. PMID 11306343.
- ^ Koot VC, Peeters PH, Granath F, Grobbee DE, Nyren O (2003). «Общая смертность и смертность от конкретных причин среди шведских женщин с косметическими грудными имплантатами: проспективное исследование». BMJ. 326 (7388): 527–8. Дои:10.1136 / bmj.326.7388.527. ЧВК 150462. PMID 12623911.
- ^ Пуккала Е., Кульмала И., Хови С.Л., Хемминки Е., Кескимяки И., Пакканен М., Липворт Л., Бойс Д.Д., Маклафлин Д.К. (2003). «Причины смерти финских женщин с косметическими грудными имплантатами, 1971–2001 годы». Энн Пласт Сург. 51 (4): 339–42, обсуждение 343–4. Дои:10.1097 / 01.sap.0000080407.97677.A5. PMID 14520056. S2CID 34929987.
- ^ Вильнёв П.Дж., Холовати Э.Дж., Бриссон Дж., Се Л., Угнат А.М., Латулиппе Л., Мао Ю. (2006). «Смертность среди канадских женщин с косметическими имплантатами груди». Являюсь. J. Epidemiol. 164 (4): 334–41. Дои:10.1093 / aje / kwj214. PMID 16777929.
- ^ Бринтон Л.А., Любин Дж. Х., Мюррей М. С., Колтон Т., Гувер Р. Н. (2006). «Смертность среди пациентов с увеличивающей маммопластикой: обновленная информация». Эпидемиология. 17 (2): 162–9. Дои:10.1097 / 01.ede.0000197056.84629.19. PMID 16477256. S2CID 22285852.
- ^ Национальная процедурная статистика пластической хирургии, 2006 г., Арлингтон-Хайтс, Иллинойс, Американское общество пластических хирургов, 2007 г.
- ^ «Пластическая хирургия помогает повысить самооценку». Psych Central.com. В архиве из оригинала 19.06.2010.
- ^ Grippaudo FR, Renzi L, Costantino B, Longo B, Santanelli F (2013). «Поздняя односторонняя гематома после реконструкции груди с помощью имплантатов: клинический случай и обзор литературы». Эстетический хирургический журнал. 33 (6): 830–834. Дои:10.1177 / 1090820X13496249. PMID 23864111.
- ^ а б «Важная информация для женщин об увеличении груди с помощью имплантатов груди INAMED, наполненных силиконом» (PDF). 2006-11-03. Архивировано из оригинал (PDF) на 2007-01-03. Получено 2007-05-04.
- ^ «Важная информация для пациентов с аугментацией о грудных имплантатах Mentor MemoryGel с силиконовым гелем» (PDF). 2006-11-03. Архивировано из оригинал (PDF) 16 октября 2014 г.. Получено 11 октября 2014.
- ^ «Хирургия грудного имплантата с солевым раствором: принятие обоснованного решения (Mentor Corporation)». Справочник FDA для потребителей грудных имплантатов - 2004 г.. 2004-01-13. Архивировано из оригинал на 2006-11-26. Получено 2007-05-04.
- ^ "НОВОСТИ FDA". В архиве из оригинала 2011-11-03. Получено 2011-11-09.
- ^ Breiting VB, Hölmich LR, Brandt B, Fryzek JP, Wolthers MS, Kjøller K, McLaughlin JK, Wiik A, Friis S (2004). «Долгосрочное состояние здоровья датских женщин с силиконовыми имплантатами груди». Пластическая и реконструктивная хирургия. 114 (1): 217–226. Дои:10.1097 / 01.PRS.0000128823.77637.8A. PMID 15220596. S2CID 20584928.
- ^ Бринтон Л.А., Любин Дж. Х., Мюррей М. С., Колтон Т., Гувер Р. Н. (2006). «Смертность среди пациентов с увеличивающей маммопластикой: обновление». Эпидемиология. 17 (2): 162–9. Дои:10.1097 / 01.ede.0000197056.84629.19. PMID 16477256. S2CID 22285852.
- ^ Вильнёв П.Дж., Холовати Е.Дж., Бриссон Дж., Се Л., Угнат А.М., Латулиппе Л., Мао Ю. (июнь 2006 г.). «Смертность среди канадских женщин с косметическими имплантатами груди». Американский журнал эпидемиологии. 164 (4): 334–341. Дои:10.1093 / aje / kwj214. PMID 16777929.
- ^ Бринтон Л.А., Мэлоун К.Э., Коутс Р.Дж., Шенберг Дж.Б., Суонсон, Калифорния, Далинг Дж.Р., Стэнфорд Дж.Л. (1996). «Увеличение и уменьшение груди: результаты исследования случай-контроль рака груди». Пластическая и реконструктивная хирургия. 97 (2): 269–275. Дои:10.1097/00006534-199602000-00001. PMID 8559808. S2CID 29456173.
- ^ Бенадиба Л. (2004). "Histoire des protheses mammaires" (На французском). Архивировано из оригинал 29 января 2015 г.. Получено 12 октября 2015.
- ^ Информационный буклет по грудному имплантату (PDF) (4-е изд.). Канберра: Австралийское Содружество. 2001 г. ISBN 0642735794. Архивировано из оригинал (PDF) на 2007-01-01. Получено 2006-12-29.
- ^ "Немецкое общество сенологии, Декларация консенсуса по безопасности силиконовых грудных имплантатов - 24 сентября 1998 г.". 1998 г. Цитировать журнал требует
| журнал =(помощь) - ^ Яновский Е.С., Куппер Л.Л., Хулка Б.С. (2000). «Мета-анализ связи между силиконовыми грудными имплантатами и риском заболеваний соединительной ткани». Медицинский журнал Новой Англии. 342 (11): 781–790. Дои:10.1056 / NEJM200003163421105. PMID 10717013.
- ^ [1] В архиве 27 декабря 2005 г. Wayback Machine
- ^ [2] В архиве 23 июня 2006 г. в г. Wayback Machine
- ^ Тагвелл П., Уэллс Дж., Петерсон Дж., Уэлч В., Пейдж Дж., Дэвисон К., МакГоуэн Дж., Рэмрот Д., Ши Б. (2001). «Вызывают ли силиконовые грудные имплантаты ревматологические заболевания? Систематический обзор назначенной судом Национальной научной комиссии». Ревматоидный артрит. 44 (11): 2477–84. Дои:10.1002 / 1529-0131 (200111) 44:11 <2477 :: AID-ART427> 3.0.CO; 2-Q. PMID 11710703.
- ^ (PDF) https://web.archive.org/web/20030829114951/http://www.eucomed.be/docs/STOA-SILICONE%20BREAST%20IMPLANT%20Study%20update-30May03.pdf. Архивировано из оригинал (PDF) на 2003-08-29. Получено 2019-01-28. Отсутствует или пусто
| название =(помощь) - ^ Нойан-Лоренц С., Феделес Дж., Эйзенман-Кляйн М., Кинни Б., Каннингем Б.Л. (2001). «Восьмое согласованное заявление о позиции IQUAM: трансатлантические инновации, апрель 2009 г.». Пластическая и реконструктивная хирургия. 127 (3): 1368–75. Дои:10.1097 / PRS.0b013e318206312e. PMID 21364439. S2CID 29112694.
- ^ Браун С.Л., Миддлтон М.С., Берг В.А., Су М.С., Пеннелло Г. (2000). «Распространенность разрыва имплантатов груди из силиконового геля, выявленная на МРТ в популяции женщин в Бирмингеме, Алабама». Американский журнал рентгенологии. 175 (4): 1057–1064. Дои:10.2214 / ajr.175.4.1751057. PMID 11000165.
- ^ Уокер PS, Стены B, Мерфи Д.К. (2009). «Имплантаты груди Natrelle, заполненные физиологическим раствором: проспективное 10-летнее исследование». Журнал эстетической хирургии. 29 (1): 19–25. Дои:10.1016 / j.asj.2008.10.001. PMID 19233001.
- ^ Hölmich LR, Vejborg IM, Conrad C, Sletting S, Høier-Madsen M, Fryzek JP, McLaughlin JK, Kjøller K, Wiik A, Friis S (2004). «Необработанный разрыв силиконового имплантата груди». Пластическая и реконструктивная хирургия. 114 (1): 204–214. Дои:10.1097 / 01.PRS.0000128821.87939.B5. PMID 15220594. S2CID 25947224.
- ^ Кацин В.Е., Сентено Дж. А., Фенг Л. Дж., Кили М., Маллик Ф. Г. (2001). «Патология лимфатических узлов у пациентов с имплантатами груди: гистологическая и спектроскопическая оценка». Американский журнал хирургической патологии. 29 (4): 506–11. Дои:10.1097 / 01.pas.0000155145.60670.e4. PMID 15767806. S2CID 31982669. Архивировано из оригинал (—Академический поиск) 24 мая 2009 г.
- ^ «Исследование разрыва имплантатов груди, заполненных силиконовым гелем (компонент МРТ)». Справочник FDA для потребителей грудных имплантатов - 2004 г.. 2000-05-22. В архиве из оригинала от 09.06.2007. Получено 2007-05-04.
- ^ а б c «Местные осложнения». Справочник FDA для потребителей грудных имплантатов - 2004 г.. 2004-06-08. Архивировано из оригинал на 2007-05-13. Получено 2007-05-04.
- ^ МРТ разорванного силиконового грудного имплантата В архиве 2013-09-26 в Wayback Machine 2013-04-05
- ^ Hölmich LR, Friis S, Fryzek JP, Vejborg IM, Conrad C, Sletting S, Kjøller K, McLaughlin JK, Olsen JH (2003). «Частота разрыва силиконового имплантата груди». Arch. Surg. 138 (7): 801–806. Дои:10.1001 / archsurg.138.7.801. PMID 12860765.
- ^ Hedén P, Nava MB, van Tetering JP, Magalon G, Fourie le R, Brenner RJ, Lindsey LE, Murphy DK, Walker PS (2006). «Распространенность разрыва в силиконовых грудных имплантатах Inamed». Пластическая и реконструктивная хирургия. 118 (2): 303–308. Дои:10.1097 / 01.prs.0000233471.58039.30. PMID 16874191. S2CID 30442865.
- ^ «Краткое изложение клинических проблем FDA (документ MS Word)». В архиве из оригинала 2008-03-08.
- ^ Каннингем Б., МакКью Дж. (2009). «Безопасность и эффективность имплантатов Mentor's MemoryGel через 6 лет». Пластическая и реконструктивная хирургия. 33 (3): 440–444. Дои:10.1007 / s00266-009-9364-6. PMID 19437068. S2CID 25722841.
- ^ Хеден П., Боне Б., Мерфи Д.К., Сликтон А., Уокер П.С. (2006). «Когезивные силиконовые грудные имплантаты Style 410: безопасность и эффективность через 5–9 лет после имплантации». Пластическая и реконструктивная хирургия. 118 (6): 1281–1287. Дои:10.1097 / 01.prs.0000239457.17721.5d. PMID 17051096. S2CID 34380204.
- ^ Hölmich LR, Fryzek JP, Kjøller K, Breiting VB, Jørgensen A, Krag C, McLaughlin JK (2005). «Диагностика разрыва силиконового грудного имплантата: клинические результаты по сравнению с результатами магнитно-резонансной томографии». Анналы пластической хирургии. 54 (6): 583–589. Дои:10.1097 / 01.sap.0000164470.76432.4f. PMID 15900139. S2CID 39525474.
- ^ «Консультативная группа экспертов по грудным имплантатам: протокол судебных заседаний». HealthCanada. 29 сентября 2005 г. Архивировано из оригинал на 2007-11-07. Получено 2007-05-04.
- ^ Сонг JW, Ким HM, Bellfi LT, Chung KC (2011). «Влияние систематических ошибок дизайна исследования на диагностическую точность магнитно-резонансной томографии для обнаружения разрывов силиконового имплантата груди: метаанализ». Пластическая и реконструктивная хирургия. 127 (3): 1029–1044. Дои:10.1097 / PRS.0b013e3182043630. ЧВК 3080104. PMID 21364405.
- ^ AFP (18 сентября 2011 г.). «Грудные имплантаты безопасны, но не для жизни: эксперты из США». Независимый. В архиве из оригинала от 3 августа 2016 г.
- ^ Барнсли Г.П., Сигурдсон Л.Дж., Барнсли С.Е. (2006). «Имплантаты груди с текстурированной поверхностью в профилактике капсульной контрактуры у пациентов с увеличением груди: метаанализ рандомизированных контролируемых испытаний». Пластическая и реконструктивная хирургия. 117 (7): 2182–2190. Дои:10.1097 / 01.prs.0000218184.47372.d5. PMID 16772915. S2CID 35420582.
- ^ Вонг СН, Сэмюэл М, Тан Б.К., Сонг С (2006). «Капсульная контрактура при субгландулярном увеличении груди с текстурированными и гладкими имплантатами груди: систематический обзор». Пластическая и реконструктивная хирургия. 118 (5): 1224–1236. Дои:10.1097 / 01.prs.0000237013.50283.d2. PMID 17016195. S2CID 29643167.
- ^ Гендель Н., Гутьеррес Дж. (Май 2006 г.). «Долгосрочная безопасность и эффективность грудных имплантатов, покрытых полиуретановой пеной». Журнал эстетической хирургии. 26 (3): 265–274. Дои:10.1016 / j.asj.2006.04.001. PMID 19338905.
- ^ Младик Р.А. (1993). ""«Техника увеличения груди подмышечным солевым раствором без прикосновения». Журнал эстетической хирургии. 17 (3): 183–192. Дои:10.1007 / BF00636260. PMID 8213311. S2CID 39767802.
- ^ Адамс В.П., Риос Дж. Л., Смит С. Дж. (2006). «Улучшение результатов лечения пациентов в эстетической и реконструктивной хирургии груди с использованием трехкратного орошения груди антибиотиками: шестилетнее проспективное клиническое исследование». Пластическая и реконструктивная хирургия. 117 (1): 30–6. Дои:10.1097 / 01.prs.0000185671.51993.7e. PMID 16404244. S2CID 35238465.
- ^ Planas J, Cervelli V, Planas G (2001). «Пятилетний опыт ультразвукового лечения контрактур груди». Эстетическая пластическая хирургия. 25 (2): 89–93. Дои:10.1007 / s002660010102. PMID 11349308. S2CID 2784003.
- ^ Шлезингер С.Л., Элленбоген Р., Десвинь М.Н., Свехлак С., Хек Р. (2002). «Зафирлукаст (Accolate): новый метод лечения капсульной контрактуры». Эстетический пласт. Surg. 22 (4): 329–36. Дои:10.1067 / май.2002.126753. PMID 19331987.
- ^ Скудери Н., Маццоччи М., Фиорамонти П., Бистони Г. (2006). «Влияние зафирлукаста на капсулярную контрактуру: предварительный отчет». Эстетический пласт. Surg. 30 (5): 513–520. Дои:10.1007 / s00266-006-0038-3. PMID 16977359. S2CID 251008.
- ^ Сильвер H (1982). «Уменьшение капсулярной контрактуры с помощью двухэтапной увеличивающей маммопластики и импульсной электромагнитной энергии (диапульсотерапия)». Пластическая и реконструктивная хирургия. 69 (5): 802–805. Дои:10.1097/00006534-198205000-00013. PMID 7071225. S2CID 8451166.
- ^ Теббетц Ж.Б. (октябрь 2006 г.). «Очки критериев для удаления грудного имплантата без замены и критерии минимизации повторных операций после увеличения груди». Пластическая и реконструктивная хирургия. 114 (5): 1258–1262. Дои:10.1097 / 01.prs.0000136802.91357.cf. PMID 15457046.
- ^ Теббетц Ж.Б. (декабрь 2006 г.). «Достижение нулевого процента повторных операций в течение 3 лет в ходе предварительного одобрения исследования 50 последовательных случаев аугментации маммопластики». Пластическая и реконструктивная хирургия. 118 (6): 1453–7. Дои:10.1097 / 01.prs.0000239602.99867.07. PMID 17051118. S2CID 27630646.
- ^ Липуорт Л., Холмич Л. Р., Маклафлин Дж. К. (май 2011 г.). «Силиконовые грудные имплантаты и заболевание соединительной ткани: нет ассоциации». Семинары по иммунопатологии. 33 (3): 287–94. Дои:10.1007 / s00281-010-0238-4. PMID 21369953. S2CID 22297654.
- ^ Arepalli SR, Bezabeh S, Brown SL (2002). «Аллергическая реакция на платину в силиконовых грудных имплантатах». Журнал долгосрочных эффектов медицинских имплантатов. 12 (4): 299–306. Дои:10.1615 / jlongtermeffmedimplants.v12.i4.80. PMID 12627791.
- ^ «Справочная информация FDA о платине в силиконовых грудных имплантатах». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 16 июня 2006 г. Архивировано с оригинал 15 июля 2006 г.
- ^ Комиссар, канцелярия. «Предупреждения о безопасности медицинских изделий для людей - грудные имплантаты: обновленная информация - анапластическая крупноклеточная лимфома, связанная с имплантатом груди (BIA-ALCL)». www.fda.gov. В архиве из оригинала 28 апреля 2018 г.. Получено 28 апреля 2018.
- ^ Swerdlow, Стивен Х .; Кампо, Элиас; Пилери, Стефано А .; Харрис, Нэнси Ли; Штейн, Харальд; Зиберт, Райнер; Адвани, Ранджана; Гильмини, Микеле; Salles, Gilles A .; Зеленец, Андрей Д .; Джефф, Элейн С. (19 мая 2016 г.). «Пересмотр 2016 г. классификации лимфоидных новообразований Всемирной организации здравоохранения». Кровь. 127 (20): 2375–2390. Дои:10.1182 / кровь-2016-01-643569. ISSN 0006-4971. ЧВК 4874220. PMID 26980727.
- ^ Здравоохранение, Центр приборов и радиологии. "Грудные имплантаты - отчеты о медицинских устройствах анапластической крупноклеточной лимфомы, связанной с грудным имплантатом". www.fda.gov. В архиве из оригинала 28 апреля 2018 г.. Получено 28 апреля 2018.
- ^ Miranda RN, Aladily TN, Prince HM, Kanagal-Shamanna R, de Jong D, Fayad LE и др. (Январь 2014). «Анапластическая крупноклеточная лимфома, связанная с имплантатом груди: длительное наблюдение за 60 пациентами». Журнал клинической онкологии. 32 (2): 114–20. Дои:10.1200 / JCO.2013.52.7911. ЧВК 4062709. PMID 24323027.
- ^ а б Клеменс, Марк. "Анапластическая крупноклеточная лимфома, связанная с имплантатом груди (BIA-ALCL) В архиве 2017-03-26 в Wayback Machine " (2017).
- ^ Клеменс М.В., Хорвиц С.М. (март 2017 г.). «Консенсусное руководство NCCN по диагностике и лечению анапластической крупноклеточной лимфомы, связанной с грудным имплантатом». Журнал эстетической хирургии. 37 (3): 285–289. Дои:10.1093 / asj / sjw259. PMID 28184418.
- ^ "Факты об ALCL, связанных с имплантатами | Фонд доктора медицины Андерсона". www.mdanderson.org. В архиве из оригинала на 2017-12-09. Получено 2017-12-08.
- ^ "ALCL, связанный с грудным имплантатом: ПРОФИЛЬНЫЙ проект | Фонд пластической хирургии". www.thepsf.org. В архиве из оригинала на 2017-05-07. Получено 2017-04-25.
- ^ Джонсон GW, Христос JE (1993). «Эндоскопическое увеличение груди: трансумбиликальное введение имплантатов груди, заполненных физиологическим раствором». Пластическая и реконструктивная хирургия. 92 (5): 801–8. Дои:10.1097/00006534-199392050-00004. PMID 8415961.
- ^ Валлах С.Г. (2004). «Максимальное использование разреза для абдоминопластики». Пластическая и реконструктивная хирургия. 113 (1): 411–417. Дои:10.1097 / 01.PRS.0000091422.11191.1A. PMID 14707667. S2CID 44430032.
- ^ Граф Р.М., Бернардес А., Риппель Р., Араухо Л. Р., Дамасио Р. К., Ауэрсвальд А. (2003). «Субфасциальный грудной имплантат: новая процедура». Пластическая и реконструктивная хирургия. 111 (2): 904–908. Дои:10.1097 / 01.PRS.0000041601.59651.15. PMID 12560720.
- ^ Теббетц Дж.Б. (2004). «Обеспечивает ли фасция дополнительное значимое прикрытие грудного имплантата?». Пластическая и реконструктивная хирургия. 113 (2): 777–779. Дои:10.1097 / 01.PRS.0000104516.13465.96. PMID 14758271.
- ^ Теббетц Дж.Б. (2002). «Система выбора грудного имплантата на основе характеристик тканей пациента и динамики мягких тканей имплантата». Пластическая и реконструктивная хирургия. 109 (4): 1396–1409. Дои:10.1097/00006534-200204010-00030. PMID 11964998.
- ^ Пачик П.Т., Нельсон CE, Вернер С. (2008). «Обезболивание при увеличивающей маммопластике: безопасность и эффективность постоянных катетеров у 644 последовательных пациентов». Эстет Сург Дж.. 28 (3): 279–84. Дои:10.1016 / j.asj.2008.02.001. PMID 19083538.
- ^ Пачик П.Т., Нельсон CE, Вернер С. (2008). «Обезболивание при увеличивающей маммопластике с использованием постоянных катетеров у 687 последовательных пациентов: анализ данных». Эстет Сург Дж.. 28 (6): 631–41. Дои:10.1016 / j.asj.2008.09.001. PMID 19083591.
- ^ Теббетц Дж.Б. (2002). «Система выбора грудного имплантата на основе характеристик тканей пациента и динамики мягких тканей имплантата». Пласт. Реконстр. Surg. 109 (4): 1396–409, обсуждение 1410–5. Дои:10.1097/00006534-200204010-00030. PMID 11964998.
- ^ Теббетс Дж. Б., Адамс В. П. (2005). «Пять важнейших решений при увеличении груди с использованием пяти измерений за 5 минут: процесс поддержки принятия решений высокой пятеркой». Пласт. Реконстр. Surg. 116 (7): 2005–16. Дои:10.1097 / 01.prs.0000191163.19379.63. PMID 16327616. S2CID 11180810.
- ^ Теббетц Дж.Б. (2002). «Достижение предсказуемого 24-часового возвращения к нормальной деятельности после увеличения груди: часть I. Совершенствование практики с использованием принципов исследования движения и времени». Пласт. Реконстр. Surg. 109 (1): 273–90, обсуждение 291–2. Дои:10.1097/00006534-200201000-00044. PMID 11786826. S2CID 26419990.
- ^ Теббетц Дж.Б. (2002). «Достижение предсказуемого 24-часового возвращения к нормальной деятельности после увеличения груди: Часть II. Подготовка пациентов, усовершенствованные хирургические методы и инструменты». Пласт. Реконстр. Surg. 109 (1): 293–305, обсуждение 306–7. Дои:10.1097/00006534-200201000-00046. PMID 11786828. S2CID 21392313.
- ^ «Выбор грудных имплантатов» (Интернет). Миннеаполисская пластическая хирургия, ООО. В архиве из оригинала 24 ноября 2016 г.. Получено 23 ноября 2016.
- ^ Заннис Дж (2017). Сказки для Тальякоцци: взгляд изнутри на современную пластическую хирургию. ISBN 9781524659073. Получено 7 июн 2019.
- ^ а б Стивенс WG, Хирш Э.М., Стокер Д.А., Коэн Р. (2006). «In vitro дефляция предварительно заполненных солевых имплантатов груди». Пластическая и реконструктивная хирургия. 118 (2): 347–349. Дои:10.1097 / 01.prs.0000227674.65284.80. PMID 16874200. S2CID 41156555.
- ^ Арион Х.Г. (1965). «Ретромаммарный протез». C R Société Française de Gynécologie. 5.
- ^ Айзенберг Т.С. (2009). «Силиконовые гелевые имплантаты вернулись - и что?». Американский журнал косметической хирургии. 26: 5–7. Дои:10.1177/074880680902600103. S2CID 136191732.
- ^ Кронин Т.Д., Геров Ф.Дж. (1963). «Аугментационная маммопластика: новый« естественный »протез. Серия международных конгрессов Excerpta Medica. 66: 41.
- ^ Луу Х.М., Хаттер Дж. К., Бушар Х. Ф. (1998). «Фармакокинетическая модель на физиологической основе для 2,4-толуолдиамина, выщелоченного из имплантатов груди, покрытых полиуретановой пеной». Environ Health Perspect. 106 (7): 393–400. Дои:10.2307/3434066. JSTOR 3434066. ЧВК 1533137. PMID 9637796.
- ^ Хестер Т.Р., Теббетс Дж.Б., Максвелл Г.П. (2001). "Протез молочной железы с полиуретановым покрытием: факты и вымысел (II): взгляд назад и взгляд вперед". Клиническая пластическая хирургия. 28 (3): 579–86. Дои:10.1016 / S0094-1298 (20) 32397-X. PMID 11471963.
- ^ Браун М.Х., Шенкер Р., Сильвер С.А. (2005). «Когезивные силиконовые гелевые имплантаты груди в эстетической и реконструктивной хирургии груди». Пластическая и реконструктивная хирургия. 116 (3): 768–779, обсуждение 779–1. Дои:10.1097 / 01.prs.0000176259.66948.e7. PMID 16141814. S2CID 35392851.
- ^ Fruhstorfer BH, Hodgson EL, Malata CM (2004). «Ранний опыт использования анатомических мягких когезионных протезов из силиконового геля в косметической и реконструктивной хирургии грудных имплантатов». Анналы пластической хирургии. 53 (6): 536–542. Дои:10.1097 / 01.sap.0000134508.43550.6f. PMID 15602249. S2CID 24661896.
- ^ Хеден П., Джернбек Дж, Хобер М. (2001). «Увеличение груди с помощью имплантатов из анатомического когезионного геля: крупнейший в мире опыт». Клиники пластической хирургии. 28 (3): 531–552. Дои:10.1016 / S0094-1298 (20) 32393-2. PMID 11471959.
- ^ а б c Нихтер Л.С., Хардести Р.А., Anigian GM (июль 2018 г.). «Структурированные грудные имплантаты IDEAL IMPLANT: результаты основного исследования через 6 лет». Пластическая и реконструктивная хирургия. 142 (1): 66–75. Дои:10.1097 / PRS.0000000000004460. ЧВК 6045953. PMID 29489559.
- ^ «Какие типы грудных имплантатов доступны?». Американское общество пластических хирургов.
- ^ Кормление грудью после операции на груди В архиве 2010-12-30 на Wayback Machine, La Leche League, содержит ссылки.
- ^ Грудное вскармливание и грудные имплантаты В архиве 2010-12-31 на Wayback Machine, Избранная библиография, апрель 2003 г., Центр информации по грудному вскармливанию LLLI.
- ^ а б Неорганическое молоко: может ли Кендра Уилкинсон кормить грудью своего ребенка, даже если у нее есть имплантаты? В архиве 2010-01-25 на Wayback Machine, Кристофер Бим, Slate.com, 11 декабря 2009 г.
- ^ Handel N, Silverstein MJ, Gamagami P, Jensen JA, Collins A (1992). «Факторы, влияющие на маммографическую визуализацию груди после увеличивающей маммопластики». JAMA. 268 (14): 1913–1917. Дои:10.1001 / jama.268.14.1913. PMID 1404718.
- ^ О'Киф-младший, Уилкинсон Дж. М., Спуур К. М. (июнь 2020 г.). «Текущая практика маммографической визуализации увеличенной груди в Австралии». Журнал медицинских радиационных наук. 67 (2): 102–110. Дои:10.1002 / jmrs.374. ЧВК 7276184. PMID 31981297.
- ^ Кларк С. П., Петерс Г. Н., О'Брайен К. М. (1993). «Рак увеличенной груди: диагностика и прогноз». Рак. 72 (7): 2170–4. Дои:10.1002 / 1097-0142 (19931001) 72: 7 <2170 :: AID-CNCR2820720717> 3.0.CO; 2-1. PMID 8374874.
- ^ Скиннер К.А., Сильберман Х., Догерти В., Гамагами П., Вайсман Дж., Спосто Р., Сильверштейн М.Дж. (2001). «Рак груди после увеличивающей маммопластики». Энн Сург Онкол. 8 (2): 138–44. Дои:10.1007 / s10434-001-0138-х. PMID 11258778. S2CID 26010159.
- ^ а б Le GM, компакт-диск О'Мэлли, Glaser SL, Lynch CF, Stanford JL, Keegan TH, West DW (2005). «Имплантаты груди после мастэктомии у женщин с ранней стадией рака груди: распространенность и влияние на выживаемость». Рак груди Res. 7 (2): R184–93. Дои:10.1186 / bcr974. ЧВК 1064128. PMID 15743498.
- ^ Гендель Н, Сильверштейн MJ (2006). «Диагностика рака молочной железы и прогноз у женщин с аугментацией». Пластическая и реконструктивная хирургия. 118 (3): 587–93. Дои:10.1097 / 01.prs.0000233038.47009.04. PMID 16932162. S2CID 36277679.
- ^ Каннингем Б. (2006). «Диагностика и прогноз рака груди у женщин с расширенными функциями - обсуждение». Пластическая и реконструктивная хирургия. 118 (3): 594–595. Дои:10.1097 / 01.prs.0000233047.87102.8e.
- ^ Schwartz GF, Veronesi U, Clough KB, Dixon JM, Fentiman IS, Heywang-Köbrunner SH, Holland R, Hughes KS, Mansel RE, Margolese R, Mendelson EB, Olivotto IA, Palazzo JP, Solin LJ (2006). «Консенсусная конференция по сохранению груди». JACAS. 203 (2): 198–207. Дои:10.1016 / j.jamcollsurg.2006.04.009. PMID 16864033.
- ^ Lavigne E, Holowaty EJ, Pan SY, Villeneuve PJ, Johnson KC, Fergusson DA и др. (Апрель 2013). «Выявление рака груди и выживаемость среди женщин с косметическими имплантатами груди: систематический обзор и метаанализ наблюдательных исследований». BMJ. 346 (29 апреля): f2399. Дои:10.1136 / bmj.f2399. PMID 23637132.
- ^ Hwang ES, Lichtensztajn DY, Gomez SL, Fowble B, Clarke CA (апрель 2013 г.). «Выживаемость после лампэктомии и мастэктомии при ранней стадии инвазивного рака груди: влияние возраста и статуса рецепторов гормонов». Рак. 119 (7): 1402–11. Дои:10.1002 / cncr.27795. ЧВК 3604076. PMID 23359049.
- ^ Черни V (1895). "Plastischer Ersatz der Brusthus durch ein Lipoma". Zentralblatt für Chirurgie. 27: 72.
- ^ Глиценштейн Дж (апрель 2007 г.). «[Первые« наполнители », вазелин и парафин. От чуда к катастрофе]». Анналы хирургической пластической и эстетической медицины. 52 (2): 157–61. Дои:10.1016 / j.anplas.2006.05.003. PMID 16860452.
- ^ Комитет по безопасности силиконовых грудных имплантатов Института медицины (США), Бондюрант С., Эрнстер В., Хердман Р. и др. (Комитет по безопасности силиконовых грудных имплантатов) (1999). Бондюран С., Эрнстер В., Хердман Р. (ред.). Безопасность силиконовых имплантатов груди. Институт медицины. п. 21. Дои:10.17226/9602. ISBN 0-309-06532-1. PMID 20669503. В архиве из оригинала от 13.03.2007.
- ^ Андерсон Н. (1997). «Судебная практика: уроки спора о силиконовых грудных имплантатах». Обзор права Нью-Йоркской школы права. 41 (2): 401–07.
- ^ а б c d е ж грамм час Справочник FDA для потребителей грудных имплантатов - 2004 г. В архиве 2008-09-17 на Wayback Machine
- ^ Комитет по безопасности силиконовых грудных имплантатов Института медицины (США), Bondurant S, Ernster V, Herdman R (1999). Безопасность силиконовых грудных имплантатов - The National Academies Press. nap.edu. Дои:10.17226/9602. ISBN 978-0-309-15740-7. PMID 20669503.
- ^ Григг М., Бондюрант С., Эрнстер В.Л., Хердман Р. (2000). Григг М., Бондюран С., Эрнстер В.Л., Хердман Р. (ред.). Информация для женщин о безопасности силиконовых имплантатов груди - The National Academies Press. nap.edu. Дои:10.17226/9618. ISBN 978-0-309-06593-1. PMID 20669498.
- ^ Исследование FDA В архиве 13 января 2008 г. Wayback Machine
- ^ «Утверждение FDA». fda.gov. В архиве из оригинала 30 марта 2009 г.. Получено 28 апреля 2018.
- ^ «Утверждение FDA». fda.gov. В архиве из оригинала 26 мая 2009 г.. Получено 28 апреля 2018.
- ^ «FDA одобряет имплантаты груди, заполненные силиконовым гелем». FDA. В архиве из оригинала от 26.07.2008. Получено 2008-07-01.
- ^ а б «Вопросы и ответы по грудному имплантату». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Октябрь 2010. Архивировано с оригинал на 12.11.2010.