Дикарбонил - Dicarbonyl
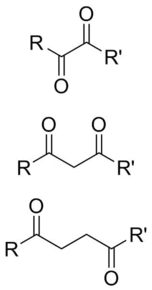
А дикарбонил это молекула содержащий два карбонил (C = O) группы. Хотя этот термин может относиться к любому органическое соединение содержащий две карбонильные группы, он используется более конкретно для описания молекул, в которых оба карбонила находятся достаточно близко друг к другу, чтобы их реакционная способность изменялась, таких как 1,2-, 1,3- и 1,4-дикарбонилы. Их свойства часто отличаются от свойств монокарбонилов, поэтому они обычно считаются собственными функциональными группами. Эти соединения могут иметь симметричные или несимметричные заместители на каждом карбониле, а также могут быть функционально симметричными (диальдегиды, дикетоны, диэфиры, и т.п.) или несимметричные (кетоэфиры, кетокислоты, и т.п.).
1,2-дикарбонилы
1,2-диальдегид
Единственный 1,2-диальдегид - это глиоксаль, (CHO)2. Как и многие алкилдиальдегиды, глиоксаль встречается почти исключительно в виде его гидрата и его олигомеров. Эти производные часто ведут себя как альдегид. Глиоксаль легко конденсируется с амины. Благодаря таким реакциям он является предшественником многих гетероциклы, например имидазолы.

1,2-дикетоны
Основной дикетон - это диацетил, также известный как 2,3-бутандион, CH3С (О) С (О) СН3. 1,2-дикетоны часто образуются в результате окисления (дегидрирования) диолы:[1]
- RCH (OH) CH (OH) R → RC (O) C (O) R + 2 Н2
2,3-Бутандион, 2,3-пентандион и 2,3-гександион в небольших количествах содержатся в различных продуктах питания. Они используются в качестве ароматических компонентов в безалкогольных напитках и в выпечке.[1] Бензил, (PhCO)2, - соответствующее производное дифенила.
Отличительной особенностью 1,2-дикетонов является длинная связь С-С, связывающая карбонильные группы. Это расстояние связи составляет около 1,54 Å по сравнению с 1,45 Å для соответствующей связи в 1,3-бутадиен. Эффект объясняется отталкиванием между частичными положительными зарядами карбонильных атомов углерода.[2]
1,2-дикетоны конденсируются со многими бифункциональными нуклеофилами, такими как мочевина и тиомочевина давать гетероциклы. Конденсация с ароматическими аминами дает дикетимин ((RC = NAr)2).
В случаях 1,2-циклогександион и 1,2-циклопентандион, то энол примерно на 1-3 ккал / моль более стабильна, чем дикетоформа.[3]
1,2-диэфиры и двухосновные кислоты
Щавелевая кислота и его сложные эфиры определяют это семейство соединений. Двухосновная кислота производится в промышленности путем окисления сахарных отходов. Встречается в природе (в виде сопряженной основы), особенно у представителей видов растений. Оксалис. Конденсация диэфиров с диамины дает циклические диамиды.
1,2-кето- и формилкарбоновые кислоты
Пировиноградная кислота (CH3C (O) CO2H) является исходной 2-кетокислотой. Его сопряженное основание, пируват (CH3C (O) CO2−), является составной частью цикл лимонной кислоты и продукт метаболизма глюкозы (гликолиз ). Соответствующая альдегидная кислота представляет собой глиоксалевая кислота (HC (O) CO2ЧАС).
1,3-дикарбонилы
1,3-диальдегиды
Исходный 1,3-диальдегид - это малоновый диальдегид (CH2(CHO)2). Как и большинство диальдегидов, он редко встречается как таковой. Вместо этого с ним обращаются почти исключительно как с его гидратом, метилацеталем и его олигомерами. Эти производные часто ведут себя как родительские. Известно много 2-замещенных производных. Их часто получают путем алкилирования энолировать малонового диальдегида.
1,3-дикетоны
Важным членом является ацетилацетон, CH3C (O) CH2C (O) CH3. Димедон представляет собой циклический 1,3-дикетон. Ацетилацетон получают промышленным способом путем термической перегруппировки изопропенилацетата.[1] Другой циклический 1,3-дикетон - это 2,2,4,4-тетраметилциклобутандион, который является предшественником полезного диол.
- CH2(CH3) COC (O) Me → MeC (O) CH2Приехать
1,3-дикетоны, которые могут таутомеризовать для энол то есть сопряженный к другому карбонилу обычно существуют преимущественно в форме енола, и особенно, когда продукт может быть дополнительно стабилизирован шестичленным кольцом, содержащим водородную связь. Например, процент енола в ацетилацетон, трифторацетилацетон, и гексафторацетилацетон составляют 85, 97 и 100% соответственно (в чистом виде, 33 ° C).[4]
Как и другие дикетоны, 1,3-дикетоны являются универсальными предшественниками гетероциклов. Гидразин, например, конденсируется, чтобы дать пиразолы.
Основание конъюгата, полученное из 1,3-кетонов, может служить лиганд s сформировать координационные комплексы ацетилацетоната металлов. в Реакция ДеМайо 1,3-дикетоны реагируют с алкенами в фотохимическом перициклическая реакция с образованием (замещенных) 1,5-дикетонов.
Классически 1,3-дикетоны получают Клейзеновская конденсация кетона со сложным эфиром.
1,3-диэфиры и двухосновные кислоты
Малоновая кислота и его сложные эфиры являются родительскими членами этого класса дикарбонилов. Также распространены 2-замещенные производные с формулой RCH (CO2Р)2, которые возникают при C-алкилировании конъюгированного основания (енолята) NaCH (CO2Р)2.
1,4-дикарбонилы
1,4-диальдегиды
Янтарный альдегид (CH2CHO)2 является простейшим и исходным 1,4-диальдегидом. Легко гидратируется с образованием 2,5-дигидрокситетрагидрофурана. Ароматический аналог - фталевый альдегид. Эти дикарбонилы образуют гетероциклические гидраты, проиллюстрированные фталевым альдегидом.

Подобные равновесия циклизации применимы к высокореактивному малеиновому диальдегиду.[5]
1,4-дикетоны
Дикетоны с двумя метиленовыми группами, разделяющими карбонильные группы, также называемые γ-дикетонами, обычно сосуществуют с их энол таутомеры. Выдающийся член ацетонилацетон. 1,4-Дикетоны являются полезными предшественниками гетероциклов через Синтез Паала – Кнорра, который дает пирролы:
Эта реактивность лежит в основе нейротоксичности γ-дикетонов.[6] 1,4-Дикетоны также являются предшественниками фураны и тиофены. Конденсация 1,4-дикетонов (и родственных субстратов) с гидразины предоставить дигидропиридазины, которые можно превратить в пиридазины.
1,4-диэфиры и двухосновные кислоты
Янтарная кислота и его сложные эфиры являются родительскими членами этого семейства 1,4-дикарбонилов. Янтарная кислота примечательна как компонент в цикл лимонной кислоты. Образует ангидрид циклической кислоты, янтарный ангидрид. Ненасыщенные члены включают малеиновый и фумаровая кислота и сложные эфиры.
1,5-дикарбонилы
1,5-диальдегиды
Глутаральдегид (CH2)3(CHO)2 является простейшим и родительским 1,5-диальдегидом. Легко увлажняет. Ароматический аналог - изофталевый альдегид.[7]
1,5-дикетоны
Эти дикетоны имеют три метиленовые группы, разделяющие карбонильные группы.
1,5-диэфиры и дикислоты
Глутаровая кислота (CH2)3(CO2ЧАС)2 является исходной 1,5-двухосновной кислотой.
Гидратация и циклизация

Янтарный альдегид, глутаральдегид, и адипальдегид образуют гидраты, которые циклизуются.[8] Подобные реакции применимы ко многим дикарбонилам.
Безопасность
Ряд дикарбонильных соединений являются биоактивными. Известно, что диацетил вызывает заболевание легких. облитерирующий бронхиолит у тех людей, которые подверглись его воздействию на работе.[9] Диальдегиды, например глутаральдегид и малоновый альдегид являются фиксаторами или стерилизаторами.
Смотрите также
Рекомендации
- ^ а б c Хардо Сигель; Манфред Эггерсдорфер (2007). «Кетоны». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. п. 16. Дои:10.1002 / 14356007.a15_077.
- ^ Эрикс, К .; Хайден, Т. Д .; Ян, С. Си; Чан, И. Ю. (1983). «Кристаллическая и молекулярная структура биацетил (2,3-бутандиона), (H3CCO)2, при -12 и -100 ° C ». Варенье. Chem. Soc. 105 (12): 3940–3942. Дои:10.1021 / ja00350a032.
- ^ Яна, Калянашис; Гангули, Бишваджит (2018). «Исследование DFT для изучения важности размера кольца и влияния растворителей на процесс кето-енольной таутомеризации α- и β-циклодионов». СКУД Омега. 3 (7): 8429–8439. Дои:10.1021 / acsomega.8b01008. ЧВК 6644555. PMID 31458971.
- ^ Джейн Л. Бёрдетт; Макс Т. Роджерс (1964). «Кето-енольная таутомерия в β-дикарбонилах, изученная с помощью спектроскопии ядерного магнитного резонанса. I. Протонные химические сдвиги и константы равновесия чистых соединений». Варенье. Chem. Soc. 86: 2105–2109. Дои:10.1021 / ja01065a003.
- ^ Д. М. Бернесс (1960). «2,5-Дигидро-2,5-Диметоксифуран». Органический синтез. 40: 29. Дои:10.15227 / orgsyn.040.0029.
- ^ Стивен Р. Клаф; Лейна Малхолланд (2005), «Гексан», Энциклопедия токсикологии, 2 (2-е изд.), Elsevier, стр. 522–525.
- ^ Ackerman, J. H .; Суррей А. Р. (1967). «Изофталевый альдегид». Органический синтез. 47: 76. Дои:10.15227 / orgsyn.047.0076.
- ^ Харди, П. М .; Nicholls, A.C .; Райдон, Х. Н. (1972). «Гидратация и полимеризация янтарного альдегида, глутаральдегида и адипальдегида». Журнал химического общества, Perkin Transactions 2 (15): 2270. Дои:10.1039 / P29720002270.
- ^ Крейсс, Кэтлин (август 2017 г.). «Признание профессиональных эффектов диацетила: чему мы можем научиться из этой истории?». Токсикология. 388: 48–54. Дои:10.1016 / j.tox.2016.06.009. ЧВК 5323392. PMID 27326900.


