Дигидроксифенилглицин - Dihydroxyphenylglycine
 | |
| Имена | |
|---|---|
| Название ИЮПАК (S) -2-амино-2- (3,5-дигидроксифенил) уксусная кислота | |
| Другие имена 3,5-дигидроксифенилглицин, DHPG, S-DHPG | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| MeSH | 3,5-дигидроксифенилглицин |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C8ЧАС9N1О4 | |
| Молярная масса | 183,05 г моль−1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
(S) -3,5-дигидроксифенилглицин или же DHPG это мощный агонист группы I метаботропные рецепторы глутамата (мГлуР) mGluR1 и mGluR5.
DHPG был первым агонистом, который оказался селективным в отношении mGluR группы I.[1] Активность агонистов обнаруживается только в (S)-изомер, и (S) -DHPG может быть частичный агонист mGluR группы I.[1]
(S) -DHPG был исследован на предмет терапевтических эффектов при лечении нейронный травмы (например, связанные с ишемия или же гипоксия ), когнитивное улучшение, и Болезнь Альцгеймера.[1]
3,5-Дигидроксифенилглицин можно выделить из латекса Молочай гелиоскопия.[2]
DHGP также находится в ванкомицин и связанные гликопептиды. Хотя (S) стереоизомер синтезируется ферментами DpgA-D,[3] именно (R) стереоизомер используется в ванкомицине и других родственных соединениях. DHPG ферментативно получен из поликетид синтазный путь.
Биосинтез
При синтезе в бактериях DHPG для синтеза требуется 5 ферментов, DpgA-D и 4-гидроксифенилглицинтрансфераза (Pgat).[4] DpgA - это поликетид III типа синтазы и инициирует синтез путем конденсации ацетил-КоА с тремя молекулами малонил-КоА. Затем тетракарбонильное соединение циклизуется с образованием промежуточного соединения C8. Затем DpgB / D дегидратирует промежуточное соединение, используя химию енолятов, чтобы способствовать потере воды. DpgB / D изомеризует продукт для ароматизации кольца.

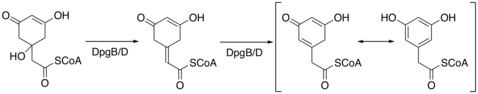
DpgC окисляет ароматический промежуточный продукт у бензильного углерода с использованием кислорода до альфа-кето-соединения. DpgC выполняет это окисление в отсутствие кофакторов железа, гема, флавина или птерина. Чен и другие предлагают следующий механизм реакции для объяснения реакционной способности DpgC.[5] Этот механизм подтверждается результатами, опубликованными в Widboom. и другие в 2007.[6] Наконец, молекула трансаминируется 4-гидроксифенилглицинтрансферазой с использованием тирозина, чтобы стать DHPG.

4-гидроксифенилглицинтрансфераза синтезирует (S) стереоизомер DHPG, однако эпимераза переключает стереоцентр в (R) конфигурацию после того, как DHPG включается в ванкомицин. нерибосомный полипептид.
Рекомендации
- ^ а б c Wiśniewski K .; Автомобиль, Х. (2002). "(S) -3,5-DHPG: обзор ». CNS Drug Rev. 8 (1): 101–116. PMID 12070529.
- ^ Müller, P .; Шютте, Х. Р. (май 1968 г.). "м-Гидроксифенилглицин и 3,5-дигидроксифенилглицин, 2 новые аминокислоты из латекса Молочай гелиоскопия". Z. Naturforsch. B (на немецком). 23 (5): 659–663. PMID 4385921.
- ^ Йим, Г., Такер, М. Н., Котева, К., Райт, Г. "Биосинтез гликопептидных антибиотиков". Журнал антибиотиков, 2017, 67, 31-41.
- ^ Пфейфер В., Николсон, Дж. Дж., Райс, Дж., Ректенуолк, Дж., Шефер, А. Б., Шоуки, Р. М., Шредер, Дж., Вохлебен, В., Пельцер, С. «Поликетид-синтаза в биосинтезе гликопептидов: Биосинтез непротеогенной аминокислоты (S) -3,5-дигидроксифенилглицина ». Журнал биологической химии, 2001, 276 (42/19), 38370-38377.
- ^ Чен, Х., Ценг, С. С., Хаббард, Б. К., Уолш, С. Т. «Биосинтез гликопептидных антибиотиков: ферментативная сборка выделенной аминокислотной мономии (S) -3,5-дигидроксифенилглицина». PNAS, 2001, 98 (26), 14901-14906.
- ^ Видбум, П. Ф., Филдинг, Э. Н., Лю, Ю., Брунер, С. Д. "Структурная основа кофактор-независимой диоксигенации в биосинтезе ванкомицина". Природа, 2007, 447, 342-345.
