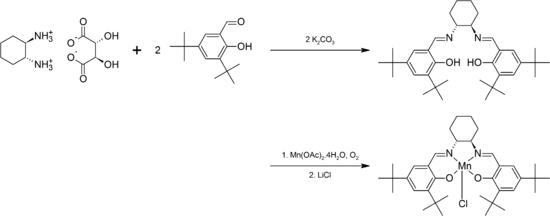Металлические саленовые комплексы - Metal salen complexes - Wikipedia
А металлический саленовый комплекс это координационное соединение между металлом катион и лиганд происходит от N,N′ -Бис (салицилиден) этилендиамин, обычно называемый саленом. Классический пример: Salcomine, комплекс с двухвалентный кобальт Co2+, обычно обозначаемый как Со (сален).[1] Эти комплексы широко исследуются как катализаторы и имитаторы ферментов.[2][3]

Не содержащее металлов соединение салена (H2САЛЕН ИЛИ САЛЕН2) имеет два фенольный гидроксил группы. «Сален-лиганд» обычно представляет собой его конъюгированное основание (сален2−) в результате потери протоны от этих гидроксильных групп. Атом металла обычно образует четыре координационные связи с атомом кислород и азот атомы.
Приготовление комплексов
Анион салена образует комплексы с большинством переходные металлы. Эти комплексы обычно получают по реакции H2сален («пролиганд») с металлическими предшественниками, содержащими встроенные основания, такие как алкоксиды, амиды металлов, или же ацетат металла. Пролиганд также можно лечить галогенид металла, с добавленной базой или без нее. Наконец, пролиганд может быть депротонирован ненуклеофильным основанием, таким как гидрид натрия, перед обработкой галогенидом металла. Например, Катализатор Якобсена готовится из предшественника саленового лиганда с ацетат марганца.[4]
Структуры
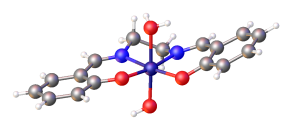
Саленские комплексы с d8 ионы металлов, такие как Ni (сален), обычно имеют низкоскоростной квадратная плоская молекулярная геометрия в сфера координации.
Другие комплексы металл-сален могут иметь дополнительные лиганды выше плоскости азот-кислород салена. Комплексы с одним дополнительным лигандом, такие как VO (сален), может иметь квадратная пирамидальная геометрия молекулы. Комплексы с двумя дополнительными лигандами, такими как Co (salen) Cl (ру ), можно иметь октаэдрическая геометрия. Обычно MN2О2 ядро относительно плоское, даже несмотря на то, что этиленовый каркас перекошен, а общий саленовый лиганд принимает скрученный C2 симметрия. Существуют примеры, когда вспомогательные лиганды заставляют N2О2 доноры вне планарности.[6] Нет доказательств того, что сален является окислительно-восстановительным агентом.невинный лиганд.
Реакции

Имитаторы ферментов
Цумаки описал первые комплексы металл – сален в 1938 году. Он обнаружил, что комплекс кобальта (II) Co (salen) обратимо связывает O2, что привело к интенсивным исследованиям кобальтовых комплексов салена и родственных ему лиганды за их способность хранить и транспортировать кислород, ища потенциал синтетические переносчики кислорода.[1] Комплексы кобальта-салена также воспроизводят определенные аспекты витамин B12.
Гомогенный катализ
Марганецсодержащий катализатор используется для асимметричного эпоксидирования алкены. в гидролитическое кинетическое разрешение В этом методе рацемическая смесь эпоксидов может быть разделена путем селективного гидролиза одного энантиомера, катализируемого аналогичным комплексом кобальта (III).[8] В последующей работе было обнаружено, что комплексы саленов хрома (III) и кобальта (III) являются хорошими катализаторами для получения поликарбонаты из углекислого газа и эпоксидов.[9]
Родственные комплексы
Замещенные саленовые комплексы

Незамещенные комплексы салена плохо растворимы в органических растворителях. Боковые цепи, присоединенные к этиленовому мостику или бензольным кольцам, могут увеличивать растворимость. Примером может служить сальпн-лиганд, происходит от 1,2-диаминопропан вместо этилендиамина, который используется в качестве дезактивация металла добавка в моторные масла и моторное топливо.[10]
Присутствие объемных групп около координационного центра обычно желательно, поскольку оно усиливает каталитическую активность и предотвращает димеризацию. Лиганды салена, полученные из 3,5-ди-терт-бутилсалицилальдегид популярны, потому что соответствуют обоим критериям и, как правило, растворимы даже в неполярных растворителях, таких как пентан.
Хиральность может быть введена в лиганд либо через диаминовую основную цепь, либо через фенильное кольцо, либо через оба.[11] Например, конденсация из C2-симметричный транс-1,2-диаминоциклогексан с 3,5-ди-терт-бутилсалицилальдегид образует лиганд, который образует комплексы с Cr, Mn, Co, Al, которые оказались полезными для асимметричные преобразования. Для примера см. Эпоксидирование Якобсена, который катализируется хиральным марганец -сален комплекс:[4]
Комплексы с лигандами сален-типа
Металлокомплексы «саленского типа» образуются с лиганды с подобными хелатными группами, Такие как акасен, сальфа, и Salqu. Комплексы меди Salqu были исследованы в качестве катализаторов окисления.[12]
Комплексы с салановыми лигандами
Комплексы с подобными Салан или же Salalen лиганды с одной или двумя насыщенными азот-арильными связями (амины скорее, чем имины ) имеют тенденцию быть менее жесткими и более богатыми электронами в металлическом центре, чем соответствующие саленовые комплексы.[13][14]
дальнейшее чтение
- McGarrigle, Eoghan M .; Гилхиани, Деклан Г. (2005). "Хром- и марганец-сален способствовали эпоксидированию алкенов". Химические обзоры. 105 (5): 1563–1602. Дои:10.1021 / cr0306945. PMID 15884784.
- Бандини, Марко; Коцци, Пьер Джорджио; Умани-Рончи, Ахилле (2002). «[Cr (Сален)] как« мост »между асимметричным катализом, кислотами Льюиса и окислительно-восстановительными процессами». Химические коммуникации (9): 919–927. Дои:10.1039 / b109945k. PMID 12123051.
Рекомендации
- ^ а б Цумаки, Т. (1938). "Nebenvalenzringverbindungen. IV. Über einige innerkomplexe Kobaltsalze der Oxyaldimine". Бюллетень химического общества Японии (на немецком). 13 (2): 252–260. Дои:10.1246 / bcsj.13.252.
- ^ Балейзао, Карлос; Гарсия, Эрменегильдо (2006). «Хиральные комплексы Салена: Обзор извлекаемых и многоразовых гомогенных и гетерогенных катализаторов». Химические обзоры. 106 (9): 3987–4043. Дои:10.1021 / cr050973n. PMID 16967927.
- ^ Decortes, Antonello; Кастилья, Ана М .; Клей, Арьян В. (2010). «Сален-комплексное образование циклических карбонатов путем циклоприсоединения CO.2 к эпоксидам ». Angewandte Chemie International Edition. 49 (51): 9822–9837. Дои:10.1002 / anie.201002087. PMID 20957709.
- ^ а б Larrow, J. F .; Якобсен, Э. (2004). "(р,р)-N,N'-Бис (3,5-Ди-терт-Бутилсалицилиден) -1,2-Циклогександиаминохлорид марганца (III), высокоэнантиоселективный катализатор эпоксидирования ». Органический синтез.; Коллективный объем, 10, п. 96
- ^ Coggon, P .; McPhail, A.T .; Mabbs, F.E .; Richards, A .; Торнли, А. С. (1970). «Получение, магнитные и электронные спектральные свойства некоторых хрома (III) -NN'-Этиленбис (салицилидениминато) комплексы: кристаллическая и молекулярная структура N,N'-Этиленбис (салицилидениминато) диаквохром (III) хлорид ". J. Chem. Soc. А: 3296–3303. Дои:10,1039 / j19700003296.
- ^ Lauffer, Randall B .; Heistand, Роберт Х .; Que, Лоуренс (1983). «Модели диоксигеназы. Кристаллические структуры комплексов 2,4-пентандионато, фенантренсемихинона и катехолато» N,N′ -Этиленбис (салицилиденаминато) железа (III) ». Неорганическая химия. 22: 50–55. Дои:10.1021 / ic00143a013.
- ^ Хуэйлань, Чен; Деян, Хан; Тиан, Ли; Хун, Ян; Венся, Тан; Цзянь; Пейджу; Ченган (1996). "Синтез и кристаллическая структура комплексов кобальта (III) с вторичными алкилами или экваториальными лигандами объемного основания Шиффа". Неорганическая химия. 35 (6): 1502–1508. Дои:10.1021 / ic940516h. PMID 11666365.
- ^ Макото Токунага; Джей Ф. Ларроу; Фумитоси Какиучи; Эрик Н. Якобсен (1997). «Асимметричный катализ с водой: эффективное кинетическое разрешение конечных эпоксидов с помощью каталитического гидролиза». Наука. 277 (5328): 936–938. Дои:10.1126 / science.277.5328.936. PMID 9252321.
- ^ Д. Дж. Даренсбург (2007). «Производство пластмасс из диоксида углерода: металлические комплексы Салена в качестве катализаторов для производства поликарбонатов из эпоксидов и CO.2". Химические обзоры. 107 (6): 2388–2410. Дои:10.1021 / cr068363q. PMID 17447821.
- ^ Dabelstein, W .; Реглицкий А .; Schutze A .; Редерс К. «Автомобильное топливо». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a16_719.pub2.
- ^ Коцци, Пьер Джорджио (2004). «Комплексы металл – основание Салена Шиффа в катализе: Практические аспекты». Chem. Soc. Ред. 33 (7): 410–21. Дои:10.1039 / B307853C. PMID 15354222.
- ^ У, Сянхун; Горден, А. В. Э. (2009). "Медные комплексы 2-хиноксалинол Сален для окисления арилметиленов". Евро. J. Org. Chem. 2009 (4): 503–509. Дои:10.1002 / ejoc.200800928.
- ^ Этвуд, Дэвид А .; Ремингтон, Майкл П .; Резерфорд, Дрю (1996). «Использование лигандов Салана для образования биметаллических комплексов алюминия». Металлоорганические соединения. 15 (22): 4763. Дои:10.1021 / om960505r.
- ^ Беркессель, Альбрехт; Бранденбург, Марк; Леттерсторф, Ева; Фрей, Джулия; Лекс, Иоганн; Шефер, Матиас (2007). «Практический и универсальный доступ к дигидросалену (салалену) лигандам: высокоэнантиоселективный титан. Катализаторы in situ для асимметричного эпоксидирования водным пероксидом водорода». Adv. Synth. Катал. 349 (14–15): 2385. Дои:10.1002 / adsc.200700221.