Металлотионеин - Metallothionein
| Надсемейство металлотионеинов (растение) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||
| Идентификаторы | |||||||||||
| Символ | Металлотионеин_sfam | ||||||||||
| Pfam | PF00131 | ||||||||||
| ИнтерПро | IPR003019 | ||||||||||
| |||||||||||
| Дрожжи МТ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Saccharomyces cerevisiae МТ-металлотионеин, связанный с медь ионы. Цистеины имеют желтый цвет, медь - коричневый. (PDB: 1AQS) | |||||||||
| Идентификаторы | |||||||||
| Символ | Дрожжевой металлотионеин | ||||||||
| Pfam | PF11403 | ||||||||
| Pfam клан | CL0461 | ||||||||
| ИнтерПро | IPR022710 | ||||||||
| |||||||||
| Цианобактерии SmtA | |||||||||
|---|---|---|---|---|---|---|---|---|---|
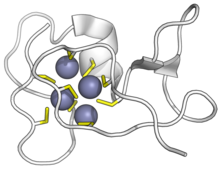 Цианобактерии SmtA-металлотионеин связывается с ионами цинка. Цистеины имеют желтый цвет, цинк - фиолетовый. (PDB: 1JJD) | |||||||||
| Идентификаторы | |||||||||
| Символ | Бактериальный металлотионеин | ||||||||
| Pfam | PF02069 | ||||||||
| Pfam клан | CL0461 | ||||||||
| ИнтерПро | IPR000518 | ||||||||
| |||||||||
Металлотионеин (MT) - это семейство цистеин -богатый, низкий молекулярный вес (МВт от 500 до 14000 Да ) белки. Они локализуются на мембране аппарат Гольджи. МТ обладают способностью связывать как физиологические (например, цинк, медь, селен ) и ксенобиотик (Такие как кадмий, Меркурий, серебро, мышьяк ) тяжелые металлы сквозь тиол группа его остатков цистеина, которые составляют почти 30% составляющих его аминокислота остатки.[2]
МТ был открыт в 1957 году Валле и Маргоше при очистке Cd-связывающего белка лошади (лошади). почечная кора.[3] MT играет роль в защите от токсичность металлов и окислительный стресс, и участвует в регулировании цинка и меди.[4] Есть четыре основных изоформы выражены у людей (семья 1, см. диаграмму ниже): MT1 (подтипы А, B, E, F, грамм, ЧАС, L, M, Икс ), MT2, MT3, и MT4. В организме человека большие количества синтезируются в основном в печень и почки. Их производство зависит от наличия диетические минералы Такие как цинк, медь, и селен, а также аминокислоты гистидин и цистеин.
Металлотионеины богаты тиолами, что позволяет им связывать ряд следов металлов. Металлотионеин связывает несколько ионов Zn. Один из немногих эукариотических белков, которые, как известно, играют важную роль в детоксикации металлов. Цинк и кадмий тетраэдрически координированы с остатками цистеина, каждая молекула белка металлотионеина может связывать до 7 атомов Zn или Cd.[5] Биосинтез металлотионеина, по-видимому, увеличился в несколько раз во время окислительного стресса, чтобы защитить клетки от цитотоксичности и повреждения ДНК. Биосинтез металлотионеина также может быть вызван определенными агентами или условиями, например гормонами, фармацевтическими препаратами, спиртами, другими веществами для лечения и многими другими.[6] Металлотионеин - это цитоплазматический белок, у взрослого человека он локализуется преимущественно в цитоплазме. У плода человека металлотионеин локализуется в ядрах гепатоцитов.[7]
Структура и классификация
MT присутствуют в широком диапазоне таксономических групп, начиная от прокариот (таких как цианобактерии Синехококк sp.), простейшие (например, инфузории Тетрахимена родов), растения (например, Pisum sativum, Triticum durum, Zea Mays, или же Quercus suber ), дрожжи (например, Saccharomyces cerevisiae или же грибковые микроорганизмы албиканс ), беспозвоночные (такие как нематода Caenorhabditis elegans, насекомое Drosophila melanogaster, моллюск Mytilus edulis, или иглокожие Стронгилоцентротус пурпуратус ) и позвоночные (например, курица Gallus gallus, или млекопитающее Homo sapiens или же Mus musculus ).
MT из этого разнообразного таксономического диапазона представляют собой последовательность с высокой гетерогенностью (в отношении молекулярной массы, числа и распределения остатков Cys) и не проявляют общей гомологии; Несмотря на это, гомология обнаруживается внутри некоторых таксономических групп (таких как МТ позвоночных).
Из их первичная структура, МП классифицированы разными методами. Первый датируется 1987 годом, когда Фаулер и другие., установили три класса МТ: Класс I, включая МТ, которые демонстрируют гомологию с МТ лошади, Класс II, включая остальные МТ, не гомологичные с МТ лошади, и Класс III, который включает фитохелатины, Cys-богатые ферментативно синтезированные пептиды. Вторая классификация была проведена Бинцем и Каги в 2001 году и учитывает таксономические параметры и закономерности распределения остатков Cys вдоль последовательности МТ. В результате получено 15 семейств белковых МТ. . Семейство 15 содержит растительные МТ, которые в 2002 г. были дополнительно классифицированы Коббетом и Голдсбро на 4 типа (1, 2, 3 и 4) в зависимости от распределения их остатков Cys и участков, лишенных Cys (называемых спейсерами), характерных для завод МЦ.
Приведена таблица, включающая основные аспекты двух последних классификаций.
| Семья | Имя | Шаблон последовательности | Пример |
|---|---|---|---|
| 1 | Позвоночное животное | К-х (1,2) -C-C-x-C-C-P-x (2) -C | Mus musculus MT1 MDPNCSCTTGGSCACAGSCKCKECKCTSCKKCCSCCPVGCAKCAQGCVCKGSSEKCRCCA |
| 2 | Моллюск | C-x-C-x (3) -C-T-G-x (3) -C-x-C-x (3) -C-x-C-K | Mytilus edulis 10MTIV MPAPCNCIETNVCICDTGCSGEGCRCGDACKCSGADCKCSGCKVVCKCSGSCACEGGCTGPSTCKCAPGCSCK |
| 3 | Ракообразный | P- [GD] -P-C-C-x (3,4) -C-x-C | Homarus americanus MTH MPGPCCKDKCECAEGGCKTGCKCTSCRCAPCEKCTSGCKCPSKDECAKTCSKPCKCCP |
| 4 | Иглокожие | P-D-x-K-C-V-C-C-x (5) -C-x-C-x (4) -C-C-x (4) -C-C-x (4,6) -C-C | Стронгилоцентротус пурпуратус SpMTA MPDVKCVCCKEGKECACFGQDCCKTGECCKDGTCCGICTNAACKCANGCKCGSGCSCTEGNCAC |
| 5 | Двукрылые | C-G-x (2) -C-x-C-x (2) -Q-x (5) -C-x-C-x (2) D-C-x-C | Drosophila melanogaster MTNB MVCKGCGTNCQCSAQKCGDNCACNKDCQCVCKNGPKDQCCSNK |
| 6 | Нематода | К-С-С-x (3) -C-C | Caenorhabditis elegans MT1 MACKCDCKNKQCKCGDKCECSGDKCCEKYCCEEASEKKCCPAGCKGDCKCANCHCAEQKQCGDKTHQHQGTAAAH |
| 7 | Инфузория | x-C-C-C-x? | Tetrahymena thermophila MTT1 MDKVNSCCCGVNAKPCCTDPNSGCCCVSKTDNCCKSDTKECCTGTGEGCKCVNCKCCKPQANCCCGVNAKPCCFDPNSGCCCVSKTNNCCKSD TKECCTGTGEGCKCQNQCTSCQCCKPVQQACCCCCDPCGD |
| 8 | Грибковый 1 | C-G-C-S-x (4) -C-x-C-x (3,4) -C-x-C-S-x-C | Neurospora crassa MT MGDCGCSGASSCNCGSGCSCSNCGSK |
| 9 | Грибок 2 | --- | Candida glabrata MT2 MANDCKCPNGCSCPNCANGGCQCGDKCECKKQSCHGCGEQCKCGSHGSSCHGSCGCGDKCECK |
| 10 | Грибковый 3 | --- | Candida glabrata MT2 MPEQVNCQYDCHCSNCACENTCNCCAKPACACTNSASNECSCQTCKCQTCKC |
| 11 | Грибковый 4 | C-X-K-C-x-C-x (2) -C-K-C | Yarrowia lipolytica MT3 MEFTTAMLGASLISTTSTQSKHNLVNNCCCSSSTSESSMPASCACTKCGCKTCKC |
| 12 | Грибковый 5 | --- | Saccharomyces cerevisiae CUP1 MFSELINFQNEGHECQCQCGSCKNNEQCQKSCSCPTGCNSDDKCPCGNKSEETKKSCCSGK |
| 13 | Грибковый 6 | --- | Saccharomyces cerevisiae CRS5 TVKICDCEGECCKDSCHCGSTCLPSCSGGEKCKCDHSTGSPQCKSCGEKCKCETTCTCEKSKCNCEKC |
| 14 | Прокариота | K-C-A-C-x (2) -C-L-C | Синехококк зр SmtA MTTVTQMKCACPHCLCIVSLNDAIMVDGKPYCSEVCANGTCKENSGCGHAGCGCGSA |
| 15 | Растение | [YFH] -x (5,25) -C- [SKD] -C- [GA] - [SDPAT] -x (0,1) -C-x- [CYF] | |
| 15.1 | Завод МЦ Тип 1 | C-X-C-X (3) - C-X-C-X (3) - C-X-C-X (3) -спейсер-C-X-C-X (3) - C-X-C-X (3) - C-X-C-X (3) | Pisum sativum MT MSGCGCGSSCNCGDSCKCNKRSSGLSYSEMETTETVILGVGPAKIQFEGAEMSAASEDGGCKCGDNCTCDPCNCK |
| 15.2 | Завод МЦ Тип 2 | C-C-X (3) -C-X-C-X (3) - C-X-C-X (3) - C-X-C-X (3) -пространство- C-X-C-X (3) - C-X-C-X (3) - C-X-C-X (3) | Lycopersicon esculentum MT MSCCGGNCGCGSSCKCGNGCGGCKMYPDMSYTESSTTTETLVLGVGPEKTSFGAMEMGESPVAENGCKCGSDCKCNPCTCSK |
| 15.3 | Завод МЦ Тип 3 | --- | Arabidopsis thaliana MT3 MSSNCGSCDCADKTQCVKKGTSYTFDIVETQESYKEAMIMDVGAEENNANCKCKCGSSCSCVNCTCCPN |
| 15.4 | Завод МЦ Тип 4 или Ес | C-x (4) -C-X-C-X (3) -C-X (5) -C-X-C-X (9,11) -HTTCGCGEHC- X-C-X (20) -CSCGAXCNCASC-X (3,5) | Triticum aestivum MT MGCNDKCGCAVPCPGGTGCRCTSARSDAAAGEHTTCGCGEHCGCNPCACGREGTPSGRANRRANCSCGAACNCASCGSTTA |
| 99 | Фитохелатины и другие небелковые МТ-подобные полипептиды | --- | Schizosaccharomyces pombe γEC-γEC-γECG |
Дополнительные данные по этой классификации можно найти на странице Expasy metallothionein.[8]
Вторичная структура элементы наблюдались в нескольких МТ SmtA из Синекохокк, MT3 млекопитающих, Echinoderma SpMTA, рыба Нототения Coriiceps MT, Crustacean MTH, но до сих пор содержание таких структур считается бедным в МТ, и его функциональное влияние не учитывается.
Третичная структура МТ также весьма неоднороден. В то время как МТ позвоночных, иглокожих и ракообразных демонстрируют бидоминиальную структуру с двухвалентными металлами, такими как Zn (II) или Cd (II) (белок свернут так, чтобы связывать металлы в двух функционально независимых доменах с металлическим кластер каждый), дрожжевые и прокариотические МТ демонстрируют монодоминальную структуру (один домен с одним металлическим кластер). Хотя структурные данные для MT моллюсков, нематод и дрозофилы отсутствуют, обычно предполагается, что первые являются бидоминиальными, а вторые - монодоминальными. Окончательных данных по MT растений нет, но были предложены две возможные структуры: 1) бидоминальная структура, аналогичная структуре MT позвоночных; 2) кодоминиальная структура, в которой два богатых Cys домена взаимодействуют с образованием единого металлического кластера.
Четвертичная структура широко не рассматривался для MT. Процессы димеризации и олигомеризации наблюдались и приписывались нескольким молекулярным механизмам, включая образование межмолекулярных дисульфидов, мостиковое соединение металлов, связанных остатками Cys или His на различных MT, или взаимодействия, опосредованные неорганическими фосфатами. Было показано, что димерные и полимерные МТ приобретают новые свойства при детоксикации металлов, но физиологическое значение этих процессов было продемонстрировано только в случае прокариотического Synechococcus SmtA. Димер МТ, продуцируемый этим организмом, образует структуры, подобные цинковым пальцам, и обладает Zn-регуляторной активностью.
Металлотионеины обладают разнообразными предпочтениями в связывании металлов, которые связаны с функциональной специфичностью. Например, млекопитающее Mus musculus MT1 предпочтительно связывает ионы двухвалентных металлов (Zn (II), Cd (II), ...), в то время как дрожжевой CUP1 селективен в отношении ионов одновалентных металлов (Cu (I), Ag (I), ...). Строго металл-селективные МТ с металло-специфическими физиологическими функциями были обнаружены Даллингер и другие. (1997) у легочных улиток (Gastropoda, Mollusca).[9] Римская улитка (Helix pomatia ), например, обладает Cd-селективной (CdMT) и Cu-селективной изоформой (CuMT), участвующими в детоксикации Cd и регуляции Cu соответственно.[9] В то время как обе изоформы содержат неизменные числа и положения остатков Cys, ответственных за лигирование металлов, избирательность по металлу, по-видимому, достигается за счет модуляции последовательности аминокислотных остатков, не участвующих непосредственно в связывании металлов (Palacios et al. 2011).[9][10]
А новая функциональная классификация МТ в виде Zn- или Cu-тионеинов в настоящее время разрабатывается на основе этих функциональных предпочтений.
Дрожжи
Металлотионеины характеризуются обилием цистеин остатки и отсутствие общих вторичная структура мотивы. Металлотионеин дрожжей (MT) также альтернативно называют металлотионеином меди (CUP). Металлотионеин дрожжей намного сильнее координируется с Cu+ чем Cu2+.[11]
Функция
Этот белок функции в первичном хранилище металла, транспорт, и детоксикация.[12] В частности, магазины Yeast MT медь таким образом защищает клетку от токсичности меди за счет хелатирующий ионы меди.
За первые 40 остатки в белке полипептид оборачивается вокруг металла, образуя два больших параллельных петли разделены глубокой щелью, содержащей металлический кластер.[12]
Примеры
Дрожжевой MT можно найти в следующем:[13]
- Saccharomyces cerevisiae
- Neurospora crassa
Функция
Металлический переплет
Документально подтверждено, что металлотионеин связывает широкий спектр металлов, включая кадмий,[14] вести,[15] цинк, ртуть, медь, мышьяк, серебро и др. Ранее сообщалось, что металлизация МТ происходит совместно [16] но недавние отчеты предоставили убедительные доказательства того, что связывание металлов происходит посредством последовательного, некооперативного механизма.[17] Наблюдение за частично металлизированным МТ (то есть имеющим некоторую способность связывать свободный металл) позволяет предположить, что эти виды являются биологически важными.
Металлотионеины, вероятно, участвуют в захвате, транспорте и регуляции цинка в биологических системах. МТ млекопитающих связывает три иона Zn (II) в своем бета-домене и четыре в альфа-домене. Цистеин представляет собой серосодержащую аминокислоту, отсюда и название «-тионеин». Однако для некоторых форм МТ было предложено участие неорганических сульфид- и хлорид-ионов. В некоторых МТ, в основном бактериальных, гистидин участвует в связывании цинка. Связывая и высвобождая цинк, металлотионеины (МТ) могут регулировать уровень цинка в организме. Цинк, в свою очередь, является ключевым элементом для активации и связывания определенных факторы транскрипции через свое участие в цинковый палец область белка.[18][19] Металлотионеин также переносит ионы (сигналы) цинка из одной части клетки в другую. Когда цинк попадает в клетку, он может быть захвачен тионеином (который, таким образом, становится «металлотионеином») и перенесен в другую часть клетки, где он высвобождается в другую органеллу или белок. Таким образом, тионеин и металлотионеин становятся ключевыми компонентами системы передачи сигналов цинка в клетках. Эта система особенно важна в мозге, где передача сигналов цинка важна как между нервными клетками, так и внутри них. Это также кажется важным для регуляции белка-супрессора опухолей p53.
Контроль окислительного стресса
Остатки цистеина из MT могут захватывать вредные радикалы окислителя, такие как супероксидные и гидроксильные радикалы.[20] В этой реакции цистеин окисляется до цистин, и ионы металлов, которые были связаны с цистеином, высвобождаются в среду. Как объяснено в Выражение и регулирование В разделе этот Zn может активировать синтез большего количества МТ. Было высказано предположение, что этот механизм является важным механизмом в контроле окислительного стресса с помощью МТ. Роль MT в снижении окислительного стресса подтверждена мутантами MT Knockout, но некоторые эксперименты предполагают также прооксидантную роль MT.[нужна цитата ]
Металлотионеин также играет роль в дифференцировке и пролиферации гемопоэтических клеток, а также в предотвращении апоптоза ранних дифференцированных клеток. Индуцированные уровни МТ были неблагоприятно связаны с чувствительностью к апоптозу, индуцированному этопозидом, что означает, что МТ является потенциальным негативным регулятором апоптоза.[21]
Выражение и регулирование
Экспрессия гена металлотионеина индуцируется множеством стимулов, таких как воздействие металлов, окислительный стресс, глюкокортикоиды, Витамин Д, водное напряжение, голодание, упражнение и т. д. Уровень ответа на эти индукторы зависит от гена МТ. Гены MT присутствуют в своих промоторах, специфических последовательностях для регуляции экспрессии, такие элементы, как элементы ответа на металл (MRE), элементы ответа глюкокортикоидов (GRE), GC-богатые блоки, элементы базального уровня (BLE) и элементы ответа щитовидной железы (TRE) .[22][23]
Металлотионеин и болезнь
Рак
Поскольку МТ играют важную роль в регуляции факторов транскрипции, дефекты функции или экспрессии МТ могут приводить к злокачественным новообразованиям. трансформация ячеек и в конечном итоге рак.[24] Исследования показали повышенную экспрессию МТ при некоторых формах рака груди, толстой кишки, почек, печени, кожи (меланома), легких, носоглотки, яичников, простаты, рта, слюнной железы, яичек, щитовидной железы и мочевого пузыря; они также обнаружили более низкие уровни экспрессии МТ при гепатоцеллюлярной карциноме и аденокарциноме печени.[25]
Есть данные, позволяющие предположить, что более высокие уровни экспрессии МТ также могут приводить к устойчивости к химиотерапевтический наркотики.[26]
Аутизм
Токсичность тяжелых металлов была предложил как гипотетический этиология из аутизм, и дисфункция синтеза и активности MT может играть роль в этом. Многие тяжелые металлы, в том числе Меркурий, вести, и мышьяк были связаны с симптомами, напоминающими неврологические симптомы аутизма.[27] Однако дисфункция МТ не связана конкретно с расстройствами аутистического спектра. Исследование 2006 г., посвященное изучению детей, подвергшихся воздействию вакцина консервант тиомерсал, обнаружили, что уровни MT и антитела к МТ у детей-аутистов существенно не отличались от детей-неаутистов.[28]
Низкое соотношение цинка и меди рассматривается как биомаркер аутизма и считается признаком нарушения системы металлотионеина.[29]
Кроме того, есть признаки того, что уровень цинка у матери может повлиять на иммунологическое состояние развивающегося ребенка, что может привести к аутизму и может снова быть признаком того, что система металлотионеина была затронута.[30]
Смотрите также
Рекомендации
- ^ PDB: 2КАК; Peroza EA, Schmucki R, Güntert P, Freisinger E, Zerbe O (март 2009 г.). «Бета (Е) -домен Е (с) -1-металлотионеина пшеницы: металл-связывающий домен с отличительной структурой». Журнал молекулярной биологии. 387 (1): 207–18. Дои:10.1016 / j.jmb.2009.01.035. PMID 19361445.
- ^ Sigel H, Sigel A, ред. (2009). Металлотионеины и родственные хелаторы (ионы металлов в науках о жизни). Ионы металлов в науках о жизни. 5. Кембридж, Англия: Королевское химическое общество. ISBN 1-84755-899-2.
- ^ Маргошес М, Валле Б.Л. (1957). «Белок кадмия из коры почек лошади». Журнал Американского химического общества. 79 (17): 4813–4814. Дои:10.1021 / ja01574a064.
- ^ Фелизола С.Дж., Накамура Ю., Арата Ю., Исэ К., Сато Ф., Рейни В.Е., Мидорикава С., Сузуки С., Сасано Х. (сентябрь 2014 г.). «Металлотионеин-3 (МТ-3) в коре надпочечников человека и его нарушениях». Эндокринная патология. 25 (3): 229–35. Дои:10.1007 / s12022-013-9280-9. PMID 24242700.
- ^ Сухи Д.А., Саймон К.Д., Линцер Д.И., О'Халлоран ТВ (апрель 1999 г.). «Металлотионеин является частью механизма поглощения цинка для выживания клеток в условиях крайней депривации цинка». Журнал биологической химии. 274 (14): 9183–92. Дои:10.1074 / jbc.274.14.9183. PMID 10092590.
- ^ Ван В.К., Мао Х., Ма Д.Д., Ян В.Х. (август 2014 г.). «Характеристики, функции и применение металлотионеина у водных позвоночных». Границы морских наук. 1: 34. Дои:10.3389 / fmars.2014.00034.
- ^ Чериан М.Г. (сентябрь 1994 г.). «Значение ядерной и цитоплазматической локализации металлотионеина в печени и опухолевых клетках человека». Перспективы гигиены окружающей среды. 102 Дополнение 3: 131–5. Дои:10.2307/3431776. JSTOR 3431776. ЧВК 1567399. PMID 7843087.
- ^ «Металлотионеины: классификация и перечень позиций». www.uniprot.org.
- ^ а б c Даллингер Р., Бергер Б., Хунцикер П., Кяги Дж. Х. (1997). «Металлотионеин в метаболизме Cd и Cu улиток». Природа. 388 (6639): 237–238.
- ^ Паласиос О., Пагани А., Перес-Рафаэль С., Эгг М., Хёкнер М., Брандштеттер А., Капдевила М., Атриан С., Даллингер Р. (январь 2011 г.). «Механизмы формирования специфичности металлов в семействе металлотионеинов многоклеточных: эволюционная дифференциация металлотионеинов моллюсков». BMC Биология. 9 (4): 4. Дои:10.1186/1741-7007-9-4. ЧВК 3033865. PMID 21255385.
- ^ Бухман С., Скроч П., Уэлч Дж, Фогель С., Карин М. (сентябрь 1989 г.). «Продукт гена CUP2, регулятор экспрессии дрожжевого металлотионеина, представляет собой активируемый медью ДНК-связывающий белок». Молекулярная и клеточная биология. 9 (9): 4091–5. Дои:10.1128 / MCB.9.9.4091. ЧВК 362479. PMID 2674688.
- ^ а б Петерсон К.В., Нарула СС, Армитаж И.М. (январь 1996 г.). «Трехмерная структура раствора медь и серебро-замещенных металлотионеинов дрожжей». Письма FEBS. 379 (1): 85–93. Дои:10.1016/0014-5793(95)01492-6. PMID 8566237.
- ^ Butt TR, Ecker DJ (сентябрь 1987 г.). «Дрожжевой металлотионеин и его применение в биотехнологии».. Микробиологические обзоры. 51 (3): 351–64. Дои:10.1128 / ммбр.51.3.351-364.1987. ЧВК 373116. PMID 3312986.
- ^ Фрайзингер Э., Вашак М. (2013). «Кадмий в металлотионеинах». Ионы металлов в науках о жизни. 11: 339–71. Дои:10.1007/978-94-007-5179-8_11. PMID 23430778.
- ^ Вонг, Дейзи Л .; Меррифилд-Макрей, Морин Э .; Стиллма, Мартин Дж. (2017). «Глава 9. Связывание (II) свинца в металлотионеинах». В Astrid, S .; Helmut, S .; Сигель, Р. К. О. (ред.). Свинец: его влияние на окружающую среду и здоровье. Ионы металлов в науках о жизни. 17. де Грюйтер. С. 241–270. Дои:10.1515/9783110434330-009.
- ^ НУЖНА ЦИТАТА
- ^ Крезель А., Марет В. (сентябрь 2007 г.). «Двойные наномолярные и пикомолярные Zn (II) связывающие свойства металлотионеина». Журнал Американского химического общества. 129 (35): 10911–21. Дои:10.1021 / ja071979s. PMID 17696343.
- ^ Хуанг М., Крепкий Д., Ху В., Петеринг Д.Х. (май 2004 г.). "Zn-, Cd- и Pb-фактор транскрипции IIIA: свойства, связывание ДНК и сравнение с металлическими комплексами TFIIIA-finger 3". Журнал неорганической биохимии. 98 (5): 775–85. Дои:10.1016 / j.jinorgbio.2004.01.014. ЧВК 3516448. PMID 15134923.
- ^ Хуанг М., Шоу III CF, Петеринг DH (апрель 2004 г.). «Межбелковый обмен металлов между фактором транскрипции IIIa и апо-металлотионеином». Журнал неорганической биохимии. 98 (4): 639–48. Дои:10.1016 / j.jinorgbio.2004.02.004. ЧВК 3535305. PMID 15041244.
- ^ Кумари М.В., Хирамацу М., Эбади М. (август 1998 г.). «Действия по улавливанию свободных радикалов изоформ I и II металлотионеина». Свободные радикальные исследования. 29 (2): 93–101. Дои:10.1080/10715769800300111. PMID 9790511.
- ^ Такахаши С. (июль 2012 г.). «Молекулярные функции металлотионеина и его роль в гематологических злокачественных новообразованиях». Журнал гематологии и онкологии. 5 (1): 41. Дои:10.1186/1756-8722-5-41. ЧВК 3419633. PMID 22839501.
- ^ Клаассен CD, Лю Дж., Чоудхури С. (1999). «Металлотионеин: внутриклеточный белок для защиты от токсичности кадмия». Ежегодный обзор фармакологии и токсикологии. 39: 267–94. Дои:10.1146 / annurev.pharmtox.39.1.267. PMID 10331085.
- ^ Мостафа WZ, Hegazy RA (ноябрь 2015 г.). «Витамин D и кожа: фокус на сложных отношениях: обзор». Журнал перспективных исследований. 6 (6): 793–804. Дои:10.1016 / j.jare.2014.01.011. ЧВК 4642156. PMID 26644915.
- ^ Krizkova S, Fabrik I, Adam V, Hrabeta J, Eckschlager T, Kizek R (2009). «Металлотионеин - перспективный инструмент для диагностики рака». Братиславске Лекарске Листы. 110 (2): 93–7. PMID 19408840.
- ^ Cherian MG, Jayasurya A, Bay BH (декабрь 2003 г.). «Металлотионеины в опухолях человека и потенциальная роль в канцерогенезе». Мутационные исследования. 533 (1–2): 201–9. Дои:10.1016 / j.mrfmmm.2003.07.013. PMID 14643421.
- ^ Басу А., Кришнамурти С. (август 2010 г.). «Клеточные ответы на цисплатин-индуцированное повреждение ДНК». Журнал нуклеиновых кислот. 2010: 1–16. Дои:10.4061/2010/201367. ЧВК 2929606. PMID 20811617.
- ^ Барабан DA (октябрь 2009 г.). «Токсичные биометаллы разрушают будущее ваших детей?». Биометаллы. 22 (5): 697–700. Дои:10.1007 / s10534-009-9212-9. PMID 19205900.
- ^ Сингх В.К., Хэнсон Дж. (Июнь 2006 г.). «Оценка металлотионеина и антител к металлотионеину у нормальных детей и детей-аутистов, подвергшихся воздействию тимеросала вакцинного происхождения». Детская аллергия и иммунология. 17 (4): 291–6. Дои:10.1111 / j.1399-3038.2005.00348.x. PMID 16771783.
- ^ Faber S, Zinn GM, Kern JC, Kingston HM (май 2009 г.). «Соотношение цинка и меди в плазме как биомаркер у детей с расстройствами аутистического спектра». Биомаркеры. 14 (3): 171–80. Дои:10.1080/13547500902783747. PMID 19280374.
- ^ Вела Г., Старк П., Соча М., Зауэр А.К., Хагмейер С., Грабрукер А.М. (2015). «Цинк во взаимодействии кишечника и мозга при аутизме и неврологических расстройствах». Нейронная пластичность. 2015: 972791. Дои:10.1155/2015/972791. ЧВК 4386645. PMID 25878905.
дальнейшее чтение
- Cherian MG, Jayasurya A, Bay BH (декабрь 2003 г.). «Металлотионеины в опухолях человека и потенциальная роль в канцерогенезе». Мутационные исследования. 533 (1–2): 201–9. Дои:10.1016 / j.mrfmmm.2003.07.013. PMID 14643421.
