Нейротрубочка - Neurotubule


Нейротрубочки находятся микротрубочки нашел в нейроны в нервных тканях.[1] Вместе с нейрофиламенты и микрофиламенты, они образуют цитоскелет нейронов. Нейротрубочки представляют собой неразделенные полые цилиндры, состоящие из тубулин белковые полимеры[2] и массивы, параллельные плазматической мембране нейронов.[3] Нейротрубочки имеют внешний диаметр около 23 нм и внутренний диаметр, также известный как центральное ядро, около 12 нм. Стенка нервных трубок имеет ширину около 5 нм. Вокруг нейротрубочки имеется непрозрачная прозрачная зона диаметром около 40 нм.[3] Подобно микротрубочкам, нейротрубочки очень динамичны, и их длину можно регулировать с помощью полимеризация и деполимеризация тубулина.[4]
Несмотря на сходные механические свойства, нейротрубочки отличаются от микротрубочек, обнаруженных в других типах клеток, в отношении их функции и внутриклеточного расположения. Большинство нейротрубочек не закреплены в центр организации микротрубочек (MTOC) как обычные микротрубочки. Вместо этого они высвобождаются для транспортировки в дендриты и аксоны после их зарождение в центросома. Следовательно, оба конца нейротрубочек оканчиваются в цитоплазма вместо.[5]
Нейротрубочки имеют решающее значение в различных клеточные процессы в нейронах. Вместе с нейрофиламенты, они помогают поддерживать форму нейрона и обеспечивают механическую поддержку. Нейротрубочки также помогают транспортировать органеллы, везикулы, содержащие нейротрансмиттеры, мессенджер РНК и другие внутриклеточные молекулы внутри нейрона.[6]
Структура и динамика

Сочинение
Подобно микротрубочкам, нейротрубочки состоят из белковых полимеров α-тубулин и β-тубулин. α-тубулин и β-тубулин - глобулярные белки, которые тесно связаны. Они объединяются в димер, называемый тубулин. Нейротрубочки обычно собираются из 13 протофиламентов, которые полимеризуются из димеров тубулина. Поскольку димер тубулина состоит из одного α-тубулина и одного β-тубулина, один конец нейротрубочки обнажен α-тубулином, а другой конец - β-тубулином, эти два конца вносят вклад в полярность нервной трубки - плюс (+) конец и минус (-) конец. Субъединица β-тубулина обнажена на плюсовом (+) конце. Эти два конца различаются по скорости роста: конец с плюсом (+) - это быстрорастущий конец, а конец с минусом (-) - это медленнорастущий конец. Оба конца имеют свою собственную скорость полимеризации и деполимеризации димеров тубулина, чистая полимеризация вызывает сборку тубулина, следовательно, длину нейротрубочек.[4]
Динамическая нестабильность
Рост нейротрубочек регулируется динамическая нестабильность.[7] Он характеризуется отчетливыми фазами роста и быстрой усадки. Переход от роста к быстрому сокращению называется «катастрофой». Обратное называется «спасением».
Поляризованные массивы нейротрубочек
Нейроны имеют поляризованную сеть нейротрубочек.[8] Аксоны Большинство нейронов содержат нейротрубочки с плюсовым (+) концом, равномерно направленным к концу аксона, и минус (-) концом, ориентированным к телу клетки, аналогично общей ориентации микротрубочек в других типах клеток. С другой стороны, дендриты содержат нейротрубочки со смешанной полярностью. Половина из них указывает своим плюсовым (+) концом в сторону верхушки дендрита, а другая половина указывает им в сторону тела клетки, напоминая антипараллельный массив микротрубочек митотическое веретено.
Поляризованная сеть нейротрубочек формирует основу для избирательного переноса грузов в аксоны и дендриты.[9] Например, когда мутации происходят в динеин, а моторный белок это критически важно для поддержания однородной ориентации аксональных нейротрубочек, полярность нейротрубочек в аксоне становится смешанной.[10] В результате дендритные белки неправильно транспортируются в аксоны.[11]
Для неполяризованных нейронов нейриты содержат 80% нейротрубочек с положительным (+) концом, обращенным к концу.[нужна цитата ]
Аксональный транспорт
Нейротрубочки несут ответственность за транспортировку внутриклеточных материалов. Грузы транспортируются моторными белками, которые используют нейротрубочки как «след». В аксональный транспорт могут быть классифицированы по скорости - быстрая или медленная и по направлению - антероградная или ретроградная.
Быстрый и медленный аксональный транспорт
Грузы перевозятся как быстро, так и медленно. Скорость быстрого аксонального транспорта составляет 50-500 мм в день, в то время как медленный аксональный транспорт, как было установлено, составляет 0,4 мм в день у золотых рыбок и 1-10 мм в день в нерве млекопитающих. Транспорт нерастворимого белка способствует быстрому перемещению, тогда как медленный транспорт транспортирует до 40-50% растворимого белка.[12] Скорость транспорта зависит от типа перевозимого груза. Нейротрофины, семейство белков, важных для выживания нейрона, а также органеллы, такие как митохондрии и эндосомы, транспортируются с высокой скоростью. Напротив, структурные белки, такие как тубулин и субъединицы нейрофиламентов, транспортируются с более низкой скоростью. Белкам, которые переносятся от спинного мозга к стопе, может потребоваться до года.[13]
Антероградный транспорт и ретроградный транспорт

Антероградный транспорт относится к транспортировке грузов от минусового (-) конца к плюсовому (+) концу, тогда как ретроградный транспорт - это транспортировка грузов в обратном направлении. Антероградный транспорт - это часто транспортировка из Тело клетки к периферии нейрона, тогда как ретроградный транспорт переносит органеллы и пузырьки от конца аксона к телу клетки.
Антероградный транспорт регулируется кинезины, класс моторных белков. Кинезины имеют два головных домена, которые работают вместе, как ступни: один связывается с нейротрубочками, а другой связывается, а первый диссоциирует. Связывание АТФ повышает сродство кинезинов к нейротрубочкам. Когда АТФ связывается с одним головным доменом, в головном домене будут индуцироваться конформационные изменения, заставляющие его прочно связываться с нейротрубочкой. Другой АТФ затем связывается с другим головным доменом, в то время как бывший АТФ гидролизуется, а головной домен диссоциирует. Процесс повторяется циклически, так что кинезины перемещаются по нейротрубочкам вместе с органеллами и везикулярными грузами, которые они несут.[14]
Ретроградный транспорт регулируется динеины, также класс моторных белков. Он имеет аналогичные структуры с кинезинами, а также механизм транспортировки. Он транспортирует грузы с периферии к телу клетки в нейронах.
Белки, связанные с нейротрубочками

Белки, связанные с микротрубочками (MAP) - это белки, которые взаимодействуют с микротрубочками, связываясь с их субъединицами тубулина и регулируя их стабильность. Состав нейротрубочек MAP заметно отличается от микротрубочек не нейрональных клеток.[15] Например, MAP типа II обнаруживаются исключительно в нейронах, а не в других клетках. К наиболее изученным относятся: MAP2, и тау.
MAP по-разному распределены в цитоплазме нейронов. Их распределение также варьируется на разных стадиях развития нейрона. Ювенильная изоформа MAP2 присутствует на нейротрубочках аксонов и дендритах развивающихся нейронов, но становится пониженный по мере созревания нейронов. Взрослая изоформа MAP2 обогащена нейротрубочками дендритов и практически отсутствует в нейротрубочках аксонов.[16] Напротив, тау-белок отсутствует на нейротрубочках дендритов, а его присутствие ограничено аксональными нейротрубочками. В фосфорилирование тау в определенных местах требуется для связывания тау с нейротрубочками. В здоровом нейроне этот процесс не происходит в значительной степени в дендритах, вызывая отсутствие тау на дендритных нейротрубочках. Связывание тау различных изоформ и разных уровней фосфорилирования регулирует стабильность нейротрубочек. Обнаружено, что нейротрубочки нейронов центральной нервной системы эмбриона содержат более высокофосфорилированный тау, чем у взрослых.[17] Кроме того, тау отвечает за связывание нервных трубок.[18]
Микротрубочка плюс белки, отслеживающие концы (+ TIP) представляют собой MAP, которые накапливаются на плюсовом конце микротрубочек. В нейротрубочках + TIP контролируют динамику нейротрубочек, направление роста и взаимодействие с компонентами клеточная кора. Они важны для расширения нейритов и отросток аксона.[19]
Многие другие, не специфичные для нейронов MAP, такие как MAP1B и MAP6, находятся на нервных трубках. Более того, взаимодействие между актин а некоторые MAP обеспечивают потенциальную связь между нейротрубочками и актиновые нити.[20]
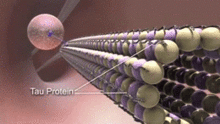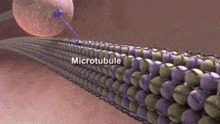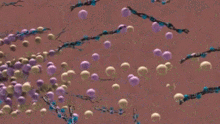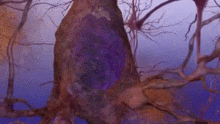
Нарушение целостности и динамики нейротрубочек может мешать выполняемым ими клеточным функциям и вызывать различные неврологические расстройства.
Болезнь Альцгеймера
В Болезнь Альцгеймера, гиперфосфорилирование из тау-белок вызывает диссоциацию тау-белка от нейротрубочек и тау-белка неправильная укладка. Агрегация неправильно свернутого тау образует нерастворимые нейрофибриллярные сплетения что является характерным признаком болезни Альцгеймера.[21] Это патологическое изменение называется таупатия. Нейротрубочки становятся склонными к распаду белками, разделяющими микротрубочки, когда тау диссоциирует.[22] В результате важные процессы в нейроне, такие как аксональный транспорт и нейронная связь, будут нарушены, создавая основу для нейродегенерация.[23] Считается, что распад нейротрубочек происходит по разным механизмам в аксонах и дендритах.
Отслоение тау дестабилизирует нейротрубочки, позволяя чрезмерно разрезать катанин, заставляя его распадаться. Распад нейротрубочек в аксоне нарушает транспорт мРНК и сигнальных молекул к концу аксона.[22] Что касается дендритов, новые данные свидетельствуют о том, что аномальная инвазия тау-белка в дендриты вызывает повышенный уровень дендритной TTLL6 (Тубулин-тирозин-лигаза-6), который повышает полиглутамилирование статус нейротрубочек в дендритах.[22] Потому что спастин проявляет сильное предпочтение полиглутамилированным микротрубочкам, дендритные нейротрубочки становятся восприимчивыми к спастин-индуцированной дезинтеграции.[22] Потеря сетей нейротрубочек в дендритах и аксонах, наряду с образованием нейрофибриллярных клубков, приводит к нарушению транспортировки важных грузов через клетку, что в конечном итоге может привести к апоптоз.[24]
Лиссэнцефалия

Лиссэнцефалия - редкое врожденное заболевание, при котором головной мозг теряет складки (извилины ) и канавки (борозды ), делая поверхность мозга гладкой. Это вызвано дефектным миграция нейронов.[25] Неспособность постмитотических нейронов занять правильное положение приводит к формированию неорганизованного и утолщенного четырехслойного неокортекса вместо нормального шестислойный неокортекс. Тяжесть лиссэнцефалии варьируется от полной потери складок головного мозга (агирия ) к общему сокращению кортиколовых складок (пахигирия ).
Нейротрубочка играет центральную роль в механизме миграции нейронов. Нарушение миграции нейронов у людей с лиссэнцефалией вызвано: мутации связаны с генами, связанными с нейротрубочками, такими как LIS1 и DCX.[26] LIS1 кодирует адаптерный белок Lis1, который отвечает за стабилизацию нейротрубочки во время миграции нейронов за счет минимизации катастрофы нейротрубочек. Он также регулирует моторный белок динеин, который играет решающую роль в перемещении ядра по нейротрубочкам. Это действие продвигает сома нейрона вперед, что является важным шагом в миграции нейронов.[27] Кроме того, мутации в LIS1 Было обнаружено, что нарушает однородную плюсово-дистальную полярность аксонов в моделях на животных, вызывая неправильный перенос дендритных белков в аксоны.[11] С другой стороны, DCX кодирует белок даблкортин который взаимодействует с Lis1 на вершине поддержки структуры 13 протофиламентов нейротрубочек.
Периферическая невропатия, вызванная химиотерапией
Периферическая невропатия, вызванная химиотерапией это патологическое изменение в нейронах, вызванное нарушением динамики нейротрубочек химиотерапевтическими препаратами, проявляющееся в боли, онемении, покалывании и мышечная слабость в конечностях. Это необратимое заболевание, которым страдает около трети пациентов, проходящих курс химиотерапии.[28] Ингибиторы тубулина подавляют митоз в раковых клетках, влияя на стабильность и динамику микротрубочек, которые формируют митотическое веретено ответственный за сегрегация хромосом во время митоза подавляя рост опухоли.
Однако эти же препараты воздействуют также на нейротрубочки нейронов. Винбластин связывается со свободным тубулином и снижает их способность к полимеризации, способствуя деполимеризации нейротрубочек. С другой стороны, паклитаксел связывается с крышкой нейротрубочек, что предотвращает превращение связанного с тубулином GTP в GDP, процесс, который способствует деполимеризации нейротрубочек. Для in vitro нейроны, обработанные паклитакселом, нарушают структуру полярности нервных трубок, что может привести к долгосрочному повреждению нейронов. Кроме того, чрезмерная стабилизация нейротрубочек нарушает их способность выполнять важные клеточные функции в нейронах.[29]
Смотрите также
использованная литература
- ^ "Медицинское определение НЕЙРОТУБОЧКИ". www.merriam-webster.com. Получено 2019-03-25.
- ^ Нервная система человека: строение и функции. Нобак, Чарльз Р. (Charles Robert), 1916-2009. (6-е изд.). Тотова, Нью-Джерси: Humana Press. 2005 г. ISBN 1588290395. OCLC 222291397.CS1 maint: другие (ссылка на сайт)
- ^ а б Lane NJ, Treherne JE (июль 1970 г.). «Окрашивание лантаном нейротрубочек в аксонах из ганглиев тараканов». Журнал клеточной науки. 7 (1): 217–31. PMID 4097712.
- ^ а б Нейрональная специфичность, пластичность и паттерны. Москона, А.А. (Арон Артур), 1922-2009, Монрой, Альберто, Хант, Р. Кевин. Нью-Йорк: Academic Press. 1982 г. ISBN 9780080584409. OCLC 276661314.CS1 maint: другие (ссылка на сайт)
- ^ Купер, Джеффри М. (2000). «Микротрубочки». Клетка: молекулярный подход. 2-е издание.
- ^ Медведь М.Ф., Коннорс Б.В., Парадсо Массачусетс. Неврология: исследование мозга (3-е изд.). Липпинкотт Уильямс и Уилкинс. п. 41.
- ^ Марк Киршнер; Митчисон, Тим (ноябрь 1984 г.). «Динамическая нестабильность роста микротрубочек». Природа. 312 (5991): 237–242. Bibcode:1984Натура.312..237М. Дои:10.1038 / 312237a0. ISSN 1476-4687. PMID 6504138.
- ^ Кван А.С., Домбек Д.А., Уэбб У.В. (август 2008 г.). «Массив поляризованных микротрубочек в апикальных дендритах и аксонах». Труды Национальной академии наук Соединенных Штатов Америки. 105 (32): 11370–5. Bibcode:2008PNAS..10511370K. Дои:10.1073 / pnas.0805199105. ЧВК 2496886. PMID 18682556.
- ^ ван Бёнинген, С.Ф., Hoogenraad CC (август 2016 г.). «Полярность нейронов: ремоделирование организации микротрубочек». Текущее мнение в нейробиологии. 39: 1–7. Дои:10.1016 / j.conb.2016.02.003. PMID 26945466.
- ^ Конде С, Касерес А (май 2009 г.). «Сборка микротрубочек, организация и динамика в аксонах и дендритах». Обзоры природы. Неврология. 10 (5): 319–32. Дои:10.1038 / nrn2631. PMID 19377501.
- ^ а б Дубей Дж, Ратнакаран Н., Кушика СП (2015). «Нейродегенерация и динамика микротрубочек: смерть от тысячи разрезов». Границы клеточной неврологии. 9: 343. Дои:10.3389 / fncel.2015.00343. ЧВК 4563776. PMID 26441521.
- ^ Grafstein B, McEwen BS, Shelanski ML (июль 1970 г.). «Аксональный транспорт белка нейротрубочек». Природа. 227 (5255): 289–90. Bibcode:1970Натура.227..289Г. Дои:10.1038 / 227289a0. PMID 4193613.
- ^ "Являются ли микротрубочки мозгом нейрона". Джон Лифф, доктор медицины. 2015-11-29. Получено 2019-04-10.
- ^ 1958-, Берг, Джереми М. (Джереми Марк) (2002). Биохимия. Тимочко, Джон Л., 1948-, Страйер, Люберт., Страйер, Люберт. (5-е изд.). Нью-Йорк: W.H. Фримен. ISBN 0716730510. OCLC 48055706.CS1 maint: числовые имена: список авторов (ссылка на сайт)
- ^ Аль-Бассам Дж., Озер Р.С., Сейфер Д., Халпайн С., Миллиган Р.А. (июнь 2002 г.). «MAP2 и тау связываются продольно вдоль внешних гребней протофиламентов микротрубочек». J. Cell Biol. 157 (7): 1187–96. Дои: 10.1083 / jcb.200201048. ЧВК 2173547. PMID 12082079.
- ^ Демельт Л., Халпаин С. (2005). «Семейство MAP2 / Tau белков, связанных с микротрубочками». Геномная биология. 6 (1): 204. Дои:10.1186 / gb-2004-6-1-204. ЧВК 549057. PMID 15642108.
- ^ Канемару К., Такио К., Миура Р., Титани К., Ихара И. (май 1992 г.). «Фосфорилирование тау-белка в парных спиральных филаментах по типу плода». Журнал нейрохимии. 58 (5): 1667–75. DOI: 10.1111 / j.1471-4159.1992.tb10039.x. PMID 1560225.
- ^ Мандельков Э., Мандельков Э.М. (февраль 1995 г.). «Микротрубочки и ассоциированные с микротрубочками белки». Curr. Мнение. Cell Biol. 7 (1): 72–81. Дои:10.1016/0955-0674(95)80047-6. PMID 7755992.
- ^ Ахманова А., Hoogenraad CC (февраль 2005 г.). "Белки слежения за плюсами микротрубочек: механизмы и функции". Текущее мнение в области клеточной биологии. 17 (1): 47–54. Дои:10.1016 / j.ceb.2004.11.001. PMID 15661518.
- ^ Myers, Kenneth A .; Баас, Питер В. (2011), Галло, Джанлука; Ланье, Лорен М. (ред.), "Взаимодействие микротрубочек-актин во время развития нейронов", Нейробиология актина: от нейруляции к синаптической функции, Advances in Neurobiology, Springer New York, pp. 73–96, Дои:10.1007/978-1-4419-7368-9_5, ISBN 9781441973689
- ^ Икбал К., Лю Ф., Гонг С.Х., Грундке-Икбал I (декабрь 2010 г.). «Тау при болезни Альцгеймера и родственных таупатиях». Текущее исследование болезни Альцгеймера. 7 (8): 656–64. Дои:10.2174/156720510793611592. ЧВК 3090074. PMID 20678074.
- ^ а б c d Жан Д.К., Баас П.В. (ноябрь 2013 г.). «Это сокращает два пути: потеря микротрубочек во время болезни Альцгеймера». Журнал EMBO. 32 (22): 2900–2. Дои:10.1038 / emboj.2013.219. ЧВК 3831311. PMID 24076651.
- ^ Ван И, Мандельков Э (январь 2016 г.). «Тау в физиологии и патологии». Обзоры природы. Неврология. 17 (1): 5–21. Дои:10.1038 / номер 2015.1. PMID 26631930.
- ^ Mudher A, Lovestone S (январь 2002 г.). «Болезнь Альцгеймера - разве тауисты и баптисты наконец-то пожмут друг другу руки?». Тенденции в неврологии. 25 (1): 22–6. Дои:10.1016 / S0166-2236 (00) 02031-2. PMID 11801334.
- ^ Добинс WB (1987). «Аспекты развития лизэнцефалии и синдромов лиссэнцефалии». Врожденные дефекты. Серия оригинальных статей. 23 (1): 225–41. PMID 3472611.
- ^ Mochida GH (сентябрь 2009 г.). «Генетика и биология микроцефалии и лиссэнцефалии». Семинары по детской неврологии. 16 (3): 120–6. Дои:10.1016 / j.spen.2009.07.001. ЧВК 3565221. PMID 19778709.
- ^ Танака Т., Сернео Ф.Ф., Хиггинс С., Гамбелло М.Дж., Виншоу-Борис А., Глисон Дж. Г. (июнь 2004 г.). «Lis1 и даблкортин действуют вместе с динеином, опосредуя связывание ядра с центросомой при миграции нейронов». Журнал клеточной биологии. 165 (5): 709–21. Дои:10.1083 / jcb.200309025. ЧВК 2172383. PMID 15173193.
- ^ Браун Т.Дж., Седхом Р., Гупта А. (февраль 2019 г.). «Периферическая невропатия, вызванная химиотерапией». JAMA Онкология. 5 (5): 750. Дои:10.1001 / jamaoncol.2018.6771. PMID 30816956.
- ^ Баас П.В., Ахмад Ф.Дж. (октябрь 2013 г.). «Помимо таксола: лечение заболеваний и повреждений нервной системы на основе микротрубочек». Мозг. 136 (Pt 10): 2937–51. Дои:10.1093 / мозг / awt153. ЧВК 3784279. PMID 23811322.

