QSER1 - QSER1 - Wikipedia
| QSER1 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||
| Псевдонимы | QSER1, богатые глутамином и серином 1 | ||||||||||||||||||||||||
| Внешние идентификаторы | MGI: 2138986 ГомолоГен: 11710 Генные карты: QSER1 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ортологи | |||||||||||||||||||||||||
| Разновидность | Человек | Мышь | |||||||||||||||||||||||
| Entrez | |||||||||||||||||||||||||
| Ансамбль | |||||||||||||||||||||||||
| UniProt |
| ||||||||||||||||||||||||
| RefSeq (мРНК) | |||||||||||||||||||||||||
| RefSeq (белок) |
| ||||||||||||||||||||||||
| Расположение (UCSC) | Chr 11: 32,89 - 32,99 Мб | Chr 2: 104,75 - 104,82 Мб | |||||||||||||||||||||||
| PubMed поиск | [3] | [4] | |||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Протеин, богатый глютамином серином 1 или же QSER1 это белок закодировано QSER1 ген.[5]
Функция этого белка в настоящее время неизвестна. QSER1 имеет один псевдоним FLJ21924.[5]
Ген
Место расположения
Ген QSER1 находится на коротком плече хромосомы 11 (11p13), начиная с 32 914 792 пар оснований и заканчивая 33 001 816 пар оснований. Его длина составляет 87 024 п.н. Он расположен между генами DEPDC7 и PRRG4 и находится на 500000 п.н. ниже гена Wilms Tumor 1 (WT1 ), что связано с множественными патологиями.[5][6]
Гомология
Ортологи
QSER1 высоко консервативен у большинства видов клады. Хордовые. Ортологи были обнаружены у приматов, птиц, рептилий, амфибий и рыб еще в латимерия, которые разошлись 414,9 миллиона лет назад.[5][6]
Паралоги
QSER1 имеет один паралог в людях, Богатые пролином 12, или PRR12. PRR12 находится на хромосоме 9 по адресу 9q13.33, функция которого неизвестна. PRR12 встречается у большинства хордовых еще до целаканта.[7] Событие дупликации, вероятно, произошло где-то в хордовой линии передачи около дивергенции латимерии. И PRR12, и QSER1 содержат консервативный домен DUF4211 около 3 ’концов генов.[5][7]
мРНК
Факторы промотора и транскрипции
Промоторная область для QSER1 имеет длину 683 п.н. и находится на хромосоме 11 между 32 914 224 и 32 914 906 п.н. Существует некоторое перекрытие между промоторной областью и 5 ’UTR QSER1. Прогнозируемые факторы транскрипции с сохранением включают (но не ограничиваются ими) EGR1, p53, E2F3, E2F4, PLAG1, NeuroD2, Myf5, ИКАРОС1, SMAD 3, КРАБ, MZF1, и c-Myb.[8]
Выражение
Нормальное выражение
Экспрессия QSER1 наблюдается на уровнях ниже 50% во многих тканях. Однако заметное выражение видно в скелетные мышцы, то приложение, тройничные ганглии, стебли мозжечка, мосты, спинной мозг, ресничный узел, бледный шар, субталамическое ядро, ганглий дорзального корня, плод печень, надпочечник, яичник, тело матки, сердечные миоциты, то атриовентрикулярный узел, кожа, гипофиз, язык, ранние предшественники эритроидов и миндалина.[9][10]
Дифференциальное выражение
Заметное снижение экспрессии QSER1 было отмечено в почках. мезангиальные клетки в ответ на лечение 25 мМ глюкозы. Это состояние было изучено, поскольку в этих клетках была отмечена дифференциальная экспрессия генов, участвующих в регуляции клеточного цикла, в ответ на высокие уровни глюкозы, наблюдаемые с сахарный диабет.[11][12]Другое исследование отметило сверхэкспрессию QSER1 при патологических кардиомиопатия. Это состояние связано с измененной экспрессией генов, участвующих в иммунных ответах, передаче сигналов, росте и пролиферации клеток, а также инфильтрации В-лимфоциты.[13][14]
Дифференциальная экспрессия QSER1 наблюдается при множественных раковых состояниях. Сверхэкспрессия QSER1 была отмечена при лимфоме Беркитта.[9] Выражение QSER1 также увеличивается с увеличением Оценка Глисона (более поздние стадии) рака простаты.[15] В исследовании реакции рака груди на паклитаксел и фторурацил-доксорубицин-циклофосфамид химиотерапия было отмечено, что линии рака молочной железы с более высокими уровнями QSER1 с большей вероятностью отвечали на лечение, чем линии с недостаточной экспрессией QSER1.[16]Более высокая экспрессия QSER1 была также отмечена в эпителиальных клетках молочных желез из иммортализованных клеточных линий, чем в эпителиальных клетках молочных желез из клеточных линий с конечной продолжительностью жизни.[17]
3 ’UTR
В 3 ’UTR QSER1 прогнозируется более 20 петель ствола. 16 стеблевых петель обнаруживаются в пределах первых 800 п.н. 3 ’UTR.[18] 3 ’UTR почти полностью консервативен у млекопитающих с меньшей сохранностью, наблюдаемой у других организмов.[19]
Протеин
Общие свойства

Белок QSER1 имеет длину 1735 аминокислот.[20] В составе пептида значительно высокое содержание серина и глутамина: 14,7% остатков серина и 8,9% глутамина.[21]
Сохранение
Белок QSER1 является высококонсервативным у хордовых видов. В таблице ниже представлена информация об ортологах белков.
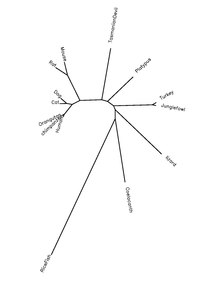
| Род и название вида | Распространенное имя | Регистрационный номер белка[22] | Идентичность последовательности человеческому белку[22] |
|---|---|---|---|
| Homo sapiens | Люди | NP_001070254.1 | |
| Пан троглодиты | Шимпанзе | XP_508354.3 | 99% |
| Macaca mulatta | Макака резус | NP_001244647.1 | 98% |
| Каллитрис Яхус | Мартышка | XP_002755192.1 | 96% |
| Ailuropoda melanoleuca | Гигантская панда | XP_002917539.1 | 90% |
| Loxodonta africana | Слон | XP_003412344.1 | 88% |
| Mus musculus | Мышь | NP_001116799.1 | 81% |
| Monodelphis domestica | Опоссум | XP_001368629.1 | 71% |
| Орниторинчус анатинус | Утконос | XP_001506659.2 | 75% |
| Taeniopygia guttata | Зебра зяблик | XP_002195876.1 | 69% |
| Gallus gallus | Курица | NP_001186343.1 | 69% |
| Анолис каролиненсис | Каролина аноле (ящерица) | XP_003214747.1 | 62% |
| Такифугу рубрипс | Японский иглобрюх | XP_003977915.1 | 48% |
| Latimeria chalumnae | Латимерия | Нет данных | 62% |
Домены и мотивы

Белок QSER1 содержит два высококонсервативных домена, обнаруженных не только в QSER1, но и в других белковых продуктах. К ним относятся домен PHA02939 из аминокислоты 1380-1440 и домен DUF4211 из аминокислоты 1522-1642.[23][24]Ядерная локализация была предсказана pSORT. Это свойство сохранялось от QSER1 человека до QSER1 латимерии. Множественные консервативные сигналы ядерной локализации также были предсказаны в белке QSER1 с помощью pSORT.[25]
Структура
Прогнозы структуры белка QSER1 показывают, что белок содержит много альфа спирали.[26][27][28] NCBI cBLAST предсказал структурное сходство между белком QSER1 и Schizosaccharomyces pombe (делящиеся дрожжи) РНК-полимераза II Цепь. Две области сходства встречаются между аминокислотами 56–194 и 322–546.[27] Эта первая область (56-194) является регуляторной областью как в человеческой, так и в дрожжевой РНК-полимеразе II, содержащей множественные повторы последовательности YSPTSPSYS. Фосфорилирование сериновых остатков в этой области регулирует прогрессию через стадии транскрипции гена.[29] Для этого региона была предоставлена трехмерная структура. Структурно подобная область находится на внешней стороне белковой молекулы и образует часть ДНК-связывающей щели.
Дальнейшее структурное сходство со связывающим белком вирусной РНК-полимеразы было предсказано Phyre2.[28] Эта структура находится в самом конце белка между аминокислотами 1671-1735. Структура имеет длинную область альфа-спиралей, которые также были предсказаны SDSC Biology Workbench PELE. Изображение структурно подобной области и выравнивания последовательностей показано справа. Области перед идентифицированным структурно подобным доменом показывают две другие альфа-спирали, предсказанные с высокой достоверностью.[28]
Пост-трансляционные модификации
Фосфорилирование

На белке QSER1 имеется 12 подтвержденных сайтов фосфорилирования. Восемь из них - фосфосерины, один фосфотирозин и три фосфотреонина. Было показано, что три из этих сайтов фосфорилируются с помощью ATM и ATR в ответ на повреждение ДНК.[30] 123 других возможных сайта фосфорилирования были предсказаны с помощью инструмента ExPASy NetPhos.[31]
СУМОилирование
Взаимодействие белка QSER1 с СУМО был отмечен в нескольких протеом общенациональные исследования.[32][33] Предсказанные сайты SUMOylation были обнаружены в белке QSER1. Высококонсервативные сайты SUMOylation встречаются с последовательностью MKMD на аминокислоте 794, VKIE на 1057, VKTG на 1145, LKSG на 1157, VKQP на 1487 и VKAE на 1492.[34]

Взаимодействия
Банкомат / ATR
Фосфорилирование QSER1 по трем сериновым остаткам, S1228, S1231 и S1239, с помощью ATM и ATR в ответ на повреждение ДНК было обнаружено в протеом всестороннее исследование.[30]
СУМО
Взаимодействие QSER1 с СУМО был подтвержден в нескольких исследованиях.[32][33] Роль SUMOylation в функции QSER1 неясна. Однако может существовать связь между QSER1 и SUMO в ответ на эндоплазматический ретикулум стресс (часто вызванный накоплением неправильно свернутых белков). В исследовании стресса ER, QSER1 был помечен как ген ответа на стресс ER с измененной экспрессией.[35] Далее, в исследовании SUMOylation в ответ на накопленные неправильно свернутые белки и стресс ER обнаружил, что QSER1 взаимодействует с SUMO в этой ситуации.[32] Любая связь между этими двумя видами деятельности не изучена и не подтверждена.
РНК-полимераза II
Прямое взаимодействие QSER1 с РНК-полимеразой II было обнаружено в исследовании, проведенном Moller, et al. Было показано, что взаимодействие происходит с ДНК-направленной субъединицей РНК-полимеразы II, RPB1, РНК-полимеразы II в течение обоих митоз и межфазный. Колокализация / взаимодействие QSER1 было показано с регуляторной областью RPB1 с 52 повторами гептапептида (YSPTSPSYS).[29]
NANOG и TET1
Взаимодействие между гомеобокс протеин NANOG и Тет-метилцитозиндиоксигеназа 1 (TET1), как было показано, играет важную роль в установлении плюрипотентности во время генерации индуцированные плюрипотентные стволовые клетки. Было показано, что белок QSER1 взаимодействует как с NANOG, так и с TET1.[36]
Убиквитин
QSER1 взаимодействует с убиквитин в двух исследованиях субстратов на уровне протеома.[37][38] Конкретные подробности этого взаимодействия не изучены.
Патология
Измененная экспрессия QSER1 отмечается при патологической кардиомиопатии, лимфоме Беркитта, раке простаты и некоторых упомянутых выше раках груди.[8][9][13][15] NCBI AceView перечисляет несколько мутаций, связанных с другими патологиями, включая делецию восьми пар оснований и делецию 13 пар оснований в QSER1, связанную с лейомиосаркома из матка и разница в 57 пар оснований в нейробластоме. Также перечислены несколько вариантов сращивания с усеченными 5 'и / или 3' концами, которые часто наблюдаются при раковых заболеваниях.[39] Кроме того, согласно базе данных NCBI OMIM, множественные патологии связаны с изменениями в области 11p13 и, следовательно, могут вовлекать QSER1.[40] К ним относятся экссудативный Витреоретинопатия 3,[41] Семейный Кандидоз 3,[42] Централопатический Эпилепсия,[43] и аутосомно-рецессивная глухота 51.[44]QSER1 также был отмечен как ген восприимчивости к болезнь Паркинсона.[35]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000060749 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000074994 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б c d е "Ген NCBI QSER1".
- ^ а б "Genecards QSER1".
- ^ а б "Ген NCBI PRR12".
- ^ а б "Инструменты Genomatix: Эльдорадо".
- ^ а б c "NCBI GeoProfiles db; QSER1 GDS596".
- ^ "Профиль NCBI EST db; QSER1".
- ^ Кларксон М.Р., Мерфи М., Гупта С., Ламбе Т., Маккензи Х.С., Годсон С., Мартин Ф., Брэди Х.Р. (март 2002 г.). «Высокая экспрессия измененного глюкозой гена в мезангиальных клетках. Экспрессия гена регулирующего актин белка запускается окислительным стрессом и разборкой цитоскелета». Журнал биологической химии. 277 (12): 9707–12. Дои:10.1074 / jbc.M109172200. PMID 11784718.
- ^ "NCBI GeoProfiles db; QSER1 GDS1891".
- ^ а б Галиндо С.Л., Скиннер М.А., Эррами М., Олсон Л.Д., Уотсон Д.А., Ли Дж., Маккормик Дж.Ф., Макивер Л.Дж., Кумар Н.М., Фам Т.К., Гарнер Х.Р. (9 декабря 2009 г.). «Транскрипционный профиль кардиомиопатии, вызванной изопротеренолом, и сравнение с гипертрофией сердца, вызванной физической нагрузкой, и сердечной недостаточностью человека». BMC Physiology. 9 (23): 23. Дои:10.1186/1472-6793-9-23. ЧВК 2799380. PMID 20003209.
- ^ "NCBI GeoProfiles db; QSER1 GDS3596".
- ^ а б "NCBI GeoProfiles db; QSER1 GDS1746".
- ^ "NCBI GeoProfiles db; QSER1 GDS3721".
- ^ "NCBI GeoProfiles db; QSER1 GDS2810".
- ^ "мфолд".
- ^ "SDSC Biology Workbench ClustalW".
- ^ "NCBI QSER1 Protein".
- ^ "Рабочий стол SDSC по биологии; SAPS".
- ^ а б «Национальный центр биотехнологической информации NCBI».
- ^ "NCBI Conservation domains db; DUF4211".
- ^ "NCBI консервативные домены db; PHA02939".
- ^ "pSORT II Prediction".
- ^ "Инструментальные средства биологии SDSC; PELE".
- ^ а б "NCBI cBLAST; QSER1".
- ^ а б c "Phyre2".
- ^ а б Möller A, Xie SQ, Hosp F, Lang B, Phatnani HP, James S, Ramirez F, Collin GB, Naggert JK, Babu MM, Greenleaf AL, Selbach M, Pombo A (июнь 2012 г.). «Протеомный анализ митотической РНК-полимеразы II обнаруживает новые взаимодействия и связь с белками, дисфункциональными при болезни». Молекулярная и клеточная протеомика. 11 (6): M111.011767. Дои:10.1074 / mcp.M111.011767. ЧВК 3433901. PMID 22199231.
- ^ а б Мацуока С., Баллиф Б.А., Смогоржевска А., Макдональд Э.Р., Хуров К.Е., Ло Дж., Бакаларски К.Э., Чжао З. и др. (Май 2007 г.). «Анализ субстрата ATM и ATR выявляет обширные белковые сети, реагирующие на повреждение ДНК». Наука. 316 (5828): 1160–6. Bibcode:2007Научный ... 316.1160M. Дои:10.1126 / наука.1140321. PMID 17525332. S2CID 16648052.
- ^ "ExPASy NetPhos".
- ^ а б c Tatham MH, Matic I, Mann M, Hay RT (21 июня 2011 г.). «Сравнительный протеомный анализ определяет роль SUMO в контроле качества белка». Научная сигнализация. 4 (178): RS4. Дои:10.1126 / scisignal.2001484. PMID 21693764. S2CID 649212.
- ^ а б Bruderer R, Tatham MH, Plechanovova A, Matic I, Garg AK, Hay RT (февраль 2011 г.). «Очистка и идентификация эндогенных конъюгатов polySUMO». Отчеты EMBO. 12 (2): 142–8. Дои:10.1038 / embor.2010.206. ЧВК 3049431. PMID 21252943.
- ^ «ExPASy SUMOplot».
- ^ а б Домброски Б.А., Наяк Р.Р., Ювенс К.Г., Анкенер В., Чунг В.Г., Шпильман Р.С. (май 2010 г.). «Экспрессия генов и генетические вариации в ответ на стресс эндоплазматического ретикулума в клетках человека» (PDF). Американский журнал генетики человека. 86 (5): 719–29. Дои:10.1016 / j.ajhg.2010.03.017. ЧВК 2869002. PMID 20398888. Архивировано из оригинал (PDF) на 2013-10-04. Получено 2013-05-02.
- ^ Коста Й, Динг Дж., Теуниссен Т.В., Файола Ф., Хор Т.А., Шлиаха П.В., Фидальго М., Сондерс А., Лоуренс М., Дитманн С., Дас С., Левассер Д. Н., Ли З., Сюй М., Рейк В., Сильва Дж. (Март 2013 г.). «NANOG-зависимая функция TET1 и TET2 в установлении плюрипотентности». Природа. 495 (7441): 370–4. Bibcode:2013Натура.495..370C. Дои:10.1038 / природа11925. ЧВК 3606645. PMID 23395962.
- ^ Ким В., Беннетт Э.Дж., Хаттлин Э.Л., Го А., Ли Дж., Поссемато А., Сова М.Э., Рад Р., Раш Дж., Гребень М.Дж., Харпер Дж.В., Гайги С.П. (октябрь 2011 г.). «Систематическая и количественная оценка протеома, модифицированного убиквитином». Молекулярная клетка. 44 (2): 325–40. Дои:10.1016 / j.molcel.2011.08.025. ЧВК 3200427. PMID 21906983.
- ^ Даниэльсен Дж. М., Сильвестерсен КБ, Беккер-Йенсен С., Шкларчик Д., Поульсен Дж. В., Хорн Х., Йенсен Л. Дж., Майланд Н., Нильсен М.Л. (март 2011 г.). «Масс-спектрометрический анализ убиквитилирования лизина выявляет беспорядочные связи на уровне сайта». Молекулярная и клеточная протеомика. 10 (3): M110.003590. Дои:10.1074 / mcp.M110.003590. ЧВК 3047152. PMID 21139048.
- ^ "NCBI AceView db; QSER1".
- ^ "NCBI OMIM db; 11p13".
- ^ "NCBI OMIM db; Экссудативная витреоретинопатия 3".
- ^ "NCBI OMIM db; кандидоз, семейный 3".
- ^ "NCBI OMIM db; Централопатическая эпилепсия".
- ^ "NCBI OMIM db; Аутосомно-рецессивная глухота 51".




