TP53-индуцибельный регулятор гликолиза и апоптоза - TP53-inducible glycolysis and apoptosis regulator
В TP53-индуцибельный регулятор гликолиза и апоптоза (TIGAR) также известный как фруктозо-2,6-бисфосфатаза TIGAR является фермент что у людей кодируется C12orf5 ген.[5][6][7]
TIGAR - это недавно открытый фермент, который в основном функционирует как регулятор глюкоза распад в человеке клетки. Помимо своей роли в контроле деградации глюкозы, активность TIGAR может позволить клетке выполнять ДНК ремонт, и деградация собственной органеллы. Наконец, TIGAR может защитить клетку от смерти. С момента своего открытия в 2005 году Куанг-Ю Джен и Вивиан Г. Чунг, TIGAR стал представлять особый интерес для научного сообщества благодаря своей активной роли во многих раки. Обычно производство TIGAR организмом активируется p53 подавитель опухолей белок после того, как клетка испытала низкий уровень Повреждение ДНК или стресс. В некоторых случаях рака TIGAR находится под контролем других белков. Есть надежда, что будущие исследования TIGAR дадут представление о новых способах лечения рака.[8][9][10]
Этот ген регулируется как часть р53. подавитель опухолей пути и кодирует белок с последовательностью, сходной с бисфосфат домен гликолитический фермент, разрушающий фруктозо-2,6-бисфосфат. Белок функционирует, блокируя гликолиз и направляя путь в пентозофосфатный шунт. Экспрессия этого белка также защищает клетки от повреждения ДНК. активные формы кислорода и обеспечивает некоторую защиту от повреждений ДНК, вызванных апоптоз. Область 12p13.32, которая включает этот ген, паралогична области 11q13.3.[7]
Ген
У человека ТИГАР ген, известный как C12orf5, находится на хромосома 12p 13-3, и состоит из 6 экзоны.[9] C12orf5 мРНК это 8237 пар оснований в длину.[11]
Открытие
Джен и Чунг впервые обнаружили ген c12orf5, используя компьютерный поиск, чтобы найти новые гены, регулируемые p53, которые включались в ответ на ионизирующего излучения. Они опубликовали свое исследование в журнале Cancer Research в 2005 году.[8]
Позже Карим Бенсаад и др. Опубликовали исследование, полностью посвященное структуре и функции гена c12orf5, в Cell, в котором c12orf5 было дано название TIGAR в честь его очевидной функции.[9]
Выражение
ТИГАР транскрипция быстро активируется p53 подавитель опухолей белка в ответ на низкий уровень клеточного стресса, например, вызванный воздействием низких доз УФ.[12] Однако при высоких уровнях клеточного стресса экспрессия TIGAR снижается.[12] P53, а фактор транскрипции, может связывать два сайта в человеческом гене TIGAR для активации экспрессии.[9][13] Один сайт находится в первой интрон, и связывает р53 с высокой аффинностью.[9][13] Второй находится непосредственно перед первым экзоном, связывает р53 с низким сродством,[9][13] и сохраняется между мышами и людьми.[9]Экспрессия TIGAR может регулироваться другими механизмами, не связанными с p53, в линии опухолевых клеток.[9]
Структура
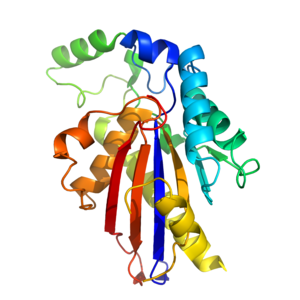
TIGAR составляет примерно 30 кДа [9] и имеет третичная структура это похоже на гистидинфосфатаза складывать.[14] Ядро TIGAR состоит из α-β-α-сэндвича, который состоит из шести нитей. β лист в окружении 4 α спирали.[14] Дополнительные α-спирали и длинная петля построены вокруг ядра, чтобы дать полный фермент.[14] TIGAR имеет активный сайт который структурно похож на PhoE (фермент бактериальной фосфатазы) и функционально подобен таковому у фруктоза-2,6-бисфосфатаза.
Бис-фосфатазоподобный активный центр TIGAR заряжен положительно и катализирует удаление фосфат группы из других молекул.[9][14] В отличие от фруктозо-2,6-бисфосфатазы, активный сайт TIGAR открыт и доступен, как и у PhoE.[14] Сайт содержит 3 важных аминокислоты (2 гистидина и 1 глютаминовая кислота [9]), которые участвуют в фосфатаза реакция. Эти 3 остатка вместе известны как каталитическая триада,[9] и присутствуют во всех ферментах, относящихся к фосфоглицеромутаза ветвь надсемейства гистидинфосфатаз.[9][14] Один из остатков гистидина электростатически связаны с отрицательно заряженным фосфатом. Второй фосфат связан где-то еще в активном центре.[14]
Функция
Активность TIGAR может иметь множественные клеточные эффекты. TIGAR действует как прямой регулятор фруктозо-2,6-бисфосфат уровни и гексокиназа 2 активности, и это может косвенно привести ко многим изменениям внутри клетки в цепи биохимических событий. TIGAR представляет собой фруктозобисфосфатазу, которая активирует р53 в результате ингибирования экспрессии переносчика глюкозы, а также регулирует экспрессию гексокиназы и фосфоглицератмутазы. TIGAR также ингибирует фосфофруктокиназу (PFK), снижая уровень фруктозы-2,6, бисфосфата, поэтому гликолиз ингибируется и стимулируется пентозофосфатный путь.[15]
Регулирование фруктозо-2,6-бисфосфата
TIGAR снижает клеточный уровень фруктозо-2,6-бисфосфата.[9][13] Он катализирует удаление фосфатной группы из фруктозо-2,6-бисфосфата (F-2,6-BP):[9][13]Фруктоза-2,6-Бисфосфат-> Фруктоза-6-фосфат (F-6-P) + фосфат
Ф-2,6-БП - это аллостерический регулятор сотовой связи метаболизм глюкозы пути. Обычно F-2,6-BP связывается и увеличивает активность фосфофруктокиназа 1. Фосфофруктокиназа-1 катализирует добавление фосфата к F-6-P с образованием фруктозо-1,6-бисфосфата (F-1,6-BP). Это важный шаг в гликолиз путь, составляющий первую часть аэробного дыхания в млекопитающие.F-2,6-BP также связывается с фруктозо-1,6-бисфосфатазой и снижает ее активность.[9] Фруктозо-1,6-бисфосфатаза катализирует удаление фосфата из F-1,6-BP с образованием F-6-P. Эта реакция является частью глюконеогенез путь, который синтезирует глюкоза, и является обратным гликолизу.[16] Когда TIGAR снижает уровень F-2,6-BP, фосфофруктокиназа становится менее активной, а активность фруктозо-1,6-бисфосфатазы увеличивается.[9][13] Повышается уровень фруктозо-6-фосфата,[9][13] который имеет несколько эффектов внутри ячейки:
- Скорость гликолиза снижается[9][13]
- Скорость глюконеогенеза увеличивается[9]
- Избыток фруктозо-6-фосфата превращается в глюкозо-6-фосфат в изомеризация реакция [9]
- Избыток глюкозо-6-фосфата попадает в пентозофосфатный путь. В конечном итоге это приводит к удалению активные формы кислорода (ROS) в ячейке[9][13]
- Удаление ROS помогает предотвратить апоптоз (клеточное самоубийство), а также может уменьшить накопление Повреждение ДНК через некоторое время.[9][13]
Ответ на повреждение ДНК и остановка клеточного цикла
TIGAR может препятствовать прохождению клетки через стадии цикла ее роста и деления, уменьшая клеточную АТФ уровни.[12] Это известно как клеточный цикл арестовать.[12] Эта функция TIGAR является частью опосредованной p53 Повреждение ДНК ответ, при котором при низких уровнях клеточного стресса р53 инициирует остановка клеточного цикла чтобы дать ячейке время на ремонт.[13][17][18] Вместо этого при высоком уровне клеточного стресса р53 инициирует апоптоз.[13][17][18]
В не покоящихся клетках клеточный цикл состоит из фаз G0 -> G1 -> S -> G2 -> M и строго регулируется в контрольных точках между фазами.[19] Если клетка подверглась стрессу, экспрессируются определенные белки, которые препятствуют определенной последовательности макромолекулярный взаимодействия на контрольной точке, необходимые для перехода к следующему этапу.[17][18][19]
Активность TIGAR может предотвратить переход клеток в S-фазу через контрольную точку, известную у людей как точка ограничения. В самом начале Фаза G1, белок под названием ретинобластома (Rb) существует в нефосфорилированном состоянии. В этом состоянии Rb связывается с фактором транскрипции белка. E2F и предотвращает активацию E2F транскрипции белков, необходимых для S-фаза. Во время нормального клеточного цикла, по мере развития G1, Rb будет фосфорилироваться в определенном наборе последовательных шагов белками, называемыми циклинзависимые киназы (cdks) привязаны к циклин белки. Специфические комплексы, фосфорилирующие Rb: циклин D -cdk4 и циклин E -cdk2.[20]
Когда Rb много раз фосфорилирован, он диссоциирует от E2F. E2F может активировать экспрессию генов S-фазы.[20] TIGAR может косвенно препятствовать прохождению клетки через точку ограничения, удерживая Rb в нефосфорилированном состоянии.[12]
При экспрессии TIGAR снижает клеточные уровни АТФ за счет своей фосфатазной активности.[12] Для фосфорилирования Rb доступно меньше АТФ, поэтому Rb остается нефосфорилированным и связан с E2F, который не может активировать гены S-фазы.[12] Экспрессия циклина D, ckd4, циклина E и cdk2 снижается, когда TIGAR активен, из-за отсутствия АТФ, необходимого для их транскрипции и перевод.[12] Эта активность TIGAR служит для остановки клеток в G1.[12]
Активность гексокиназы 2
В условиях низкого содержания кислорода, известных как гипоксия, небольшое количество TIGAR отправляется в митохондрии и увеличивает активность гексокиназы 2 (HK2) за счет связывания с ней[21]
Во время гипоксии белок, называемый Hif1α активируется и вызывает повторную локализацию TIGAR из цитоплазма к внешнему митохондриальному мембрана.[21] Здесь HK2 связан с анион канал во внешней митохондриальной мембране, называемый VDAC.[22] TIGAR связывает гексокиназу 2 и увеличивает ее активность с помощью пока неизвестного механизма.[21]
Гексокиназа 2 (HK2) осуществляет следующую реакцию:
Глюкоза + АТФ -> Глюкозо-6-фосфат + АДФ [21][22][23]
Считается, что HK2 поддерживает митохондриальную мембранный потенциал поддерживая высокий уровень АДФ.[23] Он также предотвращает апоптоз несколькими способами: снижает уровни митохондриальных АФК,[21][23] и предотвращает белок, вызывающий апоптоз Bax от создания канала с VDAC.[22] Это останавливает цитохром с белок проходит через VDAC в цитоплазму, где запускает апоптоз через каспаза белковый каскад.[22]
TIGAR не переносится в митохондрии и не связывает HK2 в нормальных клеточных условиях,[21] или если клетке не хватает глюкозы.[21] Для повторной локализации в митохондриях не требуется фосфатазный домен TIGAR.[21] Вместо 4 аминокислот в C-терминал конец TIGAR существенны.[21]
Защита от апоптоза
Повышенная экспрессия TIGAR защищает клетки от апоптоза, вызванного окислительным стрессом. [24] за счет снижения уровня ROS.[9] TIGAR может косвенно снижать АФК двумя разными способами. В внутриклеточный Окружающая среда клетки будет определять, какой из этих двух режимов действия TIGAR более распространен в клетке в любой момент времени.[9][21]
Активность фруктозо-2,6-бисфосфатазы TIGAR снижает ROS за счет увеличения активности пентозофосфатного пути (PPP).[9] Глюкозо-6-фосфат накапливается из-за дефосфорилирования F-2,6-BP под действием TIGAR и входит в PPP.[9] Это заставляет PPP генерировать больше никотинамид аденин динуклеотид (НАДФН ).[9][25] НАДФН является переносчиком электроны который используется ячейкой как Восстановитель во многих анаболические реакции. НАДФН, производимый PPP, передает электроны в окисленный глутатион молекула (GSSG) с образованием восстановленного глутатиона (GSH).[9][25]
GSH становится Восстановитель, и передает электроны на АФК пероксид водорода с образованием безвредной воды при реакции:
GSH + H202 -> H20 + GSSG [9][25]
Снижение H2O2 в результате активности TIGAR защищает от апоптоза.[9][25]
TIGAR также снижает ROS за счет увеличения активности HK2. HK2 косвенно снижает уровень ROS, сохраняя ADP уровни на внешней митохондриальной мембране высокие. Если уровень АДФ падает, частота дыхания снижается и вызывает электронная транспортная цепь стать чрезмерно восстановленным с избыточными электронами. Эти избыточные электроны переходят в кислород и образуют АФК.[21]
Действие комплекса TIGAR / HK2 защищает клетки от апоптоза только в условиях низкого содержания кислорода. В нормальных условиях или в условиях дефицита глюкозы защита от апоптоза, опосредованная TIGAR, обеспечивается только его бис-фосфатазной активностью.[21]
TIGAR не может предотвратить апоптоз через пути смерти, которые не зависят от ROS и p53.[9] В некоторых клетках экспрессия TIGAR может подтолкнуть клетки к апоптозу.[9]
Интерлейкин 3 (Ил-3) - это фактор роста что может привязать к рецепторы на поверхности клетки и приказывает клетке выживать и расти.[26] Когда IL-3-зависимые клеточные линии лишены IL-3, они умирают.[26] из-за снижения усвоения и метаболизма глюкозы.[26] Когда TIGAR сверхэкспрессируется в клетках, лишенных ИЛ-3, скорость гликолиза дополнительно снижается, что увеличивает скорость апоптоза.[9]
Аутофагия
Аутофагия - это когда клетка переваривает некоторые из собственных органелл путем лизосомальной деградации. Аутофагия используется для удаления поврежденных органелл или в условиях голодания для получения дополнительных питательных веществ. Обычно аутофагия происходит посредством пути TSC-Mtor, но может быть индуцирована ROS. TIGAR, даже при очень низких уровнях, подавляет аутофагию, снижая уровни ROS. Механизм, с помощью которого TIGAR делает это, не зависит от пути Mtor, но точные детали неизвестны.[27]
Возможные роли при раке
TIGAR может способствовать развитию или подавлению нескольких раки в зависимости от клеточного контекста.[13][28][29][30] TIGAR может оказывать некоторое влияние на три характеристики рака; способность избежать апоптоза, неконтролируемый деление клеток, и измененный метаболизм.[13][28][29][30][31] Многие раковые клетки изменили метаболизм, при этом скорость гликолиза и анаэробное дыхание очень высоки пока окислительное дыхание низкий, что называется Эффект Варбурга (или же аэробный гликолиз ).[31] Это позволяет раковым клеткам выживать в условиях низкого содержания кислорода и использовать молекулы дыхательных путей для синтеза аминокислот и нуклеиновые кислоты для поддержания быстрого роста.[31]
В Глиома, тип рака мозга, TIGAR может быть чрезмерно выражен там, где онкогенный -подобные эффекты.[28] В этом случае TIGAR поддерживает уровни энергии для увеличения роста за счет увеличения дыхания (вызывая измененный метаболизм), а также защищает клетки глиомы от апоптоза, вызванного гипоксией, за счет снижения ROS (что позволяет избежать апоптоза).[28] TIGAR также сверхэкспрессируется при некоторых формах рака груди.[30]
В множественная миелома Экспрессия TIGAR связана с активностью MUC-1. MUC-1 - это онкопротеин который сверхэкспрессируется при множественной миеломе и защищает эти клетки от апоптоза, индуцированного АФК, поддерживая активность TIGAR. Когда активность MUC-1 устраняется, уровни TIGAR снижаются, и клетки подвергаются апоптозу, индуцированному ROS.[29]
При раке головы и шеи, известном как носоглоточный рак, онкопротеинкиназа c-Met поддерживает выражение TIGAR. TIGAR увеличивает скорость гликолиза и уровень НАДФН, что позволяет раковым клеткам поддерживать высокие темпы роста.[32]
Однако TIGAR может также оказывать ингибирующее действие на развитие рака, предотвращая клеточную пролиферацию благодаря своей роли в остановке клеточного цикла, опосредованной p53.[13]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000078237 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000038028 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Jen KY, Cheung VG (сентябрь 2005 г.). «Идентификация новых генов-мишеней p53 в ответе на ионизирующее излучение». Рак Res. 65 (17): 7666–73. Дои:10.1158 / 0008-5472.CAN-05-1039. PMID 16140933.
- ^ Бенсаад К., Цурута А., Селак М.А., Видал М.Н., Накано К., Бартронс Р., Готлиб Е., Вусден К.Х. (июль 2006 г.). «TIGAR, p53-индуцибельный регулятор гликолиза и апоптоза». Клетка. 126 (1): 107–20. Дои:10.1016 / j.cell.2006.05.036. PMID 16839880. S2CID 15006256.
- ^ а б «Ген Entrez: C12orf5 хромосома 12, открытая рамка считывания 5».
- ^ а б Jen KY, Cheung VG (сентябрь 2005 г.). «Идентификация новых генов-мишеней p53 в ответе на ионизирующее излучение». Рак Res. 65 (17): 7666–73. Дои:10.1158 / 0008-5472.CAN-05-1039. PMID 16140933.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах Бенсаад К., Цурута А., Селак М.А., Видал М.Н., Накано К., Бартронс Р., Готтлиб Е., Вусден К.Х. (июль 2006 г.). «TIGAR, p53-индуцибельный регулятор гликолиза и апоптоза». Клетка. 126 (1): 107–20. Дои:10.1016 / j.cell.2006.05.036. PMID 16839880. S2CID 15006256.
- ^ Green DR, Chipuk JE (июль 2006 г.). «p53 и метаболизм: внутри TIGAR». Клетка. 126 (1): 30–2. Дои:10.1016 / j.cell.2006.06.032. PMID 16839873.
- ^ "NCBI Summary C12orf5 хромосома 12 открытая рамка считывания 5".
- ^ а б c d е ж грамм час я Мадан Э, Гогна Р., Куппусами П., Бхатт М., Пати У, Махди А.А. (июль 2012 г.). «TIGAR индуцирует p53-опосредованную остановку клеточного цикла путем регуляции комплекса RB-E2F1». Br. J. Рак. 107 (3): 516–26. Дои:10.1038 / bjc.2012.260. ЧВК 3405207. PMID 22782351.
- ^ а б c d е ж грамм час я j k л м п о Мадан Е., Гогна Р., Бхатт М., Пати У, Куппусами П., Махди А.А. (декабрь 2011 г.). «Регулирование метаболизма глюкозы с помощью p53: новые роли супрессора опухолей». Oncotarget. 2 (12): 948–57. Дои:10.18632 / oncotarget.389. ЧВК 3282098. PMID 22248668.
- ^ а б c d е ж грамм Ли Х, Джогль Дж (январь 2009 г.). «Структурные и биохимические исследования TIGAR (TP53-индуцированный регулятор гликолиза и апоптоза)». J. Biol. Chem. 284 (3): 1748–54. Дои:10.1074 / jbc.M807821200. ЧВК 2615519. PMID 19015259.
- ^ Гарретт, Реджинальд (2016). Биохимия. Стэмфорд, Коннектикут: Cengage Learning. п. 631. ISBN 978-1305577206.
- ^ Voet JG, Voet D (2004). Биохимия (3-е изд.). Нью-Йорк: J. Wiley & Sons. ISBN 0-471-19350-X.
- ^ а б c Vousden KH, Lu X (август 2002). «Живи или дай умереть: реакция клетки на p53». Nat. Преподобный Рак. 2 (8): 594–604. Дои:10.1038 / nrc864. PMID 12154352. S2CID 6412605.
- ^ а б c Джексон С.П., Бартек Дж. (Октябрь 2009 г.). «Реакция на повреждение ДНК в биологии человека и болезнях». Природа. 461 (7267): 1071–8. Bibcode:2009 Натур.461.1071J. Дои:10.1038 / природа08467. ЧВК 2906700. PMID 19847258.
- ^ а б Элледж SJ (декабрь 1996 г.). «Контрольные точки клеточного цикла: предотвращение кризиса идентичности». Наука. 274 (5293): 1664–72. Bibcode:1996 Наука ... 274.1664E. Дои:10.1126 / science.274.5293.1664. PMID 8939848. S2CID 39235426.
- ^ а б Хенли С.А., Дик Ф.А. (2012). «Семейство белков ретинобластомы и их регуляторные функции в цикле деления клеток млекопитающих». Ячейка Div. 7 (1): 10. Дои:10.1186/1747-1028-7-10. ЧВК 3325851. PMID 22417103.
- ^ а б c d е ж грамм час я j k л Cheung EC, Ludwig RL, Vousden KH (декабрь 2012 г.). «Митохондриальная локализация TIGAR в условиях гипоксии стимулирует HK2 и снижает АФК и гибель клеток». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 109 (50): 20491–6. Bibcode:2012PNAS..10920491C. Дои:10.1073 / pnas.1206530109. ЧВК 3528527. PMID 23185017.
- ^ а б c d Пасторино Дж. Г., Шульга Н., Хук Дж. Б. (март 2002 г.). «Митохондриальное связывание гексокиназы II ингибирует Bax-индуцированное высвобождение цитохрома с и апоптоз». J. Biol. Chem. 277 (9): 7610–8. Дои:10.1074 / jbc.M109950200. PMID 11751859.
- ^ а б c да-Силва В.С., Гомес-Пуйу А., де Гомес-Пуйу М. Т., Морено-Санчес Р., Де Феличе Ф. Г., де Мейс Л., Оливейра М. Ф., Галина А. (сентябрь 2004 г.). «Активность связанной с митохондриями гексокиназы в качестве превентивной антиоксидантной защиты: устойчивое образование АДФ как регуляторный механизм мембранного потенциала и генерации активных форм кислорода в митохондриях». J. Biol. Chem. 279 (38): 39846–55. Дои:10.1074 / jbc.M403835200. PMID 15247300.
- ^ Валко М., Лейбфриц Д., Монкол Дж., Кронин М.Т., Мазур М., Телсер Дж. (2007). «Свободные радикалы и антиоксиданты в нормальных физиологических функциях и болезнях человека». Int. J. Biochem. Cell Biol. 39 (1): 44–84. Дои:10.1016 / j.biocel.2006.07.001. PMID 16978905.
- ^ а б c d Fico A, Paglialunga F, Cigliano L, Abrescia P, Verde P, Martini G, Iaccarino I, Filosa S (август 2004 г.). «Глюкозо-6-фосфатдегидрогеназа играет решающую роль в защите от апоптоза, вызванного окислительно-восстановительным стрессом». Разница в гибели клеток. 11 (8): 823–31. Дои:10.1038 / sj.cdd.4401420. PMID 15044966.
- ^ а б c Vander Heiden MG, Plas DR, Rathmell JC, Fox CJ, Harris MH, Thompson CB (сентябрь 2001 г.). «Факторы роста могут влиять на рост и выживание клеток за счет воздействия на метаболизм глюкозы». Мол. Клетка. Биол. 21 (17): 5899–912. Дои:10.1128 / MCB.21.17.5899-5912.2001. ЧВК 87309. PMID 11486029.
- ^ Bensaad K, Cheung EC, Vousden KH (октябрь 2009 г.). «Модуляция внутриклеточных уровней АФК с помощью TIGAR контролирует аутофагию». EMBO J. 28 (19): 3015–26. Дои:10.1038 / emboj.2009.242. ЧВК 2736014. PMID 19713938.
- ^ а б c d Ванка С., Штайнбах Дж. П., Ригер Дж. (Сентябрь 2012 г.). «Tp53-индуцированный регулятор гликолиза и апоптоза (TIGAR) защищает клетки глиомы от гибели клеток, вызванной голоданием, за счет активации дыхания и улучшения окислительно-восстановительного гомеостаза клеток». J. Biol. Chem. 287 (40): 33436–46. Дои:10.1074 / jbc.M112.384578. ЧВК 3460445. PMID 22887998.
- ^ а б c Инь Л., Косуги М., Куфе Д. (январь 2012 г.). «Ингибирование онкопротеина MUC1-C вызывает гибель клеток множественной миеломы за счет подавления экспрессии TIGAR и истощения НАДФН». Кровь. 119 (3): 810–6. Дои:10.1182 / кровь-2011-07-369686. ЧВК 3265204. PMID 22117045.
- ^ а б c Вон KY, Lim SJ, Kim GY, Kim YW, Han SA, Song JY, Lee DK (февраль 2012 г.). «Регуляторная роль p53 в метаболизме рака через SCO2 и TIGAR при раке груди человека». Гм. Патол. 43 (2): 221–8. Дои:10.1016 / j.humpath.2011.04.021. PMID 21820150.
- ^ а б c Ханахан Д., Вайнберг Р.А. (март 2011 г.). «Признаки рака: следующее поколение». Клетка. 144 (5): 646–74. Дои:10.1016 / j.cell.2011.02.013. PMID 21376230.
- ^ Луи Ф.В., Вонг ЭЙ, Хо К, Нг ПК, Лау С.П., Цуй С.К., Цанг СМ, Цао ЮЗ, Ченг Ш., Нг МХ, Нг ЙК, Лам Э.К., Хонг Б., Ло КВ, Мок ТС, Чан АТ, Миллс Великобритания (Март 2011 г.). «Ингибирование c-Met подавляет экспрессию TIGAR и снижает продукцию NADPH, что приводит к гибели клеток». Онкоген. 30 (9): 1127–34. Дои:10.1038 / onc.2010.490. ЧВК 3428712. PMID 21057531.
дальнейшее чтение
- Green DR, Chipuk JE (июль 2006 г.). «p53 и метаболизм: внутри TIGAR». Клетка. 126 (1): 30–2. Дои:10.1016 / j.cell.2006.06.032. PMID 16839873.
- White, Kenneth E .; Evans, Wayne E .; О'Риордан, Джеффри Л.Х .; Speer, Marcy C .; Econs, Майкл Дж .; Лоренц-Депьерё, Беттина; Грабовски, Моника; Мейтингер, Томас; Стром, Тим М. (ноябрь 2000 г.). «Аутосомно-доминантный гипофосфатемический рахит связан с мутациями в FGF23». Nat. Genet. 26 (3): 345–8. Дои:10.1038/81664. PMID 11062477. S2CID 38870810.
- Хартли Дж. Л., Темпл Г. Ф., Браш Массачусетс (ноябрь 2000 г.). «Клонирование ДНК с использованием сайт-специфической рекомбинации in vitro». Genome Res. 10 (11): 1788–95. Дои:10.1101 / гр.143000. ЧВК 310948. PMID 11076863.
- Като Ю., Като М. (август 2005 г.). «Сравнительная геномика локуса Fgf6-Fgf23 млекопитающих». Int. J. Mol. Med. 16 (2): 355–8. Дои:10.3892 / ijmm.16.2.355. PMID 16012775.





