Хлорид вольфрама (IV) - Tungsten(IV) chloride
 | |
| Имена | |
|---|---|
| Другие имена тетрахлорид вольфрама | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ECHA InfoCard | 100.157.353 |
| |
| |
| Характеристики | |
| Cl4W | |
| Молярная масса | 325,65 г · моль−1 |
| Внешность | черное твердое вещество |
| Плотность | 4,62 г · см−3 |
| Температура плавления | 450 ° С (842 ° F, 723 К) |
| Родственные соединения | |
Другой анионы | Фторид вольфрама (IV) |
Родственные соединения | Хлорид вольфрама (V) Гексахлорид вольфрама |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Хлорид вольфрама (IV) является неорганическое соединение с формулой WCl4. Это диамагнитное черное твердое вещество. Соединение представляет интерес для исследований как одно из немногих двоичных хлориды вольфрама.
Состав и подготовка
WCl4 обычно готовится путем сокращения гексахлорид вольфрама. Сообщалось о многих восстановителях, включая красный фосфор, гексакарбонил вольфрама, галлий, олово и сурьма. Последний считается оптимальным:[1]
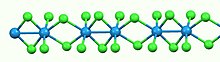
Как и большинство бинарных галогенидов металлов, WCl4 полимерный. Он состоит из линейных цепочек атомов вольфрама, каждая в восьмигранный геометрия. Из шести хлоридных лигандов, присоединенных к каждому центру W, четыре являются мостиковые лиганды. Разделения W-W попеременно связывают (2,688 Å) и не связывают (3,787 Å).
Реакции
Восстановление хлорида вольфрама (IV) натрием дает производное гептахлорида дивольфрама (III):[2]
- 2 WCl4 + 5 thf + 2 Na → [Na (thf)3] [W2Cl7(thf)2] + NaCl
использованная литература
- ^ Чжоу, Ибо; Колесниченко, Владимир; Мессерле, Луи (2014). «Кристаллические и аморфные формы тетрахлорида вольфрама». Неорганические синтезы: Том 36. Неорганические синтезы. 36. С. 30–34. Дои:10.1002 / 9781118744994.ch6. ISBN 9781118744994.
- ^ Бродерик, Эрин М .; Браун, Сэмюэл С .; Джонсон, Марк Дж. А. (2014). Гекса димолибдена и вольфрама (алкоксиды). Неорганические синтезы. 36. С. 95–102. Дои:10.1002 / 9781118744994.ch18. ISBN 9781118744994.

