Тетрахлорид селена - Selenium tetrachloride
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Тетрахлорид селена | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.030.036 |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| SeCl4 | |
| Молярная масса | 220,771 г / моль |
| Внешность | кристаллы от белого до желтого |
| Плотность | 2,6 г / см3, твердый |
| Температура плавления | возвышенный при 191,4 ° C[1] |
| разлагается в воде | |
| Структура | |
| Моноклиника, mS80 | |
| C12 / c1, № 15 | |
| Качели (газовая фаза)[нужна цитата ] | |
| Опасности | |
Классификация ЕС (DSD) (устарело) | |
| R-фразы (устарело) | R23 / 25, R33, R50 / 53 |
| S-фразы (устарело) | S20 / 21, S28, S45, S60, S61[2] |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | негорючий |
| Родственные соединения | |
Другой анионы | Тетрафторид селена Тетрабромид селена Диоксид селена |
Другой катионы | Монооксид дихлора Тетрахлорид серы Тетрахлорид теллура |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Тетрахлорид селена это неорганическое соединение в составе формула SeCl4. Это соединение существует в виде летучего твердого вещества от желтого до белого цвета. Это один из двух общедоступных хлориды селена Другой пример: монохлорид селена, Se2Cl2. SeCl4 используется в синтезе других селен соединения.
Синтез и структура
Соединение получают путем обработки селен с хлор.[3] Когда реагирующий селен нагревается, продукт возвышенный из реакционной колбы. Летучесть тетрахлорида селена может быть использована для очистки селена.
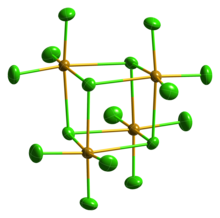
Твердый SeCl4 на самом деле тетрамерный кластер кубанового типа, для которого атом Se в SeCl6 октаэдр расположен в четырех углах куба, а мостиковые атомы Cl - в четырех других углах. Мостовые расстояния Se-Cl больше, чем конечные расстояния Se-Cl, но все углы Cl-Se-Cl составляют приблизительно 90 °.[4]
SeCl4 часто использовался в качестве примера для обучения VSEPR правила гипервалентные молекулы. Таким образом, можно было бы предсказать четыре связи, но пять электронных групп, дающих начало геометрия качелей. Очевидно, что это не так в Кристальная структура. Другие предположили, что кристаллическую структуру можно представить как SeCl3+ и Cl−. Эта формулировка предсказывала бы пирамидальная геометрия для SeCl3+ катион с валентным углом Cl-Se-Cl приблизительно 109 °. Однако эта молекула является прекрасным примером ситуации, когда максимальная связь не может быть достигнута с помощью простейшей молекулярной формулы. Образование тетрамера (SeCl4)4,[5] с делокализованной сигма-связью мостикового хлорида явно предпочтительнее "гипервалентной" небольшой молекулы. Газообразный SeCl4 содержит SeCl2 и хлор, которые рекомбинируют при конденсации.
Реакции
Тетрахлорид селена можно восстановить in situ до дихлорида, используя трифенилстибин:
- SeCl4 + SbPh3 → SeCl2 + Cl2SbPh3
Тетрахлорид селена реагирует с водой с образованием селеновый и соляной кислоты:[6][страница нужна ]
- SeCl4 + 3 часа2O → H2SeO3 + 4 HCl
При лечении диоксид селена, это дает оксихлорид селена:[6][страница нужна ]
- SeCl4 + SeO2 → 2SeOCl2
Рекомендации
- ^ Лиде, Дэвид Р. (1998). Справочник по химии и физике (87 изд.). Бока-Ратон, Флорида: CRC Press. п. 487. ISBN 0-8493-0594-2. Получено 2008-07-02.
- ^ «323527 Тетрахлорид селена». Сигма-Олдрич. Получено 2008-07-02.
- ^ Новак, Х. Г .; Suttle, J. F .; Parker, W. E .; Клейнберг, Дж. (1957). «Хлорид селена (IV)». Неорганические синтезы. Неорганические синтезы. 5. п. 125. Дои:10.1002 / 9780470132364.ch33. ISBN 9780470132364.
- ^ Kristallstruktur der stabilen Modifikation von SeCl4, Zeitschrift fur Naturforschung, 36b, 1660, 1981
- ^ Уэллс, Структурная неорганическая химия, пятое изд, Оксфорд, стр. 709, г. ISBN 0-19-855370-6
- ^ а б Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.

