Осмий (IV) хлорид - Osmium(IV) chloride
 | |
| Имена | |
|---|---|
| Название ИЮПАК Осмий (IV) хлорид | |
| Другие имена Осмий хлорид, тетрахлорид осмия | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ECHA InfoCard | 100.151.226 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| OsCl4 | |
| Молярная масса | 332,041 г / моль |
| Внешность | красно-черный ромбический кристаллы |
| Плотность | 4,38 г / см3 |
| Температура плавления | разлагается при 323 ° C |
| реагирует с водой | |
| Растворимость | растворим в соляной кислоте |
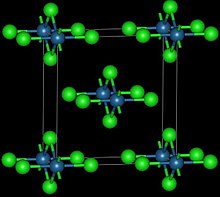
| Структура | |
| Орторомбический, oS10 | |
| Сммм, №65 | |
| Родственные соединения | |
Другой анионы | Оксид осмия (IV) |
Другой катионы | Хлорид железа (III) Хлорид рутения (III) Осмий (III) хлорид |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Осмий (IV) хлорид или тетрахлорид осмия это неорганическое соединение состоит из осмий и хлор с эмпирическая формула OsCl4. Он существует в двух полиморфы (кристаллические формы). Соединение используется для получения других комплексов осмия.
Приготовление, структура, реакции
Впервые о нем сообщили в 1909 году как о продукте хлорирования металлического осмия.[1]Этот маршрут дает высокотемпературный полиморф:[2]
- Os + 2 Cl2 → OsCl4
Этот красновато-черный полиморф ромбический и принимает структуру, в которой центры осмия скоординированы октаэдрически, разделяя противоположные края OsCl6 октаэдры в цепочку.[3] Коричневый, по-видимому, кубический полиморф образуется при восстановлении четырехокись осмия с тионилхлорид:[4]
- OsO4 + 4 SOCl2 → OsCl4 + 2 кл2 + 4 СО2
Тетраоксид осмия растворяется в соляная кислота чтобы дать анион гексахлороосмат:
- OsO4 + 10 HCl → H2OsCl6 + 2 кл2 + 4 часа2О
использованная литература
- ^ Отто Рафф и Ферд. Борнеманн (1910). "Über das Osmium, seine analytische Bestimmung, seine Oxyde und seine Chloride". Zeitschrift für anorganische Chemie. 65: 429–456. Дои:10.1002 / zaac.19100650126.
- ^ Коттон, С. А. (1997). Химия драгоценных металлов. Лондон: Чепмен и Холл. ISBN 0-7514-0413-6.
- ^ Уэллс А.Ф. (1984). Структурная неорганическая химия (5-е изд.). Оксфордские научные публикации. ISBN 0-19-855370-6.
- ^ Пол Махмер (1967). «О полиморфизме тетрахлорида осмия». Chem. Commun. (12): 610a. Дои:10.1039 / C1967000610A.
