Туннельная нанотрубка - Tunneling nanotube
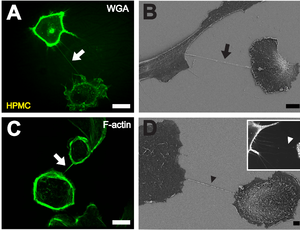
B Изображение TNT (черная стрелка) между двумя клетками с помощью сканирующей электронной микроскопии через один час после посева клеток. Масштабная линейка: 10 мкм.
C Окрашивание F-актина флуоресцентно меченным фаллоидином показывает, что актин присутствует в TNT между отдельными HPMC (белая стрелка). Масштабная линейка: 20 мкм.
D Изображение с помощью сканирующего электронного микроскопа связанного с субстратом филоподия-подобного расширения в качестве потенциального предшественника TNT (черная стрелка). На вставке показано флуоресцентное микроскопическое изображение связанных с субстратом филоподий-подобных выступов, приближающихся к соседней клетке (белая стрелка). Масштабная линейка: 2 мкм.[1]
А туннельная нанотрубка (TNT) или же мембранная нанотрубка это термин, который применялся к выступам, выходящим из плазматическая мембрана которые позволяют различным животным клеткам соприкасаться на больших расстояниях, иногда более 100 мкм между Т-клетки.[2][3][4] Два типа структур были названы нанотрубками. Первый тип имеет диаметр менее 0,7 мкм, содержит актин и нести порции плазматическая мембрана между ячейками в обоих направлениях. Второй тип крупнее (> 0,7 мкм), содержит как актин, так и микротрубочки, и может нести компоненты цитоплазма Такие как пузырьки и органеллы между ячейками,[5] включая целые митохондрии.[6] Диаметр TNT составляет от 50 до 200 нм, а длина может достигать нескольких диаметров ячейки.[6] Эти структуры могут участвовать в межклеточной коммуникации,[7] передача нуклеиновые кислоты между ячейками в ткань,[8] и распространение патогенов или токсинов, таких как ВИЧ[3] и прионы.[9] ТНТ наблюдали продолжительность жизни от нескольких минут до нескольких часов,[10] и несколько белков были вовлечены в их образование или ингибирование.
История
Мембранные нанотрубки были впервые описаны в 1999 г. Клетка статья, исследующая развитие Drosophila melanogaster крыло имагинальные диски.[11] Совсем недавно Наука В статье, опубликованной в 2004 году, описаны структуры, которые соединяют вместе различные типы иммунных клеток, а также связи между клетками в культура ткани.[6][12] Со времени этих публикаций было зарегистрировано больше TNT-подобных структур, содержащих различные уровни F-актина, микротрубочек и других компонентов, но оставшихся относительно однородными с точки зрения состава.[10]
Формирование
В образовании нанотрубок могут быть задействованы несколько механизмов. К ним относятся молекулярные механизмы контроля, а также межклеточные взаимодействия.
Было предложено два основных механизма образования TNT. Первый включает цитоплазматические выступы, простирающиеся от одной клетки к другой, где они сливаются с мембраной клетки-мишени.[6] Во-вторых, по мере того, как две ранее соединенные ячейки удаляются друг от друга, TNT остаются мостами между двумя ячейками.[3][13]
Индукция
Немного дендритные клетки и THP-1 моноциты было показано, что они соединяются через туннельные нанотрубки и демонстрируют поток кальция при воздействии бактериальных или механических стимулов. Было показано, что TNT-опосредованная передача сигналов вызывает распространение в клетках-мишенях, подобно ламеллиподии образуются, когда дендритные клетки подвергаются воздействию бактериальных продуктов. TNT, продемонстрированные в этом исследовании, распространялись с начальной скоростью 35 микрометров в секунду и показали, что они соединяют моноциты THP-1 с нанотрубками длиной до 100 микрометров.[14]
Формирование цитонемы к BnL-FGF градиент наблюдался, предполагая, что хемотаксический контроль может вызвать образование TNT-подобных структур.[11] Подтверждающим выводом является то, что фосфатидилсерин образование TNT под контролем экспозиции из мезенхимальные стволовые клетки (МСК) к популяции поврежденных клеток.[15] Протеин S100A4 и его рецептор, как было показано, определяют направление роста TNT, так как p53 активирует каспаза 3 для расщепления S100A4 в инициирующей клетке, тем самым создавая градиент, в котором клетка-мишень имеет более высокие количества белка.[16]
Одно исследование показало, что межклеточный контакт необходим для образования мостиков из нанотрубок между ними. Т-клетки.[3] Активация p53 также рассматривается как необходимый механизм для развития TNT, поскольку нижележащие гены регулируются с помощью p53 (а именно EGFR, Акт, PI3K, и mTOR ) были вовлечены в формирование нанотрубок после пероксид водорода лечение и сывороточное голодание.[17] Коннексин-43 показал, что способствует связи между стромальные клетки костного мозга (BMSC) и альвеолярный эпителиальные клетки, приводящие к образованию нанотрубок.[18]
Клеточный стресс от ротенон или же TNF-α также было показано, что он индуцирует образование TNT между эпителиальными клетками.[19] Воспаление от липополисахариды или же интерферон-γ показал увеличение экспрессии белков, связанных с образованием TNT.[20]
Торможение
TNT-подобные структуры, называемые стримерами, не образовывались при культивировании с цитохалазин D, F-актин деполимеризация сложный,[21] и отдельное исследование с использованием цитохалазин B обнаружено поврежденное образование тротила без разрушения существующих тротилов.[22] Латрункулин-B, другое деполимеризующее F-актин соединение, как было обнаружено, полностью блокирует образование TNT.[6] Блокировка CD38, которые были вовлечены в высвобождение митохондрий астроциты,[23] также значительно снизилось образование TNT.[24]
TNFAIP2, также называемый M-Sec, как известно, опосредует образование TNT и подавление этого белка посредством shRNA снижение выработки TNT в эпителиальные клетки примерно на две трети.[20]
Роль в митохондриальном переносе
Туннельные нанотрубки были задействованы как один механизм, с помощью которого весь митохондрии возможно переведен от ячейки к ячейке.[6] Митохондриальная ДНК повреждение, по-видимому, является основным триггером для образования TNT, чтобы транспортировать целые митохондрии,[25] хотя точный порог повреждения, необходимый для образования тротила, пока неизвестен. Максимальная скорость движения митохондрий над TNT составила около 80 нм / с, ниже измеренной скорости 100-1400 нм / с аксональный транспорт митохондрий; это могло быть связано с меньшим диаметром TNT, ингибирующим миграцию митохондрий.[26]
В одном исследовании Ахмад и другие. использовали четыре линии мезенхимальных стволовых клеток, каждая из которых экспрессировала либо отличающийся фенотип Rho-GTPase Miro1; более высокий уровень Miro1 был связан с более эффективным митохондриальный перенос через ТНТ.[19] Несколько исследований показали, посредством избирательного блокирования образования TNT, что TNT являются основным механизмом перемещения целых митохондрий между гетерогенными клетками.[27][28][29]
Подобные конструкции
Структура под названием цитонема обеспечивает обмен между центрами сигнализации. Цитонемы, однако, не всегда соединяют две клетки и могут действовать исключительно как датчики окружающей среды.[21]
Плазмодесматы были идентифицированы как функциональные каналы, соединяющие клетки растений,[30] и стромулы соединять пластиды.[31]
Миоподия представляют собой богатые актином цитоплазматические расширения, которые наблюдались у эмбриональных Дрозофила. Подобные структуры наблюдались в Xenopus и мышь модели.[10] Актин-содержащие клеточные выступы, получившие название «стримеров», наблюдались в культивируемых В-клетки.[21]
Везикулярный транспорт в мембранных нанотрубках был смоделирован с использованием континуального подхода.[32] Были исследованы различные синтетические нанотрубки, основанные на укладке циклических пептидов и других циклических молекул.[33]
Смотрите также
Рекомендации
- ^ Ранцингер Дж., Рустом А., Абель М., Лей Дж., Кихм Л., Витковски М. и др. (2011-12-27). Бересвилл С (ред.). «Действие нанотрубок между мезотелиальными клетками человека раскрывает новые аспекты воспалительных реакций». PLOS ONE. 6 (12): e29537. Bibcode:2011PLoSO ... 629537R. Дои:10.1371 / journal.pone.0029537. ЧВК 3246504. PMID 22216308.
- ^ Abounit S, Zurzolo C (март 2012 г.). «Проводка через туннельные нанотрубки - от электрических сигналов до передачи органелл» (PDF). Журнал клеточной науки. 125 (Pt 5): 1089–98. Дои:10.1242 / jcs.083279. PMID 22399801. S2CID 8433589.
- ^ а б c d Sowinski S, Jolly C, Berninghausen O, Purbhoo MA, Chauveau A, Köhler K и др. (Февраль 2008 г.). «Мембранные нанотрубки физически соединяют Т-клетки на больших расстояниях, представляя новый путь передачи ВИЧ-1». Природа клеточной биологии. 10 (2): 211–9. Дои:10.1038 / ncb1682. PMID 18193035. S2CID 25410308.
- ^ Дэвис Д.М., Совински С. (июнь 2008 г.). «Мембранные нанотрубки: динамические связи на большие расстояния между клетками животных». Обзоры природы. Молекулярная клеточная биология. 9 (6): 431–6. Дои:10.1038 / nrm2399. PMID 18431401. S2CID 8136865.
- ^ Онфельт Б., Недвецки С., Беннингер Р.К., Пурбху М.А., Совински С., Хьюм А.Н. и др. (Декабрь 2006 г.). «Структурно различные мембранные нанотрубки между человеческими макрофагами поддерживают везикулярный трафик на большие расстояния или серфинг бактерий». Журнал иммунологии. 177 (12): 8476–83. Дои:10.4049 / jimmunol.177.12.8476. PMID 17142745.
- ^ а б c d е ж Растом А., Саффрич Р., Маркович И., Вальтер П., Гердес Х. Х. (февраль 2004 г.). «Нанотубулярные магистрали для межклеточного транспорта органелл». Наука. 303 (5660): 1007–10. Bibcode:2004Научный ... 303.1007R. Дои:10.1126 / science.1093133. PMID 14963329. S2CID 37863055.
- ^ Онфельт Б., Дэвис Д.М. (ноябрь 2004 г.). «Могут ли мембранные нанотрубки облегчить связь между иммунными клетками?». Сделки Биохимического Общества. 32 (Pt 5): 676–8. Дои:10.1042 / BST0320676. PMID 15493985. S2CID 32181738.
- ^ Бельтинг М., Виттруп А. (декабрь 2008 г.). «Нанотрубки, экзосомы и пептиды, связывающие нуклеиновые кислоты, обеспечивают новые механизмы межклеточной коммуникации в эукариотических клетках: последствия для здоровья и болезней». Журнал клеточной биологии. 183 (7): 1187–91. Дои:10.1083 / jcb.200810038. ЧВК 2606965. PMID 19103810.
- ^ Гуссе К., Шифф Э., Ланжевен С., Мариджанович З., Капуто А., Бровман Д. Т. и др. (Март 2009 г.). «Прионы захватывают туннельные нанотрубки для межклеточного распространения». Природа клеточной биологии. 11 (3): 328–36. Дои:10.1038 / ncb1841. PMID 19198598. S2CID 30793469.
- ^ а б c Гурке С., Баррозу Дж. Ф., Гердес Х. Х. (май 2008 г.). «Искусство сотовой связи: туннельные нанотрубки преодолевают разрыв». Гистохимия и клеточная биология. 129 (5): 539–50. Дои:10.1007 / s00418-008-0412-0. ЧВК 2323029. PMID 18386044.
- ^ а б Рамирес-Вебер Ф.А., Корнберг ТБ (май 1999 г.). «Цитонемы: клеточные процессы, которые проецируются в главный сигнальный центр в имагинальных дисках Drosophila». Клетка. 97 (5): 599–607. Дои:10.1016 / S0092-8674 (00) 80771-0. PMID 10367889. S2CID 15789546.
- ^ Онфельт Б., Недвецкий С., Янаги К., Дэвис Д.М. (август 2004 г.). «Передний край: мембранные нанотрубки соединяют иммунные клетки». Журнал иммунологии. 173 (3): 1511–3. Дои:10.4049 / jimmunol.173.3.1511. PMID 15265877.
- ^ Шерер Н.М., Леманн М.Дж., Хименес-Сото Л.Ф., Хоренсавиц С., Пипаерт М., Мотес В. (март 2007 г.). «Ретровирусы могут устанавливать филоподиальные мостики для эффективной передачи от клетки к клетке». Природа клеточной биологии. 9 (3): 310–5. Дои:10.1038 / ncb1544. ЧВК 2628976. PMID 17293854.
- ^ Watkins SC, Salter RD (сентябрь 2005 г.). «Функциональная связь между иммунными клетками, опосредованная туннельными нанотрубочками». Иммунитет. 23 (3): 309–18. Дои:10.1016 / j.immuni.2005.08.009. PMID 16169503.
- ^ Лю К., Джи К., Го Л., Ву В., Лу Х., Шан П, Ян С. (март 2014 г.). «Мезенхимальные стволовые клетки спасают поврежденные эндотелиальные клетки в модели ишемии-реперфузии in vitro посредством туннельного переноса митохондрий, опосредованного структурой нанотрубок». Микрососудистые исследования. 92: 10–8. Дои:10.1016 / j.mvr.2014.01.008. PMID 24486322.
- ^ Sun X, Wang Y, Zhang J, Tu J, Wang XJ, Su XD и др. (Декабрь 2012 г.). «Определение направления туннелирования-нанотрубки в нейронах и астроцитах». Смерть и болезнь клеток. 3 (12): e438. Дои:10.1038 / cddis.2012.177. ЧВК 3542613. PMID 23222508.
- ^ Ван И, Цуй Дж, Сунь Х, Чжан И (апрель 2011 г.). «Развитие туннельных нанотрубок в астроцитах зависит от активации p53». Гибель клеток и дифференциация. 18 (4): 732–42. Дои:10.1038 / cdd.2010.147. ЧВК 3131904. PMID 21113142.
- ^ Ислам М.Н., Дас С.Р., Эмин М.Т., Вей М., Сун Л., Вестфален К. и др. (Апрель 2012 г.). «Перенос митохондрий из стромальных клеток костного мозга в легочные альвеолы защищает от острого повреждения легких». Природа Медицина. 18 (5): 759–65. Дои:10,1038 / нм 2736. ЧВК 3727429. PMID 22504485.
- ^ а б Ахмад Т., Мукерджи С., Паттнаик Б., Кумар М., Сингх С., Кумар М. и др. (Май 2014 г.). «Miro1 регулирует межклеточный транспорт митохондрий и повышает эффективность спасения мезенхимальных стволовых клеток». Журнал EMBO. 33 (9): 994–1010. Дои:10.1002 / embj.201386030. ЧВК 4193933. PMID 24431222.
- ^ а б Хасе К., Кимура С., Такацу Х., Омаэ М., Кавано С., Китамура Х и др. (Декабрь 2009 г.). «M-Sec способствует образованию мембранных нанотрубок, взаимодействуя с Ral и комплексом экзоцисты». Природа клеточной биологии. 11 (12): 1427–32. Дои:10.1038 / ncb1990. PMID 19935652. S2CID 1388030.
- ^ а б c Остефьорд MW, Гердес HH, Ван X (январь 2014 г.). «Туннельные нанотрубки: разнообразие морфологии и структуры». Коммуникативная и интегративная биология. 7 (1): e27934. Дои:10.4161 / cib.27934. ЧВК 3995728. PMID 24778759.
- ^ Букорештлиев Н.В., Ван Х, Ходнеланд Э., Гурке С., Баррозо Дж. Ф., Гердес Х. Х. (май 2009 г.). «Селективный блок образования туннельных нанотрубок (TNT) подавляет межклеточный перенос органелл между клетками PC12». Письма FEBS. 583 (9): 1481–8. Дои:10.1016 / j.febslet.2009.03.065. PMID 19345217. S2CID 13528434.
- ^ Хаякава К., Эспозито Э, Ван Х, Терасаки Ю., Лю И, Син С. и др. (Июль 2016 г.). «Перенос митохондрий от астроцитов к нейронам после инсульта». Природа. 535 (7613): 551–5. Bibcode:2016Натура.535..551H. Дои:10.1038 / природа18928. ЧВК 4968589. PMID 27466127.
- ^ Марлейн ЧР, Пиддок Р.Э., Мистри Дж. Дж., Зайцева Л., Хельмих С., Хортон Р. Х. и др. (Май 2019). «Торговля митохондриями, управляемая CD38, способствует биоэнергетической пластичности множественной миеломы». Исследования рака. 79 (9): 2285–2297. Дои:10.1158 / 0008-5472.CAN-18-0773. PMID 30622116.
- ^ Торральба Д., Байшаули Ф, Санчес-Мадрид Ф (2016). «Митохондрии не знают границ: механизмы и функции межклеточного митохондриального переноса». Границы клеточной биологии и биологии развития. 4: 107. Дои:10.3389 / fcell.2016.00107. ЧВК 5039171. PMID 27734015.
- ^ Ван X, Гердес HH (июль 2015 г.). «Перенос митохондрий через туннельные нанотрубки спасает апоптозные клетки PC12». Гибель клеток и дифференциация. 22 (7): 1181–91. Дои:10.1038 / cdd.2014.211. ЧВК 4572865. PMID 25571977.
- ^ Паскье Дж., Герруахен Б.С., Аль Тавади Х., Гиаби П., Малеки М., Абу-Кауд Н. и др. (Апрель 2013). «Предпочтительный перенос митохондрий от эндотелиальных к раковым клеткам через туннельные нанотрубки модулирует химиорезистентность». Журнал трансляционной медицины. 11 (1): 94. Дои:10.1186/1479-5876-11-94. ЧВК 3668949. PMID 23574623.
- ^ Лу Дж, Чжэн Х, Ли Ф, Ю Й, Чен З, Лю З и др. (Февраль 2017). «Туннелирующие нанотрубки способствуют межклеточному переносу митохондрий с последующей повышенной инвазивностью раковых клеток мочевого пузыря». Oncotarget. 8 (9): 15539–15552. Дои:10.18632 / oncotarget.14695. ЧВК 5362504. PMID 28107184.
- ^ Ли X, Zhang Y, Yeung SC, Liang Y, Liang X, Ding Y и др. (Сентябрь 2014 г.). «Митохондриальный перенос мезенхимальных стволовых клеток, индуцированных плюрипотентными стволовыми клетками, на эпителиальные клетки дыхательных путей снижает повреждение, вызванное сигаретным дымом». Американский журнал респираторной клетки и молекулярной биологии. 51 (3): 455–65. Дои:10.1165 / rcmb.2013-0529OC. PMID 24738760.
- ^ Галлахер К.Л., Бенфей П.Н. (январь 2005 г.). «Не просто еще одна дыра в стене: понимание межклеточной торговли белками». Гены и развитие. 19 (2): 189–95. Дои:10.1101 / gad.1271005. PMID 15655108.
- ^ Келер Р.Х., Цао Дж., Ципфель В.Р., Уэбб В.В., Хансон М.Р. (июнь 1997 г.). «Обмен белковых молекул через связи между пластидами высших растений». Наука. 276 (5321): 2039–42. Дои:10.1126 / science.276.5321.2039. PMID 9197266.
- ^ Кузнецов А.В. (август 2011 г.). «Моделирование двунаправленного транспорта наночастиц квантовых точек в мембранных нанотрубках». Математические биологические науки. 232 (2): 101–9. Дои:10.1016 / j.mbs.2011.04.008. PMID 21609723.
- ^ Родригес-Васкес Н., Фуэртес А., Аморин М., Гранха Дж. Р. (2016). «Глава 14. Биоинспирированные каналы искусственных ионов натрия и калия». В Astrid S, Helmut S, Roland KO S (ред.). Ионы щелочных металлов: их роль в жизни. Ионы металлов в науках о жизни. 16. Springer. С. 485–556. Дои:10.1007/978-4-319-21756-7_14 (неактивно 09.09.2020).CS1 maint: DOI неактивен по состоянию на сентябрь 2020 г. (связь)
дальнейшее чтение
- Гурке С., Баррозу Дж. Ф., Гердес Х. Х. (май 2008 г.). «Искусство сотовой связи: туннельные нанотрубки преодолевают разрыв». Гистохимия и клеточная биология. 129 (5): 539–50. Дои:10.1007 / s00418-008-0412-0. ЧВК 2323029. PMID 18386044.
- «Туннелирование нанотрубок: секретная сеть жизни». Новый ученый. Ноябрь 2008 г.
внешняя ссылка
- Исследовательская группа Ханса-Германа Гердеса - Лаборатория, впервые обнаружившая мембранные нанотрубки
